Amidasen
| Amidasen | ||
|---|---|---|
| Enzymklassifikation | ||
| EC, Kategorie | 3.5.-.-, Hydrolase | |
| Reaktionsart | hydrolytische Spaltung | |
| Substrat | Amide | |
Amidasen (auch: Amidohydrolasen) sind in der Enzymologie, einem Teilgebiet der Biochemie, Enzyme, welche eine chemische Reaktion zur Spaltung von Amidbindungen katalysieren. Die Enzyme bilden eine Unterfamilie der Hydrolasen. Sie erfüllen wichtige Funktionen in allen Lebewesen.[1]
Katalysierte Reaktionen
[Bearbeiten | Quelltext bearbeiten]Ein Monocarbonsäureamid reagiert dabei mit Wasser unter dem Einfluss einer Amidase zu einer Monocarbonsäure und Ammoniak bzw. dem Ammoniumsalz der Monocarbonsäure:
Auch manche sekundäre Amide werden von Amidasen hydrolysiert, jedoch zeigt sich hier die Stabilität der meisten Amidbindungen, die so nicht gespalten werden können:
Im besonderen Fall einer Peptidbindung heißen die spaltenden Enzyme Peptidasen, diese gehören formal nicht mehr zu den Amidasen, sondern stellen die Enzymkategorie 3.4.
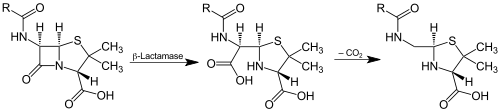
Zyklische Amidbindungen, beispielsweise in Lactamen, werden von Lactamasen gespalten, die ebenfalls zu den Amidasen gehören:
Amidasen im Menschen
[Bearbeiten | Quelltext bearbeiten]Im Menschen wurden mehrere Dutzend Amidasen identifiziert, die alle wichtige Funktionen erfüllen, darunter Ceramidasen, Histon-Deacetylasen und Sirtuine. Weitere wichtige Einzelenzyme dieser Gruppe sind die Arylformamidase, die Biotinidase, die Glutaminase und die Pantetheinase.
Pathologie
[Bearbeiten | Quelltext bearbeiten]Von acht Amidasen des Menschen sind Polymorphismen bekannt, die zu seltenen Erbkrankheiten führen können.
| Gen-Name | Amidase | OMIM | OrphaNet | Erbkrankheit |
|---|---|---|---|---|
| ACY1 | Aminoacylase-1 | 609924 | 137754 | Enzephalopathie mit assoziiertem Aminoacylase 1-Mangel (ACY1D) |
| AGA | Glykosylasparaginase | 208400 | 93 | Aspartylglukosaminurie (AGU) |
| ASAH1 | Saure Ceramidase | 228000 | Farber-Syndrom | |
| ASPA | Aspartoacylase | 271900 | 141 | Canavan-Syndrom |
| BTD | Biotinidase | 253260 | Biotinidasemangel | |
| HDAC4 | Histon-Deacetylase 4 | 600430 | 1001 | Brachydaktylie mit assoziierter geistiger Behinderung (BDMR), auch 2q37-Mikrodeletionssyndrom |
| PIGL | N-Acetylglucosaminyl-N-deacetylase | 280000 | CHIME-Syndrom | |
| UPB1 | Beta-Ureidopropionase | 613161 | 65287 | Beta-Ureidopropionase-Mangel (BUPD) |
Technische Anwendung zur Racematspaltung
[Bearbeiten | Quelltext bearbeiten]Das Enzym L-Acylase zählt auch zu den Amidasen. Es findet technische Anwendung bei der Racematspaltung von Aminosäuren.[2] Aus der Acetylierung der Aminogruppe der racemischen Aminosäure DL-Methionin mit Essigsäureanhydrid resultiert N-Acetyl-DL-methionin (RS)-1, ein 1:1-Gemisch aus (S)-1 und (R)-1. Enantiospezifisch wird dann unter katalytischen Einfluss der L-Acylase die Acetylgruppe des N-Acetyl-L-methionins (S)-1 abgespalten, es entsteht L-Methionin (S)-2 und Essigsäure. Das N-Acetyl-D-methionin (R)-1 bleibt unverändert:
Dieses Verfahren wird auch kinetische Racematspaltung genannt. Nach demselben Trennprinzip ist die Racematspaltung vieler anderer α-Aminocarbonsäuren möglich.
Literatur
[Bearbeiten | Quelltext bearbeiten]- InterPro: Amidase
- Lexikon der Biochemie, Spektrum Akademischer Verlag
- K. Drauz, H. Gröger, O. May (Ed.): Enzyme Catalysis in Organic Synthesis, Volume 1. Wiley, 2012 (Volltext in der Google-Buchsuche).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 450, ISBN 978-3-906390-29-1.
- ↑ Chibata I, Tosa T: Use of immobilized cells. In: Annu. Rev. Biophys. Bioeng. 10. Jahrgang, 1981, S. 197–216, doi:10.1146/annurev.bb.10.060181.001213, PMID 7020575 (englisch).


