Cobalamine
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
| Adenosylcobalamin (AdoCbl, Coenzym B12): R = 5′-Desoxyadenosyl Cyanocobalamin: R = –C≡N Aquocobalamin (Vitamin B12a): R = –OH2 Hydroxycobalamin (Vitamin B12b): R = –OH Methylcobalamin (MeCbl, MeB12): R = –CH3 Nitritocobalamin (Vitamin B12c): R = –O–N=O | |||||||||
| Allgemeines | |||||||||
| Trivialname | Vitamin B12 | ||||||||
| Andere Namen |
| ||||||||
| Summenformel |
| ||||||||
| CAS-Nummer |
| ||||||||
| PubChem | 16072210 | ||||||||
| ATC-Code | |||||||||
| DrugBank | DB00115 | ||||||||
| Kurzbeschreibung | roter, kristalliner Feststoff (Cyanocobalamin, Hydroxocobalamin, Methylcobalamin) | ||||||||
| Vorkommen | tierische Produkte (Adenosylcobalamin, Hydroxocobalamin, Methylcobalamin), Dickdarm (durch bakterielle Produktion) | ||||||||
| Physiologie | |||||||||
| Funktion | Zellteilung, Blutbildung, Funktion des Nervensystems | ||||||||
| Täglicher Bedarf | 4 µg[1] | ||||||||
| Folgen bei Mangel | Perniziöse Anämie, neurologische Erkrankungen (z. B. funikuläre Myelose), Glossitis, Diarrhöen | ||||||||
| Überdosis | nicht bekannt | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | |||||||||
| Aggregatzustand | fest | ||||||||
| Schmelzpunkt |
zersetzt sich ab 392 °C (Cyanocobalamin) | ||||||||
| Löslichkeit | wenig löslich in Wasser: 12 g·l−1 (Cyanocobalamin), 20 g·l−1 (Hydroxocobalamin), unlöslich in Ether, Aceton und Chloroform (Cyanocobalamin), löslich in Alkohol (Cyanocobalamin) | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Toxikologische Daten | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Cobalamine sind chemische Verbindungen, die in allen Lebewesen vorkommen und auch als Vitamin-B12-Gruppe (vereinfachend Vitamin B12) bezeichnet werden. Der wichtigste Vertreter aus der Cobalamin-Gruppe ist das umgangssprachlich ebenfalls als Vitamin B12 bezeichnete Adenosylcobalamin, welches auch als Coenzym B12 bekannt ist. Es ist als Kofaktor (Coenzym) Teil mehrerer Enzyme. Beim Menschen sind zwei Cobalamin-abhängige Enzyme bekannt, die am Stoffwechsel der Aminosäuren teilnehmen. Cobalamine enthalten das Spurenelement Cobalt als Zentralatom.[4][5]
Zur Vitamin-B12-Gruppe gehören auch die Speicherformen
- Aquocobalamin bzw. Aquacobalamin (Vitamin B12a, die konjugierte Säure des Hydroxocobalamins),[6]
- Hydroxocobalamin bzw. Hydroxycobalamin (Vitamin B12b) und
- Nitritocobalamin (Vitamin B12c).
Die Medizin verwendet die biologisch inaktiven Formen Cyanocobalamin und Hydroxocobalamin zur Vitamin-B12-Supplementierung und für andere therapeutische Zwecke. Im menschlichen Organismus werden diese Vorstufen in 5-Desoxyadenosylcobalamin und Methylcobalamin umgewandelt. Beide sind als Coenzyme biologisch aktiv.[6]
Definitionen
[Bearbeiten | Quelltext bearbeiten]Das Lexikon der medizinischen Laboratoriumsdiagnostik definiert Vitamin B12 als „wasserlösliches, nur in tierischen Lebensmitteln enthaltenes Vitamin.“[6] Hierbei wird „Vitamin B12 oder Cobalamin“ als eine Gruppe eng verwandter Moleküle bezeichnet, die als charakteristisches Strukturelement ein Corrinringsystem mit zentral gebundenem Kobaltatom enthalten.[6] Cyanocobalamin wird manchmal speziell für den Begriff „Vitamin B12“ verwendet.
Forschungsgeschichtlich bedingte Synonymbezeichnungen des Vitamin B12 sind Antiperniziosa-Faktor und Extrinisic-Faktor.[6] Die Definition des Pschyrembel betont die Beteiligung der Vitamingruppe an der Zellteilung, der Erythropoese und der Myelinbildung.[7]
Die International Union of Nutritional Sciences (IUNS) und die International Union of Pure and Applied Chemistry (IUPAC) geben an, dass „Vitamin B12“ als allgemeine Beschreibung für alle Corrinoide verwendet werden sollte, die qualitativ die biologische Aktivität von Cyanocobalamin aufweisen.[8] Die Europäische Behörde für Lebensmittelsicherheit (EFSA) beschreibt allgemeiner, dass „Vitamin B12“ alle Corrinoide mit biologisch qualitativer Aktivität des Cobalamins umfasst.[9]
In PubChem steht Vitamin B12 synonym für das Cyanocobalamin,[10] ebenso in verschiedener Fachliteratur.
Nicht zu verwechseln mit den eigentlichen Cobalaminen sind die Transcobalamine, bei denen es sich lediglich um Transportproteine für Vitamin B12 handelt.
Pseudovitamin B12
[Bearbeiten | Quelltext bearbeiten]Neben den metabolisch verwertbaren Vitamin B12-Vitameren gibt es Cobalaminanaloga, die keine biologische Aktivität im Menschen aufweisen.[11] In der Literatur werden diese als Pseudovitamin B12 bezeichnet, sie und echtes Vitamin B12 unterscheiden sich im 5. Liganden (5,6-Dimethylbenzimidazol, siehe Abschnitt „Beschreibung“). So trägt das von Cyanobakterien synthetisierte Pseudovitamin B12 dort eine Adeningruppe als Base. Daneben wurden weitere physiologisch unwirksame Analoga wie Cobinamid identifiziert oder bei denen der 5. Ligand ersetzt ist durch Kresol, 2-Methyladenin, 2-Methyl-S-adenin oder 5-Hydroxybenzimidazol.[11]
Mikroorganismen wie Cyanobakterien können diese Formen als Cofaktor verwenden. Teilweise können sie auch Pseudovitamin B12 in Vitamin B12 überführen.
Die im Menschen unwirksamen Formen werden moderat an den intrinsischen Faktor gebunden, der für die Aufnahme von Vitamin B12 nötig ist. Dadurch besteht die Gefahr, dass sie die Aufnahme von echtem Vitamin B12 blockieren. Bei der Lebensmittelanalyse besteht kein Standardverfahren, um bioverfügbares Vitamin B12 von dessen unwirksamen Analoga zu unterscheiden. Daher gibt es für Verbraucher derzeit keinen wirksamen Schutz vor falsch-positiven Mengenangaben bei Lebensmitteln.[11]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Nachdem schon Anfang der 1920er Jahre der US-amerikanische Pathologe George H. Whipple entdeckt hatte, dass Hunde, die an perniziöser Anämie (bösartige Blutarmut) litten, durch Fütterung mit roher Leber von dieser sonst tödlich verlaufenden Krankheit geheilt werden konnten, führte die Suche nach der essenziellen Komponente dieser Heilmethode schließlich 1926 zur Beschreibung eines auch beim Menschen wirksamen Antiperniziosa-Faktors durch die beiden US-amerikanischen Ärzte George R. Minot und William P. Murphy,[12] die dafür zusammen mit Whipple 1934 den Nobelpreis für Medizin erhielten.
Die Isolierung des Wirkstoffs in kristalliner Form gelang erst 1948, und das unabhängig voneinander sowohl einem Team amerikanischer Biochemiker um Karl A. Folkers (MSD),[13][14] als auch einem britischen Forscherteam um den Chemiker E. Lester Smith (Glaxo).[15] Die rot-kristalline Verbindung wurde „Vitamin B12“ genannt. Noch im selben Jahr wurde Vitamin B12 in Milchpulver, in Rindfleischextrakt und Flüssigkulturen verschiedener Bakteriengattungen gefunden.[16] In den 1950er Jahren bot das Unternehmen Pharmazell den Wirkstoffkomplex T-Vitamin Goetsch, zusammengesetzt aus „Vitamin B12, Folsäure, folinic acid, Bulgaricus Faktor und anderen noch unidentifizierten Stoffen“ an, der die elementaren Zellfunktionen der Nukleinsäure und Proteinsynthese sowie die Energiegewinnung fördern sollte.[17]
Das Unternehmen Cassella Farbwerke Mainkur hatte in den 1950er Jahren ein die zur Vitamin B-12-Gruppe gehörende Kobaltverbindung Methylcobalamin enthaltendes Präparat namens Cobaltin forte als Arzneimittel „bei Anämien verschiedenster Genese“ angeboten.[18][19]
Im Jahr 1955 konnte die britische Biochemikerin Dorothy C. Hodgkin mit Hilfe der Röntgenbeugung an Cyanocobalamin-Einkristallen deren Molekülstruktur aufklären, wofür sie u. a. 1964 mit dem Nobelpreis für Chemie geehrt wurde.[20][21]
Um 1956 glaubte man im Cyanocobalamin das Vitamin B12 gefunden zu haben, was angesichts seiner Verwendung in wirksamen Vitaminpräparaten zur Begriffsverwirrung beitrug, obwohl es tatsächlich eine biologisch inaktive Form ist.[22][23]
Die darauf aufbauende Totalsynthese des Cyanocobalamins, damals als „das Vitamin B12“ verstanden, gelang 1972 Albert Eschenmoser und Robert B. Woodward[24] und noch heute gilt diese Vitamin B12-Form als eines der größten jemals in einem Labor totalsynthetisierten Moleküle.
Beschreibung
[Bearbeiten | Quelltext bearbeiten]

Cobalamine sind organometallische Verbindungen mit einem zentralen ein-, zwei- oder dreifach positiv geladenen Cobalt-Ion und als solche die bisher einzigen bekannten cobalthaltigen Naturstoffe. Natürliche vorkommende Cobalamine mit Vitamin-B12-Wirkung sind das Adenosylcobalamin, das Methylcobalamin und das Hydroxocobalamin. Cyanocobalamin ist hingegen die industriell hergestellte, stabile Cobalamin-Form, die in der Natur nicht vorkommt.[9]
Alle Cobalamine besitzen dieselbe Grundstruktur eines Cobaltkomplexes, in dem das Cobaltkation von fünf Stickstoffatomen und einem sechsten, i. d. R. austauschbaren Liganden umgeben ist, siehe nebenstehende Abbildung. Vier der Stickstoffatome gehören zu einem ebenen Corrin-Ringsystem (blau markiert), das das Cobaltkation so fest umschließt, dass es nur durch Zerstörung des Ringsystems wieder herausgelöst werden kann, während das fünfte Stickstoffatom zu einem nucleotidartig an den Corrinring gebundenen 5,6-Dimethyl-benzimidazol-Ring gehört.
Namensgebend für das jeweilige Cobalamin indes ist der sechste, austauschbare Ligand, der in den chemischen Strukturformeln meist mit R (für Rest) abgekürzt wird: Ist R eine Hydroxygruppe, handelt es sich bei dem Cobalamin um Hydroxycobalamin, ist R eine Cyanogruppe, um Cyanocobalamin, und bei einem 5'-Desoxyadenosylliganden als Rest um 5'-Desoxyadenosylcobalamin, kurz Coenzym B12.
Meist ist der sechste Ligand R nur schwach an das Cobaltkation gebunden, so dass er leicht durch andere Liganden austauschbar ist und der menschliche Organismus zum Beispiel das therapeutisch eingesetzte Hydroxycobalamin oder Cyanocobalamin (Vitamin B12) durch Austausch der Hydroxy- gegen eine Cyanogruppe und dieser wiederum gegen eine 5'-Desoxyadenosylgruppe in das eigentlich biochemisch aktive Coenzym B12 umwandeln kann.
Cyanocobalamin selbst ist eine geruchlose, tief dunkelrote, kristalline hygroskopische Substanz, die sich nur mäßig in Wasser und niederen Alkoholen, dagegen gar nicht in (apolaren) organischen Lösungsmitteln wie Aceton, Chloroform oder Ether löst.
Im leicht sauren pH-Bereich von 4–6 ist Vitamin B12 recht temperaturstabil. In basischen Lösungen oder in Gegenwart von Reduktionsmitteln wie Ascorbinsäure (Vitamin C) und SO2 können jedoch größere Verluste auftreten.[25] So wurde die Halbwertszeit von Vitamin B12 bei einem pH-Wert von 5,5 und 30-mal so viel Vitamin C in Dunkelheit auf unter 15 Stunden bestimmt (Classic Mineralwasser hat pH 5,5 und Multivitamin-Tabletten enthalten teils 32 000-mal so viel Vitamin C wie B12).[26]
In der Zelle kommen Cobalamine im Cytosol vor allem als Methylcobalamin, in den Mitochondrien dagegen überwiegend als 5'-Desoxyadenosylcobalamin (Coenzym B12) vor. Die Abbildung oben zeigt die allgemeine Strukturformel der Cobalamine mit R als austauschbarem Liganden.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Für die chemische Reindarstellung von Vitamin B12 aus Streptomyces-Kulturen oder aus Leber wird Cyanid hinzugesetzt.[27] Die chemische Synthese von Vitamin B12 ist wegen der Komplexität der Cobalamine sehr aufwendig. Supplemente für den menschlichen Verzehr oder zum Einsatz in Tiernahrung (Geflügel und Schweine) werden daher meist mittels gentechnisch veränderten Mikroorganismen hergestellt.[28] Da lediglich das gereinigte Endprodukt auf den Markt kommt, besteht hierfür keine Kennzeichnungspflicht.
Funktion im Organismus
[Bearbeiten | Quelltext bearbeiten]Vereinfachend zusammengefasst ist Vitamin B12 wichtig für die Zellteilung und Blutbildung sowie die Funktion des Nervensystems. Vitamin B12 nimmt im humanen Organismus als Coenzym an nur zwei enzymatischen Reaktionen teil:
- N5-Methyl-Tetrahydrofolat-Homocystein-S-Methyltransferase (Methionin-Synthase, EC 2.1.1.13) und
- Methylmalonyl-CoA-Mutase (EC 5.4.99.2)
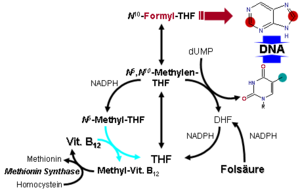
Die Reaktion der Methionin-Synthase dient u. a. der Regeneration des Methylgruppenüberträgers S-Adenosylmethionin (SAM) bzw. der Bildung von Methionin. Dabei wird Homocystein zum Methionin remethyliert. Gelingt dies nicht, bildet sich vermehrt Homocystein, ein Zwischenprodukt beim Abbau der Aminosäure Methionin. Als Methylgruppendonator fungiert dabei N5-Methyl-Tetrahydrofolat (N5-Methyl-THF). Fehlt Coenzym B12, so reichert sich N5-Methyl-THF an und es kommt zu einem sekundären Mangel an THF, welches für die Synthese der Purinbasen Adenin und Guanin und der Pyrimidinbase Thymin erforderlich ist. Durch einen Mangel an diesen Nukleobasen ist die Synthese insbesondere von DNA aber auch RNA gestört. Dies äußert sich vorrangig in Organen mit hoher Zellteilungsaktivität wie dem Knochenmark. Es kommt zu einer mehr oder minder ausgeprägten Panzytopenie im Blut, wobei der Mangel an Erythrozyten – die Anämie – am offensichtlichsten ist. Die verbleibenden Erythrozyten werden mit Hämoglobin so stark angereichert, dass sie einen höheren Hämoglobingehalt als normale Erythrozyten haben. Auch sind diese Zellen etwas größer. Daher spricht man von einer hyperchromen, makrozytären Anämie. Durch die Gabe von Folsäure kann dieser Block umgangen werden, jedoch löst dieser Ansatz nicht den zugrundeliegenden Vitamin-B12-Mangel, so dass die Behandlung der perniziösen (wörtl. gefährlich) oder megaloblastären Anämie bei Vitamin-B12-Mangel mit Folsäure einen Kunstfehler darstellt.

Der Grund hierfür ist die zusätzliche Funktion des Vitamin B12 in der Methylmalonyl-CoA-Mutase. Diese dient der Einschleusung des terminalen Propionyl-CoAs ungeradzahliger Fettsäuren, sowie Teilen des Kohlenstoffgerüstes der Aminosäuren Valin, Isoleucin, Threonin und Methionin in den mitochondrialen Citratzyklus. Das im Rahmen des Abbaus dieser Verbindungen aus Propionyl-CoA (in einem Biotin-abhängigen Schritt) gebildete Methylmalonyl-CoA wird durch die Vitamin-B12-abhängige Methylmalonyl-CoA-Mutase zu Succinyl-CoA, einem Zwischenprodukt des Citratcyclus, umgesetzt.
Ist dieser Schritt gehemmt, kommt es zu einem Anstieg von Methylmalonsäure im Plasma und vor allem im Urin. Dieser Stoffwechselweg spielt offenbar eine besondere Rolle im ZNS, da sich ein Vitamin-B12-Mangel bisweilen sogar vor der typischen Anämie mit Symptomen wie z. B. der funikulären Myelose, einer Störung der Pyramidenbahn und der Hinterstränge, aber auch scheinbaren Altersdemenzen und anderem bemerkbar macht. Daher sollte insbesondere bei älteren Patienten mit neurologischer Symptomatik ein Vitamin-B12-Mangel als mögliche (Mit-)Ursache ausgeschlossen und ggf. behandelt werden. Erste neurologische Symptome äußern sich als so genannte Polyneuropathie in Form von Kribbelparästhesien oder anderen Missempfindungen (z. B. leichtes Brennen) in verschiedenen Körperregionen, die anfangs nur vorübergehend sind.
Aufnahme und Speicherung
[Bearbeiten | Quelltext bearbeiten]In der Nahrung liegt Vitamin B12 an Proteinen gebunden vor und wird größtenteils im Magen mit Hilfe der Magensäure sowie proteolytischer Enzyme wie Pepsin herausgelöst.[9] In dieser Form bindet es an das im Magen freigesetzte Glykoprotein Haptocorrin. Dieser Komplex wandert in den Zwölffingerdarm. Dort wird Vitamin B12 mittels proteolytischen Enzymen und nach Neutralisation durch aus der Bauchspeicheldrüse stammende Bicarbonate wieder freigesetzt.
Der Intrinsische Faktor (IF) nimmt das Vitamin auf, der Komplex ist gegenüber Peptidasen stabil und gelangt schließlich ins Ileum. Durch spezifische Rezeptoren (Cubilin) wird dort die Aufnahme via Endozytose in die Enterozyten der Darmschleimhaut vermittelt.[29] Dieser Vorgang benötigt Energie und findet in der Anwesenheit von Calciumionen und in einem schwach saurem Milieu (pH >6) statt. Gemäß EFSA werden etwa 40 % des in der Nahrung enthaltenen Vitamin B12 absorbiert.[9] Über IF können etwa 2 µg Vitamin B12 pro Mahlzeit aufgenommen werden.[29] Werden über Nahrungsergänzungsmittel höhere Dosen zugeführt, wird das Vitamin auch passiv unspezifisch über die Mundschleim- oder Darmschleimhaut absorbiert. Dies erfolgt wesentlich weniger effizient (1–2 %) als die IF-abhängige Absorption.[29]
In den Lysosomen der Enterozyten wird Vitamin B12 durch proteolytische Spaltung freigesetzt. Im Cytoplasma bindet es an die Methionin-Synthase in Form von Methylcobalamin, in den Mitochondrien an die Methylmalonyl-CoA-Mutase als Adenosylcobalamin.[29] Ins Blut gelangt Vitamin B12 hauptsächlich in Form von Methylcobalamin.[9]
Im Blut wird das Cobalamin an die Cobalamin-bindende Proteine Transcobalamin (TC, 10–30 %) oder Haptocorrin (70–90 %) gebunden.[9] Ersteres geschieht an der Ileumzelle, es bildet sich Holotranscobalamin (Holo-TC), welches Vitamin B12 schnell an die Zielzellen transportiert. Holo-TC besitzt eine kurze Halbwertszeit von 1–1,5 Stunden, nur in Form von Holo-TC kann Cobalamin in die insbesondere wachsenden Zellen aufgenommen werden. Dies erfolgt durch Endozytose mit Hilfe eines spezifischen, Calciumionen-abhängigen Transcobalaminrezeptor (TCblR) – dieser kommt im Körper überall vor. In manchen Gewebe wie z. B. den Nieren oder Darm, kann auch Megalin das Holo-TC aufnehmen.
Haptocorrine wurden früher auch als Transcobalamin I und III bezeichnet, sie sind größtenteils mit Cobalamin, aber auch metabolisch inerten Analoga gesättigt.[9] Ihre Halbwertszeit beträgt 9–10 Tage und sie üben eine Speicherfunktion aus. Denn die größten Vitamin B12-Speicher sind neben den Nieren (durch Megalin vermittelte Aufnahme Holo-TCs) die Leber (etwa 50 %, durch Asialoglycoproteinrezeptoren vermittelte Aufnahme Haptocorrins); in die Leberzellen erfolgt die Aufnahme ausschließlich durch Haptocorrine.[9]
Vitamin B12 gelangt kontinuierlich mit Gallenflüssigkeit in den Dünndarm, es werden täglich etwa bis zu 1,5 % des im Körper gespeicherten Vitamins abgegeben. Mit Hilfe des IF wird es größtenteils wieder reabsorbiert, der Rest wird durch den Kot ausgeschieden. Schätzungsweise 1–2 ‰ des Vitamin B12-Pools gehen so täglich verloren.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]| Lebensmittel | Gehalt in µg/100 g (siehe Hinweis[34][35]) |
|---|---|
| Rinderleber | 65 |
| Kalbsleber | 60 |
| die Alge Spirulina maxima[34] | (57) |
| Schweineleber | 40 |
| Kalbsniere | 25 |
| Hühnerleber | 20 |
| Schweineniere | 15 |
| Austern | 14,6 |
| Hering | 11 |
| Makrele | 9 |
| Rindfleisch (Muskel) | 5,0 |
| Thunfisch | 4,3 |
| Camembert 30 % Fett i. Tr. | 3,1 |
| Lachs | 2,9 |
| Steppengrille[36] | 2,9 |
| Emmentaler 45 % Fett i. Tr. | 2,2 |
| Hühnereigelb | 2,0 |
| Totentrompete (Wildform)[37] | 1,8–2,7 |
| Echter Pfifferling (Wildform)[37] | 1,1–1,8 |
| Aal | 1 |
| Blutwurst | 1 |
| Schweinefleisch (Muskel) | 0,8 |
| Speisequark 20 % Fett i. Tr. | 0,8 |
| Kabeljau | 0,5–0,8 |
| Kuhmilch 3,5 % Fett | 0,4 |
| Sojasauce | 0,3 |
| Tempeh | 0,3 |
| Ingwer | 0,16 |
| Hühnereiweiß | 0,1 |
| Gemüse | 0,01 |
| Sauerkraut | 0 |
Cobalaminquellen
[Bearbeiten | Quelltext bearbeiten]Tiere sind nicht in der Lage, Vitamin B12 selbst herzustellen. Vitamin B12 wird in der Natur von Mikroorganismen – insbesondere Bakterien, aber auch Archaeen – produziert,[38] die als Symbionten sowohl im Verdauungstrakt von Tieren als auch auf der Oberfläche pflanzlicher Wirte (z. B. Leguminosen) vorkommen.[33]
Im menschlichen und tierischen Organismus wird Vitamin B12 vor allem in Leber und Niere akkumuliert, in Pflanzen kann es nur in Spuren vorkommen.[6] In höheren Pflanzen kommt Vitamin B12 vor allem in den Wurzeln vor, in den grünen Teilen dagegen fast nicht.[39]
Alles- und Fleischfresser decken ihren B12-Bedarf durch den Konsum von Fleisch, insbesondere Innereien. Geflügelarten und Schweine können das in ihrem Darm produzierte B12 nur unzureichend resorbieren und sind daher auf eine exogene Versorgung über ihr Futter angewiesen.[40] In der Schweinemast wird dem Futter hierfür entweder Fischmehl oder Vitamin B12 zugesetzt; letzteres in einer Dosierung von 10 µg pro kg Futter.[41] Auch im menschlichen Dickdarm kommen Bakterien vor, die Vitamin B12 produzieren. Allerdings reicht diese Synthese zur Bedarfsdeckung nicht aus und das dort gebildete Vitamin wird überwiegend mit dem Stuhl ausgeschieden.
Bei Wiederkäuern wird das Vitamin im Pansen, bei anderen Pflanzenfressern im Dickdarm gebildet.[42] Ein Mangel bei Wiederkäuern beruht in der Regel auf unzureichender Cobaltzufuhr.[40] In der Tierproduktion wird dem Futter in Spuren Cobalt hinzugefügt, falls die Tiere von cobaltarmen Weideflächen ernährt werden müssen. Hierüber soll Wachstums- und Laktationsstörungen, Blutarmut und Appetitlosigkeit entgegengewirkt werden.[43] Einige Arten von Pflanzenfressern können durch Aufnahme ihres Blinddarmkots Vitamin B12 zuführen. Der Kot ist reich an Vitaminen des B-Komplexes und Vitamin K. Das Verhalten wird Caecotrophie genannt und ist unter anderem von Nagetieren (Rodentia) und Hasenartigen (Lagomorpha) bekannt. Hindert man Kaninchen an der Aufnahme ihres Blinddarmkots, sinkt die Ausnutzung an Nährstoffen einschließlich Vitaminen aus dem Futter.
Cobalamingehalt einiger Lebensmittel
[Bearbeiten | Quelltext bearbeiten]Vitamin B12 ist in fast allen Nahrungsmitteln tierischer Herkunft (auch Eiern und Milchprodukten) zumindest in nennenswerten Mengen enthalten.[29] Im Vergleich zu Kuhmilch (0,4 µg/100 g) enthält Muttermilch nur durchschnittlich 0,05 µg/100 g.[44] Andere Quellen sind vitaminsupplementierte Nahrungsmittel und Nahrungsergänzungsmittel.[45] Das in der Nahrung enthaltene Vitamin B12 wird bei der Zubereitung nicht zerstört.[46]
Nach etablierter Fachmeinung enthält keine pflanzliche Nahrung für den menschlichen Bedarf ausreichende Mengen der verwertbaren Form des Vitamins.[6][47] Wenn diese Lebensmittel trotzdem Spuren an Vitamin B12 enthalten, sind sie mit Vitamin B12-produzierenden Bakterien kontaminiert.[46] Manche Nahrungsmittel wie Spirulina[48] oder AFA-Algen[49] enthalten große Mengen an biologisch unwirksamem Pseudovitamin B12.[45] Chlorella biosynthetisiert selbst nicht Vitamin B12, sondern nimmt es aus der Umgebung auf, beispielsweise von vergesellschafteten Bakterien.[50] Daher können die Gehalte bei Chlorella-Supplemente erheblich schwanken,[50] die Gehaltsangaben sind zudem nicht immer zuverlässig.[51] Ob das in den Produkten vorhandene Vitamin B12 für den Menschen bioverfügbar und nutzbar ist, ist nach Angaben in der Literatur nicht eindeutig.[51][11]
Durch Milchsäuregärung haltbar gemachte Gemüse und Leguminosen – wie etwa Erbsen, Bohnen und Lupinen – und Zingiberales wie Ingwer besitzen einen, wenn auch geringen, Gehalt an Vitamin B12.[30] Aktuell gibt es jedoch zu wenige oder gar keine Belege, dass fermentierte Nahrungsmittel einen ausreichenden B12-Status aufrechterhalten können.[45]
Auf der Suche nach möglicherweise geeigneten Vitamin-B12-Quellen für Vegetarier, die auch Vitaminsupplementierung meiden, stießen Watanabe et al. auf die Koreanische Rotalge (Porphyra sp.). Nach einer 2014 veröffentlichten Berechnung der Autoren könnte der tägliche Konsum von 4 g der getrockneten Meeresalge, die in dieser Form auch unter der kulinarischen Bezeichnung Nori bekannt ist, einen Vitaminbedarf in Höhe von 2,4 µg decken. Diese Aussage beruht auf Daten aus einer In-vitro-Verdauungssimulation von getrocknetem Porphyra sp., die bereits im Jahr 2009 publiziert wurden. Um die Bioaktivität des Cobalamin aus Nori zu belegen, wurde 2001 ein Tierversuch mit gefriergetrocknetem Porphyra yezoensis publiziert.[52] Bereits 1991 veröffentlichten Dagnelie et al. Tests mit Nori, Spirulina und fermentierter pflanzlicher Nahrung an Vitamin-B12-defizitären Kindern und beobachteten eine weitere Erhöhung des mittleren Erythrozyteneinzelvolumens. Die Autoren schlossen daraus, dass die Bioverfügbarkeit des Cobalamins aus diesen Quellen fraglich sei. Sie fanden es ungerechtfertigt, Algen und „andere pflanzliche Nahrung“ als eine sichere Vitamin-B12-Quelle zu empfehlen.[53] Die Übersichtsarbeit von Rizzo et al. aus dem Jahr 2016 bewertete die vorliegenden in-vitro-Tests als vielversprechend, wies jedoch gleichzeitig darauf hin, dass ausreichende Humanstudien fehlen, um die Nutzung von Algen in der Versorgung mit Vitamin B12 als vorteilhaft zu betrachten.[54]
Der Vitamin B12-Gehalt getrockneter Shiitake-Fruchtkörper schwankt erheblich, er liegt durchschnittlich bei ca. 5,6 µg pro 100 g Trockenmasse. Die Schwankungen begründen sich damit, dass der Pilz das Vitamin nicht selbst herstellen kann, sondern aus der Umwelt aufnehmen muss. Als eigentliche Vitamin-Quelle werden B12-produzierende Bakterien vermutet, die mit dem Pilz in Kontakt kommen.[50] Watanabe et al. schätzen ein, dass die Aufnahme von etwa 50 g getrockneter Shiitake-Fruchtkörper einen Vitamin-B12-Tagesbedarf für Erwachsene in Höhe von 2,4 μg decken könnte. Allerdings bewerten die Autoren die Aufnahme solch großer Mengen dieser Pilzfruchtkörper auf einer täglichen Basis als nicht praktikabel.[52]
Bedarf
[Bearbeiten | Quelltext bearbeiten]| Altersgruppe | Schätzwerte für eine angemessene Zufuhr (D-A-CH, 2018)[1] |
Adequate Intake (AI) (EFSA, 2015)[9] |
Recommended Daily Allowance (RDA) (USA, 1998)[56] |
|---|---|---|---|
| Säuglinge (bis 12 Monate) | 0,5–1,4 | 1,5 (7–11 Monate) | 0,4–0,5 (AI) |
| Kleinkinder (1 bis <3 Jahre) | 1,5 | 1,5 | 0,9 (1–3 J.) |
| Kleinkinder (4 bis <7 Jahre) | 2,0 | 1,5 | 1,2 (4–8 J.) |
| Kinder (7 bis <10 Jahre) | 2,5 | 2,5 (7–10 J.) | |
| Kinder (10 bis <13 Jahre) | 3,5 | 3,5 (11–14 J.) | 1,8 (9–13 J.) |
| Jugendliche (13 bis <15 Jahre) | 4,0 | 3,5 | |
| Adoleszente (15 bis <19 Jahre) | 4,0 | 4,0 (15–17 J.) | 2,4 (14–18 J.) |
| Erwachsene (≥19 Jahre) | 4,0 | 4,0 (≥18 J.) | 2,4 (≥19 J.) |
| Schwangere | 4,5 | 4,5 | 2,6 |
| Stillende | 5,5 | 5,0 | 2,8 |
Der tägliche Bedarf kann derzeit nur geschätzt werden.[57] Die Schätzwerte für eine angemessene Zufuhr sind viel geringer als bei den meisten anderen Vitaminen und liegen im µg-(Mikrogramm-)Bereich (vgl. Tabelle).
Die biologische Halbwertszeit des Vitamins B12 beträgt 450–750 Tage. Das Vitamin wird ständig mit Gallensäuren in den Dünndarm abgegeben und an dessen Ende – dem terminalen Ileum – mithilfe des intrinsischen Faktors wieder aufgenommen. Der Bedarf ergibt sich also aus den Mengen, die im Ileum nicht wieder rückresorbiert werden konnten. Falls es zur Störung bei der Bildung des intrinsischen Faktors kommt, kann das Vitamin nur in geringen Mengen aufgenommen oder rückresorbiert werden, wodurch sich die Speicher im Organismus schneller leeren. Die meisten Fälle von Mangel an Vitamin B12 werden durch Störungen bei der Bildung des intrinsischen Faktors verursacht. Wie lange das gefüllte Depot ausreicht, kann daher bei Patienten nach erfolgter Gastrektomie abgeschätzt werden – diese bilden keinen intrinsischen Faktor mehr, wodurch sie die Fähigkeit zur Vitamin B12-Aufnahme aus der Nahrung verloren haben. Bei ihnen manifestiert sich ein Mangel (megaloblastäre Anämie) nach 2 bis 5 Jahren.[46]
Während in der Leber gesunder Erwachsene 2000–3000 µg Vitamin B12 gespeichert sind,[9] enthält die eines gut ernährten Neugeborenen nur 25–30 µg des Vitamins.[58] Generell haben Säuglinge geringe Vitamin B12-Reserven.[59] Gestillte Kinder von Frauen, die sich vegan ernähren und nicht ausreichend supplementieren, und deren Muttermilch deshalb arm an Vitamin B12 ist, entwickeln ohne Zufütterung tierischer Lebensmittel oder von Präparaten meist im zweiten Lebenshalbjahr Symptome eines Mangels.[59] Die bei vegetarischer Ernährungsweise typischerweise hohe Folsäurezufuhr vermag die hämatologischen Symptome einer Vitamin-B12-Unterversorgung zu überdecken, so dass der Mangel bis zum Auftreten neurologischer Symptome unentdeckt bleiben kann.[60] Auch bei veganer Ernährung manifestieren sich Defizite unter Umständen erst nach einigen Jahren, pflanzliche Lebensmittel decken nicht den Vitamin B12-Bedarf.[61][62] Dagegen kann die Versorgung an Vitamin B12 bei einer ovo-lakto-vegetarischen Ernährungsweise gedeckt sein.[62]
Vitamin-B12-Mangel (Hypovitaminose)
[Bearbeiten | Quelltext bearbeiten]Mangelerscheinungen
[Bearbeiten | Quelltext bearbeiten]Bei einem Mangel an Vitamin B12 kann es zur perniziösen Anämie (Perniziosa), einer Erkrankung des Blutbildes, und zur funikulären Myelose – einer Schädigung des Zentralnervensystems mit neurologischen Dysfunktionen – kommen. In den letzten Jahren mehrten sich zudem die Hinweise auf einen möglichen Zusammenhang zwischen einem Vitamin-B12-Mangel und anderen Krankheitsbildern wie z. B. Demenz und Neuropathien. Grundsätzlich sind niedrige Vitamin-B12-Konzentrationen im Blutserum bei älteren Menschen häufiger zu beobachten.
Ein Mangel kann durch unzureichende oder einseitige Zufuhr mit der Nahrung (z. B. bei veganen Ernährungsformen),[63] durch unzureichende Resorption, z. B. bei langandauernder Einnahme von Protonenpumpenhemmern zum Magenschutz,[64] oder durch erhöhten Bedarf z. B. bei Alkoholismus verursacht werden. Bei mangelhafter Aufnahmefähigkeit im Magen-Darm-Trakt fehlt dem Organismus im Magensaft der für die Vitamin-B12-Aufnahme unabdingbar intrinsische Faktor. Häufigster Grund hierfür ist altersbedingt eine chronisch atrophische Gastritis.[65] Auch eine Störung bei der Aufnahme im terminalen Ileum kann zu einem Mangel führen.
Die ersten Anzeichen von Vitamin-B12-Unterversorgung bei erwachsenen Personen können Kribbeln und Kältegefühl in Händen und Füßen, Erschöpfung und Schwächegefühl, Konzentrationsstörungen und sogar Psychosen sein. Des Weiteren kann auch Haarausfall auftreten.[66]
Typische Folgen eines Vitamin-B12-Mangels sind:
- Methylmalonat-Acidurie (fehlende Methylmalonyl-CoA-Mutase-Aktivität)
- Homocystinurie (fehlende Methionin-Synthase-Aktivität, ggf. sekundär Methionin-Mangel)
- megaloblastäre Anämie (Störung des Folsäurestoffwechsels durch Block der N5-Methyl-THF-Spaltung zu THF)
- Hypersegmentierte Leukozyten (Zeichen der Überalterung aufgrund der Syntheseprobleme)
- sensorische Neuropathie (wohl Folge der fehlenden Methylmalonyl-CoA-Mutase-Aktivität und der Anämie)
Nach einer Magenresektion oder bei einer Autoimmungastritis (A-Gastritis), bei der sich die Immunreaktion gegen die den intrinsischen Faktor bildenden Belegzellen (= Parietalzellen) richtet, ist daher die Aufnahme des Vitamin B12 – zumindest bei normalem Angebot – kaum möglich, so dass sich in der Folge ein Vitamin-B12-Mangel ausbilden kann. Auch bei einer schweren Entzündung des Ileums, insbesondere dem Morbus Crohn (Ileitis terminalis), aber auch anderen intestinalen Erkrankungen mit Malabsorptionssyndrom, oder nach Resektionen des terminalen Ileum bzw. des Magens, kommt es typischerweise zu einem Vitamin-B12-Mangel.
In diesen Fällen ist eine regelmäßige Substitution von Vitamin B12 erforderlich, wobei diese jedoch unter Umgehung des Magen-Darm-Traktes in Form von intramuskulärer, subcutaner oder selten auch intravenöser Injektion erfolgen sollte. Nur bei Gabe hoher Dosen wird Vitamin B12 auch unspezifisch im Dünndarm aufgenommen. Dabei ist jedoch die Resorptionsquote nicht vorhersehbar und daher ist eine orale Vitamin-B12-Substitution in diesen Fällen im Allgemeinen ungenügend.
Das erste wirksame Präparat zur Behandlung der perniziösen Anämie, das in den 1930er Jahren entwickelte Campolon, beruhte auf gereinigten Extrakten aus Lebern von Schlachttieren und enthielt Vitamin B12 als Hauptbestandteil. Es löste die zuvor praktizierte Leberdiät ab, bei der die Patienten täglich rohe Leber oder daraus hergestellte Speisen zu sich nehmen mussten.
Test auf Vitamin-B12-Mangel
[Bearbeiten | Quelltext bearbeiten]Allgemein verändert ein latenter Vitamin-B12-Mangel bis zu vier im Blut messbare Biomarker (Holotranscobalamin, Gesamt-B12-Spiegel, Homocystein und Methylmalonsäure), je nach Ausprägung des Mangelzustands. Der bei dauerhafter Vitamin-B12-Unterversorgung sensitivste und als erster auffällig werdende Laborwert ist hierbei der Wert für Holotranscobalamin (Holo-TC) im Serum. Insbesondere ein Holo-TC von unter 35 pmol/l weist auf einen Vitamin-B12-Mangel hin.[67] Ist nur der Holo-TC-Wert verringert, so treten in diesem Stadium noch keine klinischen oder hämatologischen Symptome auf. Die Feststellung eines Vitamin-B12-Mangels in diesem Stadium erlaubt eine Substitutionstherapie, bevor irreversible neurologische Schädigungen auftreten.[68]
Bei einem fortschreitenden Mangel können auch erhöhte Homocysteinwerte sowie erhöhte Werte für die Methylmalonsäure (MMA) auftreten. Diese Werte müssen daher in der Regel erst bei Auffälligkeit des Holo-TC-Wertes oder bei anderweitigem Verdacht auf Vitamin-B12-Mangel (bspw. bei erhöhtem Kreatinin)[69] abgeprüft werden. Jedoch können erhöhte Methylmalonsäurewerte auch im Zusammenhang mit Stoffwechselstörungen stehen, wie der Methylmalonazidurie. Wenn erhöhte Methylmalonsäurewerte noch mit erhöhten Malonsäurewerten einhergehen, kann dies für eine kombinierte Malon- und Methylmalonazidurie (CMAMMA) sprechen.[70] Der Gesamt-Vitamin-B12-Spiegel im Serum ist oft der zuletzt abfallende und dazu relativ unspezifische und unsensitive Bio-Marker zur Feststellung einer latenten Vitamin-B12-Mangelversorgung, demzufolge hat dieser Parameter für die frühzeitige Feststellung eines Vitamin-B12-Mangels nur eine begrenzte Aussagekraft.[68]
Labormethodik
[Bearbeiten | Quelltext bearbeiten]Da es keinen Goldstandard zur Bestimmung des Vitamin-B12-Status eines Menschen gibt (Stand 2013),[71] wird z. B. von der Deutschen Gesellschaft für Ernährung die Bestimmung mehrerer Marker aus dem Blutserum für die Untersuchung der B12-Versorgung empfohlen.[72]
Seit der Jahrtausendwende wird zur Bestimmung des Cobalamin-Spiegels im Blut ein CBLA-Assay durchgeführt (competitive-binding luminescence assay), der die früheren mikrobiologischen und Radioisotopen-Dilutions-Assays der 1970er Jahre abgelöst hat. Einzelfallberichte und kleinere Studien deuten darauf hin, dass diese neueren Assays bei Patienten mit perniziöser Anämie systematische Fehler aufweisen.[71] Kleine klinische Serien bestätigten, dass die Assays eine hohe Rate falsch-negativer Ergebnisse (zwischen 22 und 35 %) produzieren, d. h., in einem von drei bis fünf Fällen wird statt eines Cobalamin-Mangels fälschlicherweise ein Normalspiegel ermittelt.[73]
Überdosierung (Hypervitaminose)
[Bearbeiten | Quelltext bearbeiten]Therapeutische – meist intravenöse – Überdosen werden mit lokalen allergischen Beschwerden[74] sowie einer Form der Akne (Acne medicamentosa) in Verbindung gebracht.[75] Auch die extrem hoch dosierte Verwendung als Gegengift von bis zu 5 g (entspricht 5.000.000 µg) Hydroxocobalamin ist laut EFSA erprobt und sicher.[76]
Die wissenschaftlichen Einschätzungen einer täglichen Höchsteinnahmemenge (engl. UL, Tolerable Upper Intake Level) variieren und basieren auf einfachen Schätzungen, weil – so u. a. das Bundesinstitut für Risikobewertung (BfR) – Untersuchungen mit sehr hohen Einnahmedosen „keine nachteiligen gesundheitlichen Effekte gezeigt haben“ bzw. die zur Berechnung benötigten Toxizitätswerte NOAEL und LOAEL nicht vorliegen.[77][55][76] Einen UL hatte der frühere Wissenschaftliche Lebensmittelausschuss der EU-Kommission (SCF) 2000[55] bzw. die Europäische Behörde für Lebensmittelsicherheit (EFSA) 2006[76] nicht festgelegt.
Für Nahrungsergänzungsmittel hat das BfR 2021 die Einnahme von 25 μg Vitamin B12 pro Tag (2004 noch 9 μg)[61] als sichere Obergrenze angegeben.[55] Die Einschätzung des BfR basiert auf Basis von Verzehrdaten aus den USA. Hierbei hat man bei einer geschätzten Aufnahmemenge von 100 μg pro Tag über Supplemente keine unerwünschten Wirkungen beobachtet. Gemäß EFSA von 2006 waren von einer zusätzlichen Aufnahme von bis zu 1.000 µg pro Tag bei Patienten mit eingeschränkter Vitamin-B12-Aufnahme keine unerwünschten Wirkungen bekannt, diese wurden aber auch nicht erfasst.[76] Die Datenlage nach Stand 2004 ließ außerdem keine Risikoabschätzung zur oralen Verabreichung explizit von Cyanocobalamin zu.[61] In Europa hat man sich noch nicht über eine einheitliche Höchstmenge für NEMs geeinigt – während in manchen Ländern keine Begrenzungen vorweisen, liegt sie in Italien bei 1.000 µg pro Tag, und in Österreich bei 25 µg pro Tag.[78]
2005 stuften die WHO bzw. die FAO Vitamin B12 als Substanz ohne bekannten negativen Gesundheitseffekt ein („Nutrient substances with no identified adverse health effects“).[79] Bei solchen Substanzen wird für die Risikobewertung der „highest observed intake“ („höchste beobachtete Einnahme“) als Richtlinie für die sichere Obergrenze gewählt.
Im Rahmen einer 2018 veröffentlichten Studie wurden die Daten aus 20 vorhergegangenen Einzelstudien analysiert sowie eine Mendelsche Randomisierung durchgeführt. Die Autoren konnten die Korrelation zwischen erhöhten Cobalamin-Spiegeln und bestimmten Tumoren (Adenokarzinom, kleinzelliges Bronchialkarzinom) nachweisen und vertreten die Auffassung, dass ihre Ergebnisse die Hypothese eines kausalen Zusammenhangs unterstützen.[80] Die in die Studie eingeschlossenen Patienten wiesen vor allem aufgrund diverser genetischer Varianten erhöhte Cobalamin-Spiegel auf. Unklar bleibt daher, inwiefern risikobehaftete Cobalamin-Spiegel auch durch orale Supplementation erreicht werden können. Unklar bleibt auch, ob ein kausaler Zusammenhang zwischen einem hohen Spiegel und dem Risiko besteht oder ob ein hoher Cobalamin-Spiegel nur ein Indikator für andere Risikofaktoren wie z. B. erhöhten Fleischkonsum und Entzündungen wegen chronischer Erkrankungen ist oder weil die Nahrungsergänzungsmittel wegen anderer Leiden genommen werden. Eine weitere Studie, die NHANES-Daten auswertete, konnte einen Zusammenhang v. a. von niedrigen Serumspiegeln mit erhöhter Mortalität ermitteln. Die Risiken erhöhter Spiegel hatten dieser Studie zufolge keinen Zusammenhang mit erhöhten Einnahmemengen.[81]
Weitere Verwendung
[Bearbeiten | Quelltext bearbeiten]Verwendung als Gegengift
[Bearbeiten | Quelltext bearbeiten]Hydroxycobalamin ist ein Antidot bei Vergiftungen durch Cyanide bzw. Blausäure. Cyanidvergiftungen kommen hauptsächlich im Rahmen von Kunststoffbränden vor. Weitere Ursachen können die versehentliche oder absichtliche Einnahme, das Einatmen oder ein Hautkontakt bei Industrieunfällen sein.
Die klinische Symptomatik Koma, Bradykardie und Hypotonie von Rauchgasexponierten im Rahmen eines Brandes sollte an eine Cyanidintoxikation denken lassen. Wie Kohlenmonoxid und Nitrose-Gase ist auch Blausäure im Rahmen der Brandbekämpfung messbar und erhärtet den Verdacht auf eine Intoxikation. Die Therapie mit 4-Dimethylaminophenol (4-DMAP) ist bei Rauchgasexponierten zu meiden, da dies als Met-Hämoglobinbildner die Oxigenierung negativ beeinflusst.
Unter dem Handelsnamen Cyanokit erhielt die Firma Merck KGaA am 29. November 2007 für Hydroxocobalamin über das zentralisierte Verfahren von der Europäischen Kommission die Marktzulassung zur Behandlung erwiesener oder vermuteter Cyanidvergiftung bei Erwachsenen und Kindern.[82] Hydroxocobalamin ist eine Form von Vitamin B12, das Cyanid-Ionen bindet. Dabei entsteht Cyanocobalamin, das über die Nieren mit dem Urin ausgeschieden wird. So wird die Bindung des Cyanids an die Cytochrom-c-Oxidase verhindert. Die Anfangsdosis für Cyanokit bei Erwachsenen liegt bei 5 g des Wirkstoffes, die als intravenöse Infusion zu verabreichen ist. In Abhängigkeit von der Schwere der Vergiftung und der klinischen Reaktion kann eine zweite Dosis von 5 g bis zu einer Gesamtdosis von 10 g verabreicht werden.
Das Risiko-Nutzen-Verhältnis im Rahmen der Behandlung der Cyanidvergiftung mit Hydroxocobalamin ist gut. Als häufige Nebenwirkung kommt es zu einer harmlosen ca. eine Woche andauernden Rotfärbung der Haut und des Urins sowie zu einem leichten Blutdruckanstieg.[83]
Topische Anwendung auf der Haut
[Bearbeiten | Quelltext bearbeiten]Cyanocobalamin wird alternativmedizinisch zur Behandlung des atopischen Ekzems (Neurodermitis) und der Schuppenflechte (Psoriasis) in Form von Salben mit 0,07%igem Vitamin-B12 auf Grundlage von Avocadoöl[84] eingesetzt. Bevor die Salbe im November 2009 unter dem Markennamen Regividerm als Medizinprodukt auf den Markt gebracht wurde, fand sie durch die Fernsehdokumentation Heilung unerwünscht – Wie Pharmakonzerne ein Medikament verhindern, die am 19. Oktober 2009 von der ARD gesendet wurde, ein großes und im Verlauf auch kritisches Medieninteresse.[85][86][87][88] Peter Schönhöfer, ein klinischer Pharmakologe, der vom WDR im Rahmen der Produktion dieser Dokumentation mit der Begutachtung der Studien beauftragt worden war, zog deren Aussagekraft kurz nach der Sendung in Zweifel, da aufgrund der niedrigen Patientenzahlen überhaupt keine belastbare Aussage darstellbar sei. Seine schon während der Produktion dem WDR gegenüber ausgesprochenen Warnungen seien ignoriert worden.[89] Der Dermatologe und Studien-Koautor Peter Altmeyer äußerte gegenüber FOCUS, seine kleine Seitenvergleichsstudie ohne Kontrollgruppe mit 13 Psoriasis- und 49 Neurodermitispatienten sei von der ARD hochgejubelt und falsch interpretiert worden. Für einen Beweis der Wirksamkeit sei ein Feldversuch mit einigen tausend Patienten notwendig.[86]
Seit März 2010 darf das besagte Produkt nicht mehr unter dem Namen Regividerm vertrieben werden, es heißt nun Mavena B12 Salbe.[90]
Weder in der gültigen S3-Leitlinie „Atopische Dermatitis“,[91] noch in der S3-Leitlinie „Psoriasis vulgaris“[92] bzw. S2k-Leitlinie „Therapie der Psoriasis bei Kindern und Jugendlichen“[93] ist eine Supplementierung von Vitamin B12 als wirksame Therapie gelistet.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Wolfgang Herrmann, Rima Obeid: Ursachen und frühzeitige Diagnostik von Vitamin-B12-Mangel. In: Deutsches Ärzteblatt. Band 105, Nr. 40, 2008, S. 680–685. doi:10.3238/arztebl.2008.0680
- Wolfgang Herrmann, Rima Obeid (Hrsg.): Vitamins in the prevention of human diseases. de Gruyter, 2011, ISBN 978-3-11-021448-2.
- E. V. Quadros: Advances in the understanding of cobalamin assimilation and metabolism. In: British Journal of Haematology. Band 148, Nummer 2, Januar 2010, S. 195–204, doi:10.1111/j.1365-2141.2009.07937.x. PMID 19832808. PMC 2809139 (freier Volltext). (Review).
- Fumio Watanabe, Tomohiro Bito: Vitamin B12 sources and microbial interaction. In: Experimental Biology and Medicine (Maywood, N.J.). Band 243, Nr. 2, Januar 2018, S. 148–158, doi:10.1177/1535370217746612, PMID 29216732, PMC 5788147 (freier Volltext) – (englisch).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Die Aufnahme von Vitamin B12 (Übersichtsgrafik)
- Vitamin B12 – alles, was du wissen musst., Quarks, 10. Juni 2021
- Anna Stahl, Helmut Heseker: Vitamin B12 (Cobalamine) (PDF; 0,3 MB), Ernährungs Umschau, Oktober 2007
- Vitamin B12 – bei pflanzenbasierter Ernährung besonders auf eine angemessene Versorgung achten – FAQ vom Bundesinstitut für Risikobewertung (BfR), 18. Oktober 2023, abgerufen am 30. Oktober 2023.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Schätzwerte für eine angemessene Zufuhr von Vitamin B12. Deutsche Gesellschaft für Ernährung, abgerufen am 1. Juni 2019.
- ↑ a b Datenblatt Coenzyme B12, ≥97.0% bei Sigma-Aldrich, abgerufen am 25. Juni 2017 (PDF).
- ↑ Eintrag zu Cobamamide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Hans Beyer: Lehrbuch der organischen Chemie. Leipzig 1968, S. 617–618.
- ↑ UniProt-Suchergebnis
- ↑ a b c d e f g Hassan Jomaa: Vitamin B12. In: Axel M. Gressner, Torsten Arndt (Hrsg.): Lexikon der Medizinischen Laboratoriumsdiagnostik. 3. Auflage. Springer Reference Medizin, 2019, ISBN 978-3-662-48985-7, S. 2463–2468, doi:10.1007/978-3-662-48986-4.
- ↑ Vitamin B12 In: Pschyrembel Online, Walter de Gruyter GmbH, Juni 2018.
- ↑ M. Jägerstad & K. Arkbåge: Cobalamins - Properties and Determination. In: Encyclopedia of Food Sciences and Nutrition, 2. Auflage, 2003, S. 1419–1427. doi:10.1016/b0-12-227055-x/00257-1.
- ↑ a b c d e f g h i j Scientific Opinion on Dietary Reference Values for cobalamin (vitamin B12). (PDF) In: EFSA. 2015, abgerufen am 16. Februar 2023 (englisch).
- ↑ Cyanocobalamin In: PubChem.
- ↑ a b c d Sabrina P. van den Oever, Helmut K. Mayer: Biologically active or just “pseudo”-vitamin B12 as predominant form in algae-based nutritional supplements? In: Journal of Food Composition and Analysis. Band 109, 1. Juni 2022, S. 104464, doi:10.1016/j.jfca.2022.104464 (englisch).
- ↑ Geroge R. Minot, William P. Murphy: Treatment of pernicious anemia by a special diet. In: The Yale Journal of Biology and Medicine. Band 74, Nr. 5, 1926, S. 341–353, PMID 11769340, PMC 2588744 (freier Volltext).
- ↑ E. L. Rickes et al.: Crystalline Vitamin B12. In: Science. Band 107, Nr. 2781, 16. April 1948, S. 396, doi:10.1126/science.107.2781.396, PMID 17783930 (englisch).
- ↑ K. Folkers: Perspectives from research on vitamins and hormones. In: Journal of Chemical Education. Band 61, 1984, S. 747. doi:10.1021/ed061p747.
- ↑ E. Lester Smith: Purification of Anti-pernicious Anæmia Factors from Liver. In: Nature. Band 161, Nr. 4095, April 1948, S. 638, doi:10.1038/161638a0, PMID 18856623 (englisch).
- ↑ H. Martens, M. Barg, D. Warren, J.-H. Jah (2002): Microbial production of vitamin B 12. In: Applied Microbiology and Biotechnology, 58(3), S. 275–285. doi:10.1007/s00253-001-0902-7. PMID 11935176.
- ↑ T-Vitamin Goetsch. In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. LIV.
- ↑ Arzneimittel Cassella. In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. LXXIV.
- ↑ Vgl. auch W. Oergel: Erfahrungen mit Cobaltin forte bei der Behandlung hypochromer Anämien [Experiences with cobaltin forte in therapy of hypochromic anemia]. In: Medizinische. Band 21, Nr. 18, Mai 1953, S. 620–622.
- ↑ Manuskript ihres Festvortrages anlässlich der Verleihung des Nobelpreises (PDF; 343 kB).
- ↑ Rima Obeid: Vitamin B12. CRC Press, ISBN 978-1-4987-0700-8, S. 12 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Lawrence Berliner: Biological Magnetic Resonance. Springer US, 1978, ISBN 978-1-4615-6534-5, S. 228 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Industrial Biotechnology of Vitamins, Biopigments, and Antioxidants. Wiley, 2016, ISBN 978-3-527-68177-8 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Walter Schilling (1974) Totalsynthese von Vitamin B-12: Darstellung von Zwischenprodukten und partialsynthetische Endstufen, Doktorarbeit (aus dem Labor von Eschenmoser / ETH), abgerufen am 25. Aug. 2019
- ↑ Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6. vollständig überarbeitete Auflage. Springer, Berlin / Heidelberg 2008, ISBN 978-3-540-73201-3, S. 427, doi:10.1007/978-3-540-73202-0.
- ↑ Iqbal Ahmad et al.: Effect of ascorbic acid on the degradation of Cyanocobalamin and Hydroxocobalamin in aqueous solution: a kinetic study. In: AAPS PharmSciTech. Band 15, Nr. 5, Oktober 2014, S. 1324–1333, doi:10.1208/s12249-014-0160-5, PMID 24920523, PMC 4179674 (freier Volltext).
- ↑ Eckhart Buddecke: 8. Cobalamin In: Grundriss der Biochemie: Für Studierende der Medizin, Zahnmedizin und Naturwissenschaften, Walter de Gruyter GmbH & Co KG, Reprint 2018; S. 363. ISBN 978-3-11-163720-4.
- ↑ transgen.de Website des Forum Bio- und Gentechnologie e. V. zu Vitamin B12 (Cobalamin)
- ↑ a b c d e Anna Stahl, Helmut Heseker: Vitamin B12 (Cobalamine). (PDF) In: Ernährungs Umschau. Oktober 2007, abgerufen am 16. Februar 2023.
- ↑ a b Mechthild Busch-Stockfisch: Lebensmittel-Lexikon. 4. Auflage. Behr’s Verlag DE, 2005, ISBN 3-89947-165-2.
- ↑ H.-D. Belitz, W. Grosch, P. Schieberle: Lehrbuch der Lebensmittelchemie. 6. Auflage. Springer, 2007, ISBN 978-3-540-73201-3, S. 418.
- ↑ Eintrag zu Vitamin B12. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Februar 2013.
- ↑ a b Claus Leitzmann u. a.: 21. Vitamin B12 (Cobalamin). In: Ernährung in Prävention und Therapie: ein Lehrbuch. 2. Auflage. Georg Thieme Verlag, 2003, ISBN 3-8304-5273-X, S. 51. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ a b Die Angaben entsprechen nicht zwingend dem Gehalt des vom menschlichen Organismus verwendbaren Vitamins der Lebensmittel. So kann der Gehalt durch vorhandenes Pseudovitamin B12 überschätzt sein.
- ↑ Geoffrey P. Webb: Dietary supplements and functional foods. Wiley-Blackwell, 2006, ISBN 1-4051-1909-8, S. 196.
- ↑ Anatol Schmidt et al.: Determination of vitamin B12 in four edible insect species by immunoaffinity and ultra-high performance liquid chromatography. In: Food Chemistry. Band 281, 30. Mai 2019, S. 124–129, doi:10.1016/j.foodchem.2018.12.039, PMID 30658738 (englisch).
- ↑ a b Fumio Watanabe et al.: Characterization of vitamin B₁₂ compounds in the wild edible mushrooms black trumpet (Craterellus cornucopioides) and golden chanterelle (Cantharellus cibarius). In: Journal of Nutritional Science and Vitaminology. Band 58, Nr. 6, 2012, S. 438–441, doi:10.3177/jnsv.58.438, PMID 23419403 (englisch).
- ↑ Stefanie Uhrig: Vitamin B12 – alles, was du wissen musst. In: Quarks. 23. Januar 2020, abgerufen am 22. Februar 2023.
- ↑ Zenon Schneider: The Occurrence and Distribution or Corrinoids. In: Zenon Schneider, Andrzej Stroinski (Hrsg.): Comprehensive B12: Chemistry, Biochemistry, Nutrition, Ecology, Medicine. De Gruyter, 1987, ISBN 3-11-084479-6, S. 189, doi:10.1515/9783110844795/html (englisch).
- ↑ a b Wolfgang Löscher, Fritz Rupert Ungemach, Reinhard Kroker: Vitamin B12. In: Pharmakotherapie bei Haus- und Nutztieren. 7. Auflage. Georg Thieme Verlag, 2006, ISBN 3-8304-4160-6, S. 346. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ H. Lindermayer, G. Probstmeier, W. Preißinger: Grundsätze der Schweinefütterung, Unterrichts- und Beratungshilfe. Teil 1: Ernährungsphysiologische Grundlagen. (PDF; 1,9 MB) LfL Tierernährung, Bayerische Landesanstalt für Tierernährung, 2009, S. 44.
- ↑ H.-P. Klöcking: 8.3.2 Vitaminmangel-Anaemie. In: Hans-Hasso Frey, Wolfgang Löscher (Hrsg.): Lehrbuch der Pharmakologie und Toxikologie für die Veterinärmedizin. 2. Auflage. Georg Thieme Verlag, 2007, ISBN 978-3-8304-1070-6, S. 216. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ J. Köhrle, L. Schomburg: 11.4 Kobalt. In: Hans-Konrad Biesalski, Stephan C. Bischoff, Christoph Puchstein (Hrsg.): Ernährungsmedizin: nach dem neuen Curriculum Ernährungsmedizin der Bundesärztekammer. 4. Auflage. Georg Thieme Verlag, 2010, ISBN 978-3-13-100294-5, S. 205. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ Eintrag zu Humanmilch. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Mai 2013.
- ↑ a b c Lindsay H. Allen: Causes of vitamin B12 and folate deficiency. In: Food and Nutrition Bulletin. Band 29, 2 Suppl, Juni 2008, S. S20–34; discussion S35–37, doi:10.1177/15648265080292S105, PMID 18709879 (englisch).
- ↑ a b c Mustafa Vakur Bor; Ebba Nexo: Vitamin B12 – Cobalamin. In: Wolfgang Herrmann und Rima Obeid (Hrsg.): Vitamins in the prevention of human diseases. De Gruyter, 2011, ISBN 978-3-11-021449-9, S. 187–271, doi:10.1515/9783110214499.187 (englisch).
- ↑ Winston J. Craig et al.: Position of the American Dietetic Association: vegetarian diets. In: Journal of the American Dietetic Association. Band 109, Nr. 7, Juli 2009, S. 1266–1282, doi:10.1016/j.jada.2009.05.027, PMID 19562864 (englisch).
- ↑ Spirulina – viel Grün und wenig dahinter. In: Verbraucherzentrale. 30. September 2022, abgerufen am 4. März 2023.
- ↑ AFA-Algen – kein blaues Wunder. In: Verbraucherzentrale. 22. März 2022, abgerufen am 4. März 2023.
- ↑ a b c Fumio Watanabe, Tomohiro Bito: Vitamin B12 sources and microbial interaction. In: Experimental Biology and Medicine (Maywood, N.J.). Band 243, Nr. 2, Januar 2018, S. 148–158, doi:10.1177/1535370217746612, PMID 29216732, PMC 5788147 (freier Volltext) – (englisch).
- ↑ a b Christiane Lerch et al.: Veganer und Vegetarier aufgepasst – Spirulina, Afa und Chlorella sind keine zuverlässigen Vitamin B12-Quellen! In: Chemische und Veterinäruntersuchungsämter Baden-Württemberg. 17. Dezember 2019, abgerufen am 5. März 2023.
- ↑ a b Fumio Watanabe et al.: Vitamin B12-Containing Plant Food Sources for Vegetarians. In: Nutrients. Band 6, Nr. 5, 5. Mai 2014, S. 1861–1873, doi:10.3390/nu6051861, PMID 24803097, PMC 4042564 (freier Volltext) – (englisch).
- ↑ Pieter C. Dagnelie et al.: Vitamin B-12 from algae appears not to be bioavailable. In: The American Journal of Clinical Nutrition. Band 53, Nr. 3, März 1991, S. 695–697, doi:10.1093/ajcn/53.3.695, PMID 2000824 (englisch).
- ↑ Gianluca Rizzo et al.: Vitamin B12 among Vegetarians: Status, Assessment and Supplementation. In: Nutrients. Band 8, Nr. 12, 29. November 2016, S. 767, doi:10.3390/nu8120767, PMID 27916823, PMC 5188422 (freier Volltext) – (englisch).
- ↑ a b c d Höchstmengen für Vitamin B12 in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: BfR. 2021, abgerufen am 2. Mai 2021.
- ↑ Vitamin B12. Fact Sheet for Health Professionals. In: Office of Dietary Supplements. National Institutes of Health, 22. Dezember 2022, abgerufen am 20. Februar 2023 (englisch).
- ↑ Fragen und Antworten der DGE zu Vitamin B12. Deutsche Gesellschaft für Ernährung, abgerufen am 1. Juni 2019.
- ↑ Institute of Medicine (US) Standing Committee on the Scientific Evaluation of Dietary Reference Intakes and its Panel on Folate, Other B Vitamins, and Choline: 9. Vitamin B12. In: Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. National Academies Press, Washington D.C. 1998, ISBN 0-309-06411-2, S. 324. (online)
- ↑ a b Berthold Koletzko, Franziska Feldl: Ausgewogene Substratversorgung durch Fleischverzehr. In: Deutsches Ärzteblatt. 13. März 1998, abgerufen am 28. Februar 2023.
- ↑ W. J. Craig, A. R. Mangels; American Dietetic Association: Position of the American Dietetic Association: vegetarian diets. In: Journal of the American Dietetic Association. Band 109, Nummer 7, Juli 2009, S. 1266–1282. PMID 19562864, Volltext (PDF; 644 kB)
- ↑ a b c Verwendung von Vitaminen in Lebensmitteln. (PDF) Toxikologische und ernährungsphysiologische Aspekte - Teil 1. In: Bundesinstitut für Risikobewertung. Angelika Domke et al., März 2004, abgerufen am 15. Februar 2023.
- ↑ a b Andreas Hahn: Vitamine. In: Reinhard Matissek (Hrsg.): Lebensmittelchemie. 9. Auflage. Springer Spektrum, Berlin 2019, ISBN 978-3-662-59668-5, S. 79, doi:10.1007/978-3-662-59669-2_4.
- ↑ Andreas Hahn: Vitamine. In: Reinhard Matissek (Hrsg.): Lebensmittelchemie. 9. Auflage. Springer Spektrum, Berlin 2019, ISBN 978-3-662-59668-5, S. 92, doi:10.1007/978-3-662-59669-2_4.
- ↑ Jameson R. Lam, Jennifer L. Schneider, Wei Zhao, Douglas A. Corley: Proton Pump Inhibitor and Histamine 2 Receptor Antagonist Use and Vitamin B Deficiency. In: JAMA. 310, 2013, S. 2435, doi:10.1001/jama.2013.280490.
- ↑ Andreas Hahn: Vitamine. In: Reinhard Matissek (Hrsg.): Lebensmittelchemie. 9. Auflage. Springer Spektrum, Berlin 2019, ISBN 978-3-662-59668-5, S. 81, doi:10.1007/978-3-662-59669-2_4.
- ↑ netdoktor.de – Vitamin B12-Mangel vom 7. Oktober 2019
- ↑ Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 10. Auflage. Kitteltaschenbuch, Sinsheim 2015, ISBN 978-3-00-050903-2, S. 31–33.
- ↑ a b Wolfgang Herrmann, Rima Obeid: Causes and Early Diagnosis of Vitamin B12 Deficiency. (auf Deutsch: Ursachen und frühzeitige Diagnostik von Vitamin-B12-Mangel) In: Deutsches Ärzteblatt. Band 105, Heft 40, 2008, S. 680–685. doi:10.3238/arztebl.2008.0680
- ↑ Schema für die Labordiagnostik des Vitamin-B12-Mangels aus Ursachen und frühzeitige Diagnostik von Vitamin-B12-Mangel.
- ↑ Monique G. M. de Sain-van der Velden, Maria van der Ham, Judith J. Jans, Gepke Visser, Hubertus C. M. T. Prinsen: A New Approach for Fast Metabolic Diagnostics in CMAMMA. In: JIMD Reports. Band 30. Springer Berlin Heidelberg, Berlin, Heidelberg 2016, ISBN 978-3-662-53680-3, S. 15–22, doi:10.1007/8904_2016_531, PMID 26915364, PMC 5110436 (freier Volltext) – (springer.com).
- ↑ a b Matthew J. Oberley, David T. Yang: Laboratory testing for cobalamin deficiency in megaloblastic anemia. In: American Journal of Hematology, 20. Februar 2013. doi:10.1002/ajh.23421.
- ↑ Vitamin B₁₂. Abgerufen am 15. April 2024 (deutsch).
- ↑ Ralph Carmel, Yash Pal Agrawal: Failures of Cobalamin Assays in Pernicious Anemia. In: New England Journal of Medicine. 367, 2012, S. 385–386. doi:10.1056/NEJMc1204070
- ↑ F. v. d. Berg, L. Gifford, J. Cabri, L. Arendt-Nielsen, E. Bader: Angewandte Physiologie: Organsysteme verstehen und beeinflussen. 2. Auflage. Thieme, 2005, ISBN 3-13-117082-4, S. 236.
- ↑ O. Braun-Falco, H. Lincke: The problem of vitamin B6/B12 acne. A contribution on acne medicamentosa. In: Münchener medizinische Wochenschrift. Band 118, 1976, S. 155–160. PMID 130553
- ↑ a b c d EFSA: Tolerable upper intake levels for vitamins and minerals (PDF), Seite 48, Februar 2006
- ↑ Anke Weißenborn et al.: Höchstmengen für Vitamine und Mineralstoffe in Nahrungsergänzungsmitteln. In: Journal of Consumer Protection and Food Safety. Band 13, Nr. 1, 1. März 2018, S. 25–39, doi:10.1007/s00003-017-1140-y.
- ↑ Christina Rempe: Hoch dosiertes Vitamin B12: Nutzen nicht belegt. In: MedWatch. 26. Januar 2024, abgerufen am 3. März 2024.
- ↑ A Model for Establishing Upper Levels of Intake for Nutrients and Related Substances. (PDF) Report of a Joint FAO/WHO Technical Workshop on Nutrient Risk Assessment WHO Headquarters, Geneva, Switzerland 2-6 May 2005. In: FAO/WHO. 2006, S. 1-257, abgerufen am 3. März 2024 (englisch).
- ↑ Anouar Fanidi et al.: Is high vitamin B12 status a cause of lung cancer? In: International Journal of Cancer. Band 145, Nr. 6, 15. September 2019, S. 1499–1503, doi:10.1002/ijc.32033, PMID 30499135, PMC 6642017 (freier Volltext).
- ↑ Bruce H. R. Wolffenbuttel et al.: Relationship between serum B12 concentrations and mortality: experience in NHANES. In: BMC medicine. Band 18, Nr. 1, 9. Oktober 2020, S. 307, doi:10.1186/s12916-020-01771-y, PMID 33032595, PMC 7545540 (freier Volltext).
- ↑ Cyanokit(R) von Merck Serono in der Europäischen Union zugelassen. Pressemitteilung vom 29. November 2007.
- ↑ Wolfgang Uhl et al.: Safety of Hydroxocobalamin in healthy volunteers in a randomized, placebo-controlled study. In: Clinical Toxicology (Philadelphia, Pa.). 44 Suppl 1, 2006, S. 17–28, doi:10.1080/15563650600811755, PMID 16990190.
- ↑ Vitamin-B12-Creme: Mehr als »rosa Hühnerkacke«? In: Pharmazeutische Zeitung. 21. Oktober 2009, abgerufen am 4. März 2017.
- ↑ Winfried Köppelle: Schleichwerbung für Quacksalbe und Wunderbuch ( vom 15. November 2009 im Internet Archive). In: Laborjournal, November 2009, S. 68–70.
- ↑ a b Jochen Niehaus: Zu dick aufgetragen. In: Focus Online. 26. Oktober 2009; abgerufen am 16. November 2009.
- ↑ Schuppenflechte-Therapie – Rosarot ist die Hoffnung. In: Frankfurter Allgemeine Zeitung.
- ↑ Neurodermitis-Creme – Falsche Heilsversprechen. Öko-Test
- ↑ NDR, Magazin ZAPP vom 28. Oktober 2009.
- ↑ Namensänderung unserer Vitamin B12 Salbe. ( vom 18. Februar 2012 im Internet Archive) Internetseite der Regeneration Pharma GmbH, Stand vom 18. Februar 2012.
- ↑ S3-Leitlinie Atopische Dermatitis der Deutschen Dermatologischen Gesellschaft. In: AWMF online (Stand 2023)
- ↑ S3-Leitlinie Therapie der Psoriasis vulgaris der Deutschen Dermatologischen Gesellschaft. In: AWMF online (Stand 2021)
- ↑ S2k-Leitlinie Therapie der Psoriasis bei Kindern und Jugendlichen der Deutschen Dermatologischen Gesellschaft. In: AWMF online (Stand 2022)