Basketan
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Basketan | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C10H12 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 132,2 g·mol−1 | ||||||||||||
| Schmelzpunkt |
102–104 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Basketan ist eine chemische Verbindung aus der Gruppe der gesättigten polycyclischen aliphatischen Kohlenwasserstoffe, bestehend aus Vier- und Sechsringen. Die Verbindung zählt wie beispielsweise Cuban oder die Asterane zu den Käfigverbindungen.[3] Die Synthese der Verbindung wurde 1966 unabhängig voneinander sowohl von Satoru Masamune, als auch von William G. Dauben veröffentlicht. Die Bezeichnung Basketan (von englisch Basket, deutsch Korb) wurde von Masamune vorgeschlagen, während Dauben die Benennung 1,1'-Bishomocuban bevorzugte.[4][1]
Synthese
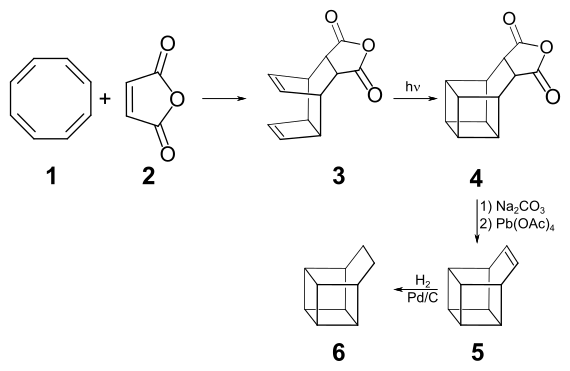
[Bearbeiten | Quelltext bearbeiten]Durch eine Diels-Alder-Reaktion von Cyclooctatetraen 1 mit Maleinsäureanhydrid 2 als Dienophil erhält man das polycyclische Dien 3, das bei der Belichtung in Aceton durch eine intramolekulare Cyclisierung mit einer Ausbeute von 40 % in das Anhydrid 4 übergeht. Durch Hydrolyse des Anhydrids und Umsetzung der Dicarbonsäure mit Bleitetraacetat in Pyridin erhält man die ungesättigte Verbindung Basketen[5] 5, die bei der katalytischen Hydrierung zum Basketan 6 reduziert wird.[4]
Eine alternative Syntheseroute mit einer höheren Gesamtausbeute geht von 1,4-Benzochinon und 1,3-Cyclohexadien aus. 1,4-Benzochinon 1 wird zunächst in das 2,5-Dibrom-1,4-benzochinon[6] 2 überführt. Die Diels-Alder-Reaktion mit 1,3-Cyclohexadien 3 ergibt das polycyclische Diketon 4. Durch Belichtung dieser Verbindung erhält man 1,6-Dibrompentacyclo[6.4.0.03,6.04,12.05,9]dodeca-2,7-dion 5. Mit 25 %iger Natronlauge bildet sich daraus in einer Pseudo-Faworski-Umlagerung mit Quecksilber(II)-oxid und Brom in 1,2-Dibromethan die Dicarbonsäure 6. Diese wird in einer modifizierten Hunsdiecker-Reaktion zum pentacyclischen Dibromid 7 decarboxyliert. Die reduktive Debromierung mit Tributylzinnhydrid und Azobis(isobutyronitril) bei gleichzeitiger Belichtung ergibt Basketan 8 in einer Gesamtausbeute von 11 % bezogen auf 1,3-Cyclohexadien.[7]
Eigenschaften
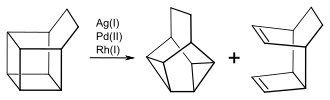
[Bearbeiten | Quelltext bearbeiten]Übergangsmetalle katalysieren die Valenzisomerisierung von Basketan und substituierten Basketanen. Mit Silberperchlorat wird Basketan zum Snoutan isomerisiert.[8]
Mit anderen Übergangsmetallen erhält man ein Gemisch von Snoutan, bzw. den entsprechenden substituierten Snoutanderivaten, und einem tricyclischen Dien:
Das Verhältnis der beiden Produkte hängt sowohl von dem Katalysator, als auch von den Substituenten am Basketangerüst ab. So erhält man bei der Isomerisierung von Basketan mit [Rh(NOR)Cl]2 zu über 99 % das Dien, während mit PdCl2(PPh3)2 der Anteil von Snoutan bei 29,9 % liegt. 4,5-Dimethylbasketan isomerisiert mit PdCl2(PPh3)2 zu 100 % zu dem Dimethylsnoutan.[9]
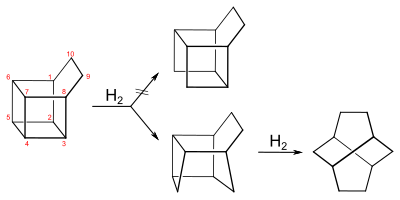
Basketan nimmt bei der Hydrierung über einem Palladium-Kohle-Katalysator eine äquimolare Menge Wasserstoff auf. Während Masamune annahm, dass dabei die Bindung zwischen C4 und C5 zu dem symmetrischen Tetracyclo[4.4.0.02,9.05,8]decan geöffnet wird, konnte Hans Musso zeigen, dass die Bindung zwischen C3 und C4, bzw. C4 und C7 zu dem Dihydrobasketan Tetracyclo[4.4.0.02,5.03,8]decan gespalten wird:[10]
Wird das Dihydrobasketan weiterhydriert entsteht unter Spaltung der Bindung zwischen C5 und C6 der polycyclische, gesättigte C10H16-Kohlenwasserstoff Twistan.[11]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b William G. Dauben, Dale L. Whalen: Pentacyclo[4.4.0.02,5.03,8.04,7]decane and pentacyclo[4.3.0.02,5.03,8.04,7]nonane. In: Tetrahedron Letters. Band 7, Nr. 31, Januar 1966, S. 3743, doi:10.1016/S0040-4039(01)99958-7.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Alan P. Marchand: Synthesis and chemistry of homocubanes, bishomocubanes, and trishomocubanes. In: Chemical Reviews. Band 89, Nr. 5, Juli 1989, S. 1011, doi:10.1021/cr00095a004.
- ↑ a b Satoru Masamune, Harold Cuts, Michael G. Hogben: Strained systems. VII. Pentacyclo[4.2.2.02,5.03,8.04,7]deca-9-ene, basketene. In: Tetrahedron Letters. Band 7, Nr. 10, Januar 1966, S. 1017, doi:10.1016/s0040-4039(00)70232-2.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Basketen: CAS-Nr.: 5603-34-9, PubChem: 138538, ChemSpider: 122156, Wikidata: Q791278.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,5-Dibrom-1,4-benzochinon: CAS-Nr.: 1633-14-3, EG-Nr.: 621-144-6, ECHA-InfoCard: 100.150.024, PubChem: 543093, ChemSpider: 472838, Wikidata: Q82105328.
- ↑ Paul G. Gassman, Ryohei Yamaguchi: 1,8-Bishomocubane. In: The Journal of Organic Chemistry. Band 43, Nr. 24, November 1978, S. 4654, doi:10.1021/jo00418a028.
- ↑ Leo A. Paquette, Ronald S. Beckley, William B. Farnham: Silver(I) Ion Catalyzed Rearrangements of Strained σ Bonds. XXVII. Kinetic Analysis of the Silver(I)-Catalyzed 1,8-Bishomocubane-Snoutane Rearrangement. In: Journal of the American Chemical Society. Band 97, Nr. 5, März 1975, S. 1089, doi:10.1021/ja00838a024.
- ↑ Leo A. Paquette, Roger A. Boggs, William B. Farnham, Ronald S. Beckley: Silver(I) ion catalyzed rearrangements of strained .sigma. bonds. XXIX. Influence of structural features on the course of transition metal catalyzed 1,8-bishomocubane rearrangements. In: Journal of the American Chemical Society. Band 97, Nr. 5, März 1975, S. 1112, doi:10.1021/ja00838a026.
- ↑ N. Andre Sasaki, Reinhard Zunker, Hans Musso: Welche C–C-Bindung wird bei der Hydrierung von Basketanderivaten geöffnet? In: Chemische Berichte. Band 106, Nr. 9, September 1973, S. 2992, doi:10.1002/cber.19731060930.
- ↑ Hans Musso: Hydrogenolyse kleiner Kohlenstoffringe, II. Über die Hydrierung von Basketan- und Snoutanderivaten. In: Chemische Berichte. Band 108, Nr. 1, Januar 1975, S. 337, doi:10.1002/cber.19751080143.