Benutzer:Denwet/Spielwiese/Vorlage:Verbesserung von Ibuprofen
(Arbeitskopie)
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Stereoisomerengemisch – Strukturformel ohne Stereochemie | ||||||||||
| Allgemeines | ||||||||||
| Freiname | Ibuprofen | |||||||||
| Andere Namen | ||||||||||
| Summenformel | C13H18O2 | |||||||||
| Kurzbeschreibung |
weißer, fast geruchloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Arzneistoffangaben | ||||||||||
| ATC-Code | ||||||||||
| Wirkstoffklasse | ||||||||||
| Wirkmechanismus |
hemmt nichtselektiv die Cyclooxygenasen I und II | |||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 206,28 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
1,175 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
154–157 °C (5 hPa)[4] | |||||||||
| Dampfdruck | ||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser: 21 mg·l−1 (25 °C)[6] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Ibuprofen ist ein Arzneistoff aus der Gruppe der nichtsteroidalen Antirheumatika (NSAR), der zur Behandlung von Schmerzen, Entzündungen und Fieber eingesetzt wird. Chemisch gehört es in die Gruppe der Arylpropionsäuren. Der Name ist – mit einer Umstellung – von der Struktur abgeleitet: 2-(4-Isobutylphenyl)propionsäure.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Entdeckung von Ibuprofen war das Ergebnis eines Forschungsprojekts bei The Boots Pure Drug Company Ltd. unter Stewart Adams in den 1950er und 1960er Jahren. Das Ziel des Projekts war die Entwicklung neuer Arzneistoffe zur Behandlung rheumatischer Erkrankungen. Als Vorbild wurde die Acetylsalicylsäure gewählt, da sie als die nebenwirkungsärmste Substanz unter den damals gebräuchlichen Standardtherapeutika, wie Glucocorticoide und Phenylbutazon, galt.[8] Erste Versuche mit Salicyl- und den ihr verwandten Phthalsäureabkömmlingen führten zwar zu wirksamen, aber deutlich toxischeren Substanzen. Dafür wurden Erkenntnisse zur Struktur-Wirkungsbeziehung, wie beispielsweise die Wichtigkeit der Carbonsäuregruppe, gefunden. Ausgehend von dieser Erkenntnis wurde die Suche nach neuen antientzündlichen Substanzen auf andere Gruppen von Carbonsäureverbindungen erweitert. Als besonders vielversprechend erwiesen sich 1958 in präklinischen Tests eine Gruppe von Phenoxyalkansäuren, die ursprünglich von Boots als Herbizide entwickelt wurden. Trotz positiver Resultate im Tierversuch stellten sie sich als klinisch unwirksam heraus. Der Durchbruch gelang mit den von John Nicholson bei Boots synthetisierten Phenylalkansäuren. Diese Substanzen, einschließlich Ibuprofen, wurden 1961 als antiinflammatorische Substanzen zum Patent angemeldet.[9] Drei Substanzen mit einer Phenylessigsäurepartialstruktur wurden zunächst klinisch getestet. Zwei der getesteten Substanzen führten zu Ausschlag, die dritte, Ibufenac, erwies sich nach längerer Nutzung nach Markteinführung als lebertoxisch.[8] Ibuprofen, das auf Grund von Sicherheitsbedenken zunächst nicht klinisch getestet wurde, erwies sich bei ersten Versuchen im Jahr 1966 an Patienten mit rheumatoider Arthritis mit einer Tagesdosis von 300 bis 600 mg als wirksam und sicher.
1969 wurde Ibuprofen in Großbritannien unter dem Markennamen Brufen mit einer empfohlenen Tagesdosis von 600 bis 800 mg in den Markt eingeführt. In der Anfangszeit stellten sich die Behandlungsergebnisse als enttäuschend heraus, woraufhin nach weiteren klinischen Studien die Tagesdosis auf zunächst 1200 mg und später auf die heute gebräuchliche Tagesdosis von 1200 bis 2400 mg erhöht wurde. In den USA wurde Ibuprofen 1974 von Upjohn unter dem Markennamen Motrin mit einer Tagesdosis von 1200 bis 3200 mg eingeführt.[8]
Nach einem 1979 zunächst gescheiterten Antrag wurde Ibuprofen zuerst 1983 in Großbritannien mit einer Einzeldosis von bis zu 200 mg und einer Tagesdosis bis 1200 mg aus der ärztlichen Verschreibungspflicht entlassen. Ein Jahr später wurde es auch in den USA mit einer Tagesdosis bis zu 1600 mg verschreibungsfrei.[8] In Deutschland ist Ibuprofen seit 1989 in einer Einzeldosis von bis zu 200 mg und seit 1998 auch in bis zu 400 mg zur Behandlung von Schmerzen und Fieber ohne ärztliche Verordnung in Apotheken erhältlich.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die bei Boots entwickelte Syntheseroute[10] verläuft über insgesamt sechs Stufen und geht von Isobutylbenzol aus. Dieses wird zunächst in einer Friedel-Crafts-Acylierung mit Essigsäureanhydrid zum Keton umgesetzt, anschließend folgt eine Darzens-Glycidester-Kondensation mit Chloressigsäureethylester zum Epoxid. Hydrolyse und Decarboxylierung führen zum Aldehyd, der mit Hydroxylamin zunächst zum Oxim, anschließend zum Nitril umgesetzt und schließlich zur freien Säure hydrolysiert wird.

Ein aktuellerer Syntheseweg geht ebenfalls von Isobutylbenzol aus, das im ersten Schritt acyliert wird, das Keton wird hier jedoch mit Raney-Nickel und Wasserstoff zum Alkohol reduziert und anschließend unter Palladium-Katalyse direkt zum Produkt carbonyliert.
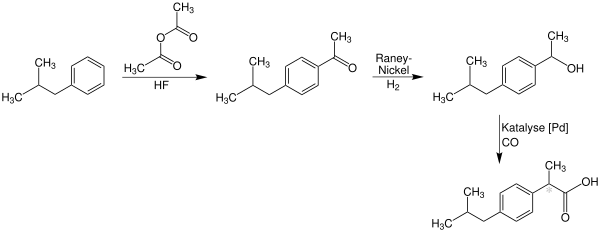
Dieser Syntheseweg wurde 1997 mit dem Greener Synthetic Pathways Award für Grüne Chemie ausgezeichnet.[11]
In beiden technischen Synthesen wird ein racemisches Gemisch der beiden Enantiomere erhalten.
Stereochemie
[Bearbeiten | Quelltext bearbeiten]Ibuprofen liegt als 1:1-Gemisch (Racemat) des pharmakologisch wirksamen Enantiomers (Eutomer) (S)-(+)-Ibuprofen (Dexibuprofen)[12] und des unwirksamen (R)-(−)-Ibuprofen (Distomer) vor. (R)-(−)-Ibuprofen wird im Körper durch eine Isomerase (2-Arylpropionyl-CoA-epimerase) in (S)-(+)-Ibuprofen umgewandelt.[13] Diese Isomerisierung ist unidirektional, d. h., es findet nur eine Umwandlung von (R)-(−)-Ibuprofen in (S)-(+)-Ibuprofen statt, nicht umgekehrt. Damit scheint die Verwendung des billigeren Racemats (RS)-(±)-Ibuprofen als Arzneistoff nicht nachteilig zu sein. Allerdings werden nur 50–60 % der applizierten Menge des Distomers so isomerisiert. Zudem verläuft die Isomerisierung sehr langsam. Ein weiterer Teil des (R)-(−)-Ibuprofens wird in das Fettgewebe eingelagert und mit einer Halbwertszeit von Tagen wieder gelöst.[14] In klinischen Studien konnte gezeigt werden, dass 200 mg (S)-(+)-Ibuprofen in etwa[15] ebenso wirksam sind wie 400 mg (RS)-(±)-Ibuprofen.[16]
| Enantiomere von Ibuprofen | |
|---|---|
 (R)-Ibuprofen |
 (S)-Ibuprofen |
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]
Ibuprofen hemmt nichtselektiv die Cyclooxygenasen I und II (COX-1 und COX-2), die im Organismus für die Bildung von entzündungsvermittelnden Prostaglandinen verantwortlich sind. Daraus resultieren die Wirkungen von Ibuprofen: Es wirkt schmerzstillend (analgetisch), entzündungshemmend (antiphlogistisch) und fiebersenkend (antipyretisch) sowie hemmend auf die Schleimproduktion im Magen mit der Folge vermehrter Magenschleimhautschäden.
Pharmakokinetik
[Bearbeiten | Quelltext bearbeiten]Die Plasmahalbwertszeit beträgt etwa zwei bis drei Stunden. In geringeren Dosen (200 bis 400 mg für Erwachsene) wirkt Ibuprofen schmerzlindernd und fiebersenkend, in höheren Dosen (bis 800 mg für Erwachsene) zusätzlich entzündungshemmend. Die Ausscheidung erfolgt zu etwa zwei Dritteln über die Niere und etwa einem Drittel über die Leber. Es werden größtenteils inaktive Metabolite ausgeschieden.[17] Bioverfügbarkeit und Wirksamkeit von Ibuprofen können mit Piperin, einem Inhaltsstoff des Pfeffers, erhöht werden.[18]
Analytik
[Bearbeiten | Quelltext bearbeiten]Die zuverlässige qualitative und quantitative Bestimmung von Ibuprofen und seinen Metaboliten in den unterschiedlichsten Untersuchungsgütern gelingt nach angemessener Probenvorbereitung durch Kopplung chromatographischer Verfahren mit der Massenspektrometrie.[19][20] Unter dem Einsatz enantioselektiver Verfahren lassen sich auch die Enantiomeren des Ibuprofens trennen und quantifizieren.[21] Auch bei ökotoxikologischen Fragen so z. B. der Untersuchung benthischer Organismen lassen sich diese Verfahren einsetzen.[22][23]
Anwendung
[Bearbeiten | Quelltext bearbeiten]Art der Anwendung und Dosierung
[Bearbeiten | Quelltext bearbeiten]Ibuprofen kann oral, rektal, dermal, topisch oder intravenös verabreicht werden. Es wird in Abhängigkeit von Alter und Körpergewicht dosiert. Bei oraler Anwendung werden 800 mg Ibuprofen als maximale Einzeldosis und zwischen 1200 und 2400 mg als Tagesgesamtdosis für Erwachsene und Jugendliche ab fünfzehn Jahren empfohlen. Bis zu einer Einzeldosis von 400 mg ist es in Deutschland rezeptfrei erhältlich. Zur Schmerzlinderung wird eine Tagesdosis von 800 mg bis 1200 mg empfohlen, zur Entzündungshemmung eine Tagesdosis von 1200 mg bis 2400 mg.[24] Etwa zweieinhalb Stunden lang hält sich die Anfangskonzentration im Blut und nimmt danach ab. [25] Eine Dosisanpassung wird unter anderem bei Patienten mit schweren Leberfunktionsstörungen und bei Kindern vorgenommen.[17]
Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]Die Anwendungsgebiete sind allgemein zur Schmerztherapie wie bei der rheumatoiden Arthritis, bei Schmerzen der Muskeln und des Bewegungsapparates, bei der akuten Gicht, bei Kopf- und Zahnschmerzen, akute Menstruationsbeschwerden, zur Fiebersenkung und speziell bei Kindern zur Behandlung eines hämodynamisch wirksamen offenen Ductus arteriosus Botalli bei Frühgeborenen vor der 34. Schwangerschaftswoche. Bei der Mukoviszidose bessert eine Hochdosisbehandlung die Symptome bei Kindern mit leichter Mukoviszidose deutlich. Die potenziellen Nebenwirkungen verhindern jedoch einen breiten Einsatz.[26][27]
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Häufig (1 bis 10 %) bis sehr häufig (> 10 %) können gastrointestinale Beschwerden wie Sodbrennen, Übelkeit oder Durchfall auftreten.[17][28] Das Auftreten von Magen-Darm-Blutungen, Magengeschwüren oder Magenschleimhautentzündungen (Gastritis) sowie Magendurchbrüchen, auch mit tödlichem Ausgang, wird gelegentlich beobachtet und hängt von der Dosis und der Anwendungsdauer ab. Bei älteren Patienten treten diese unerwünschten Nebenwirkungen häufiger auf.[17][28]
Bei chronisch entzündlichen Darmerkrankungen (Morbus Crohn, Colitis ulcerosa) kann Ibuprofen schubauslösend wirken.[17] Überempfindlichkeitsreaktionen wie Hautausschlag oder Hautjucken (Pruritus) sind möglich.
Der Einfluss von Ibuprofen auf die Blutgerinnung ist vergleichsweise gering, es hemmt die Thrombozytenfunktion und damit die Blutgerinnung schwächer als Acetylsalicylsäure. Dennoch kann nach Operationen das Risiko von Nachblutungen steigen. In Fällen, bei denen Ibuprofen die Magenschleimhaut entzündlich verändert, kann die durch das Medikament bewirkte Gerinnungshemmung dazu führen, dass aus der Magenwand unkontrolliert über einen längeren Zeitraum Blut sickert.
Bei schweren Nieren- oder Leberfunktionsstörungen ist die Anwendung von Ibuprofen kontraindiziert.[28]
Ödeme (z. B. auch Knochenmarködeme) sind eine bekannte Nebenwirkung vieler Schmerzmittel, welche auf einer Hemmung der Prostaglandinsynthese beruhen, wie dies auch bei Ibuprofen bekannt ist.[28]
Im Übrigen wird vereinzelt vom Auftreten einer Agranulozytose (starke lebensbedrohliche Verminderung der Granulozyten) berichtet.[29]
Wechselwirkungen mit anderen Arzneimitteln
[Bearbeiten | Quelltext bearbeiten]- Antikoagulantien und Thrombolytika: Ibuprofen bewirkt eine reversible Thrombozytenaggregationshemmung. Die Thrombozyten sind wichtig für die Blutgerinnung (Wundverschluss). Antikoagulantien wirken ebenfalls negativ auf die Blutgerinnung. Thrombolytika lösen Blutgerinnsel auf (beispielsweise in einem verstopften Herzkranzgefäß). Wird Ibuprofen zusammen mit Medikamenten einer dieser Wirkstoffgruppen eingenommen, ist das Blutungsrisiko größer.
- Lithium: Ibuprofen steigert die Plasmakonzentration von Lithium, indem es seine Ausscheidung in der Niere verringert. Es kann dadurch zu einer Lithium-Vergiftung (Intoxikation) beitragen.
- Acetylsalicylsäure: Bei gleichzeitiger Einnahme von Ibuprofen kann die gerinnungshemmende Wirkung von Acetylsalicylsäure verringert werden.[30] Die Wirkung der Acetylsalicylsäure (ASS) auf die Funktion der Thrombozytenaggregation beruht auf der irreversiblen Hemmung eines Enzyms in den Thrombozyten, der Cyclooxygenase-1 (COX-1). Die COX-1 in den Thrombozyten bildet hauptsächlich Thromboxan-A2 (TXA2), das über den Thromboxan-Rezeptor auf der Thrombozytenoberfläche die Thrombozytenaggregation aktiviert. Acetylsalicylsäure acetyliert (unter Abgabe seines Acetyl-Rests) das Zentrum an einem Serin des COX-1-Enzyms unumkehrbar. Wird jedoch gleichzeitig oder zu zeitnah Ibuprofen eingenommen, so konkurrieren beide Moleküle um den Zugang zum Zentrum des COX-1-Enzyms, wobei das Ibuprofen die Oberhand behält. Da Acetylsalicylsäure jedoch rascher inaktiviert wird als Ibuprofen, ist nach Abfluten des Ibuprofen-Blutspiegels keine Acetylsalicylsäure mehr vorhanden. Die übrigbleibende Salicylsäure, ein Abbauprodukt der Acetylsalicylsäure, kann keine Acetylierung durchführen, so dass es in der Folge zu einem zunehmenden Verlust an Thrombozyten-Aggregationshemmung kommt.[31]
- Zink kann unter Umständen mit NSARs wie Ibuprofen wechselwirken und die Aufnahme und Effektivität des Ibuprofens senken.[32]
Arzneimittelmarkt
[Bearbeiten | Quelltext bearbeiten]Ibuprofen wird in Form von Tabletten, Kapseln, Salben, Zäpfchen, Granulat zum Auflösen in Wasser und Kindersäften vertrieben. Tabletten bis 400 mg (für den Akutgebrauch), Salben, Gele, Zäpfchen und zum Teil Kindersäfte (zugelassen in Deutschland derzeit für Kinder ab sechs Monaten) zur Behandlung von Fieber und Schmerzen unterliegen in Deutschland der Apothekenpflicht und können ohne Rezept erworben werden. Höher dosierte Zubereitungen (600 mg und 800 mg) und Präparate zur Behandlung von Entzündungen und rheumatischen Erkrankungen unterliegen der ärztlichen Verschreibungspflicht. In einigen Ländern (beispielsweise in den Vereinigten Staaten, Polen, Niederlanden, Norwegen oder im Vereinigten Königreich) ist für Ibuprofen der Selbstbedienungsverkauf teilweise mit Mengenbeschränkung im Supermarkt zulässig.
Einige Ibuprofenpräparate enthalten Ibuprofen-Lysinat, ein Salz aus Ibuprofen und der Aminosäure Lysin. Im Magen ist dieses Salz besser löslich, so dass es schneller vom Körper resorbiert wird und dadurch zu einem schnelleren Wirkungseintritt führen soll.
Zur Behandlung eines persistierenden (d. h. in diesem Falle nach der Geburt weiterbestehenden) Ductus arteriosus ist Ibuprofen mit einer Sonderzulassung als Orphan-Arzneimittel als Injektionslösung verfügbar.
Da das Patent von Ibuprofen seit Jahren frei ist, handelt es sich – außer beim Original – bei den folgenden Präparaten um Generika mit verschiedensten Namen in Deutschland (D), Österreich (A) und der Schweiz (CH): Aktren (D, A), Alges-X (CH), Algifor-L Forte 400 (CH), Anco (D), Brufen (A, CH), Dismenol (D, A, CH), Dolgit (D, A), Dolocyl (CH), Dolormin Extra (D), Esprenit (D), Eudorlin Extra (D), Grefen (CH), Gyno-Neuralgin (D), Ibuflam (D), IbuHEXAL (D), Ibumetin (A), Ibutop (D), Ibubeta (D), Irfen (CH), Kontagripp (D), Migränin Ibuprofen (D), Movone (A), Neuralgin extra (D), Nurofen (D, A), Opturem (D), Pedea (D), RatioDolor akut (A), Saridon (CH), Spedifen (A, CH), Spalt Flüssigkapseln (D), Spidifen (D), Tispol (D), Urem (D).
Tiermedizin
[Bearbeiten | Quelltext bearbeiten]In Deutschland und der Schweiz sind derzeit keine Tierarzneimittel auf Ibuprofenbasis zugelassen. Die Anwendung von Ibuprofen bei lebensmittelliefernden Tieren ist nicht erlaubt, da es in keinem Anhang zur Verordnung (EWG) Nr. 2377/90 über Höchstmengen für Tierarzneimittelrückstände in Nahrungsmitteln aufgeführt ist. Eine Anwendung bei Pferden kann nur erfolgen, wenn sie im Equidenpass eingetragen wird und eine Wartezeit von sechs Monaten bis zu einer Schlachtung eingehalten wird. Gegenüber den für Hunde zugelassenen NSAID treten bei Gabe von Ibuprofen vermehrt gastrointestinale Nebenwirkungen auf.[33]
Literatur
[Bearbeiten | Quelltext bearbeiten]- John F. Murray, Jay A. Nadel: Murray & Nadel's Textbook of Respiratory Medicine. 4. Auflage. Saunders, Philadelphia 2005, ISBN 0-7216-0327-0.
- Thomas Karow, Ruth Lang-Roth: Pharmakologie und Toxikologie. 18. Auflage. Selbstverlag, Pulheim 2009, OCLC 553452252.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Ibuprofen bei Vetpharm
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Sicherheitsdatenblatt Ibuprofen bei Caelo, abgerufen am 8. Mai 2017.
- ↑ N. Shankland, C. C. Wilson, A. J. Florence, P. J. Cox: Acta Crystallographica, Section C: Crystal Structure Communications. 1997, 53, S. 951–954; doi:10.1107/S0108270197003193.
- ↑ a b A. J. Romero, T. C. Rhodes: Stereochemical Aspects of the Molecular Pharmaceutics of Ibuprofen. In: J Pharm Pharmacol. 1993, 45, S. 258–262.
- ↑ K. K. Kanebo; JP 52100438; 1977.
- ↑ K. D. Ertel, R. A. Heasley, C. Koegel, A. Chakrabarti, J. T. Carstensen: J Pharm Sci. 1990, 79, S. 552; doi:10.1002/jps.2600790620.
- ↑ Eintrag in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar).
- ↑ a b c Datenblatt Ibuprofen bei Sigma-Aldrich (PDF).
- ↑ a b c d Kim D. Rainsford: Ibuprofen: A Critical Bibliographic Review. CRC Press, 2003, ISBN 0-203-36258-6, History and Development of Ibuprofen, S. 1–22.
- ↑ Patent GB971700: Anti-inflammatory Agents. Angemeldet am 2. Februar 1961, veröffentlicht am 30. September 1964, Anmelder: Boots Pure Drug Company Ltd., Erfinder: J. S. Nicholson, S. S. Adams.
- ↑ Patent US3385886: Phenyl propionic acids. Angemeldet am 23. Juli 1963, veröffentlicht am 28. Mai 1968, Anmelder: Boots Pure Drug Company, Erfinder: N. J. Stuart & A. S. Sanders.
- ↑ Ibuprofen – a case study in green chemistry. (PDF; 70 kB)
- ↑ A. M. Evans: Enantioselective pharmacodynamics and pharmacokinetics of chiral non-steroidal anti-inflammatory drugs. In: European Journal of Clinical Pharmacology. 1992, 42, S. 237–256. doi:10.1007/BF00266343
- ↑ Hermann J. Roth, Christa E. Müller, Gerd Folkers: Stereochemie & Arzneistoffe. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1998, ISBN 3-8047-1485-4, S. 175–176.
- ↑ Naproxen-Natrium: Eine neue Alternative in der Selbstmedikation. In: Pharmazeutische Zeitung online 16/2002.
- ↑ Olaf Carstens: Duden | etwa | Rechtschreibung, Bedeutung, Definition, Synonyme, Herkunft. In: www.duden.de. Bibliographisches Institut GmbH, abgerufen am 24. August 2016.
- ↑ Carsten Schmuck, Bernd Engels, Tanja Schirmeister, Reinhold Fink: Chemie für Mediziner. Pearson Studium, ISBN 978-3-8273-7286-4, S. 411.
- ↑ a b c d e Bundesinstitut für Arzneimittel und Medizinprodukte: Mustertext für Fachinformation Ibuprofen (rheumatologische Indikationen). (RTF; 175 kB) Abgerufen am 6. Juni 2010.
- ↑ S. Venkatesh, K. D. Durga, Y. Padmavathi, B. M. Reddy, R. Mullangi: Influence of piperine on ibuprofen induced antinociception and its pharmacokinetics. In: Arzneimittel-Forschung. Band 61, Nummer 9, 2011, S. 506–509, doi:10.1055/s-0031-1296235, PMID 22029226.
- ↑ B. Yilmaz, A. F. Erdem: Determination of ibuprofen in human plasma and urine by gas chromatography/mass spectrometry. In: Journal of AOAC International. 2014;97(2), S. 415–420, PMID 24830154
- ↑ J. Manso, E. Larsson, J.Å. Jönsson: Determination of 4'-isobutylacetophenone and other transformation products of anti-inflammatory drugs in water and sludge from five wastewater treatment plants in Sweden by hollow fiber liquid phase microextraction and gas chromatography-mass spectrometry. In: Talanta. 2014;125, S. 87–93, PMID 24840419
- ↑ S. Ogawa, H. Tadokoro, M. Sato, T. Higashi: Enantioselective determination of ibuprofen in saliva by liquid chromatography/tandem mass spectrometry with chiral electrospray ionization-enhancing and stable isotope-coded derivatization. In: J Pharm Biomed Anal. 2014;98, S. 387–392, PMID 24999866
- ↑ L. Pasquini, J. F. Munoz, M. N. Pons, J. Yvon, X. Dauchy, X. France, N. D. Le, C. France-Lanord, T. Görner: Occurrence of eight household micropollutants in urban wastewater and their fate in a wastewater treatment plant. Statistical evaluation. In: Sci Total Environ. 2014;481, S. 459–468, PMID 24631609.
- ↑ A. Berlioz-Barbier, A. Buleté, J. Faburé, J. Garric, C. Cren-Olivé, E. Vulliet: Multi-residue analysis of emerging pollutants in benthic invertebrates by modified micro-Quick-Easy-Cheap-Efficient-Rugged-Safe extraction and nanoliquid chromatography-nanospray-tandem mass spectrometry analysis. In: J Chromatogr A. 2014. pii: S0021-9673(14)01478-2, PMID 25287267
- ↑ Fachinfo Ibu-ratiopharm, Stand August 2015
- ↑ gesundheit.de: Ibuprofen: Nebenwirkungen und Dosierung abgerufen am 12. Dezember 2016.
- ↑ A. Jaffe, I. M. Balfour-Lynn: Treatment of severe small airways disease in children with cystic fibrosis: alternatives to corticosteroids. In: Paediatr Drugs. 2002, 4 (6), S. 381–389; PMID 12038874.
- ↑ J. F. Chmiel, M. W. Konstan: Anti-inflammatory medications for cystic fibrosis lung disease: selecting the most appropriate agent. In: Treat Respir Med. 2005, 4 (4), S. 255–273; PMID 16086599.
- ↑ a b c d Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM): Mustertext Fachinformation Ibuprofen / Ibuprofen-DL-lysinat (apothekenpflichtig). (RTF; 222 kB) 2009, abgerufen am 24. Februar 2013.
- ↑ Agranulozytose nach Metamizol – sehr selten, aber häufiger als gedacht (Aus der UAW-Datenbank) In: Deutsches Ärzteblatt. Jg. 108, Heft 33, 19. August 2011, S. 1758.
- ↑ Francesca Catella-Lawson, Muredach P. Reilly, Shiv C. Kapoor, Andrew J. Cucchiara, Susan DeMarco, Barbara Tournier, Sachin N. Vyas, Garret A. FitzGerald: Cyclooxygenase Inhibitors and the Antiplatelet Effects of Aspirin. In: New England Journal of Medicine. Band 345, Nr. 25, 20. Dezember 2001, S. 1809–1817, doi:10.1056/NEJMoa003199 (freier Volltext).
- ↑ Vorsicht bei Ibuprofen mit Acetylsalicylsäure. In: Pharmazeutische Zeitung. PZ Nr. 28, 2004.
- ↑ University of Maryland: Possible Interactions with: Zinc. abgerufen am 28. September 2013.
- ↑ Julia Nakagawa u. a.: Nebenwirkungen durch nicht zugelassene nichtsteroidale Entzündungshemmer (NSAID) bei 21 Hunden. In: Kleintierpraxis. 2010, 55, S. 364–370.