Benutzer:Sivizius/HSAB-Konzept
Das HSAB-Konzept (auch Pearson-Konzept genannt) ist das Akronym für „Hard and Soft Acids and Bases“, also das Konzept der „Harten und Weichen Säuren und Basen“, und zählt zu den Säure-Base-Konzepten.
Der amerikanische Chemiker Ralph G. Pearson veröffentlichte das Konzept 1963.[1] Das HSAB-Konzept wird in vielen Bereichen der Chemie genutzt, um die Stabilität von Verbindungen und deren Reaktivität abzuschätzen.
Es basiert auf dem Lewis-Säure-Base-Konzept, also auf der Reaktivität von Elektronenpaardonatoren (Lewis-Basen) und Elektronenpaarakzeptoren (Lewis-Säuren).
Grundaussagen des Modells und Abschätzung von ‚Härte‘ und ‚Weichheit‘
[Bearbeiten | Quelltext bearbeiten]| Hart | Weich |
|---|---|
| Kleine Ionenradien | Große Ionenradien |
| Hohe Ladungen | Geringe Ladungen |
| Geringe Polarisierbarkeit | Große Polarisierbarkeit |
Innerhalb dieses Konzepts wird zwischen harten und weichen Basen sowie zwischen harten und weichen Säuren unterschieden.
- „Hart“ beschreibt dabei Teilchen (Atome, Ionen und Moleküle), die eine hohe Ladungsdichte aufweisen, also eine hohe Ladung und einen kleinen Radius (großes „Ladungs/Radien-Verhältnis“).
- „Weich“ bezeichnet dagegen Teilchen mit geringer Ladungsdichte, also solche mit geringer Ladung und großem Radius (kleines „Ladungs/Radien-Verhältnis“).
Darüber hinaus sind harte Teilchen kaum polarisierbar (aber stark polarisierend)[2] und weiche Teilchen leicht polarisierbar (aber schwach polarisierend).[3]
Eine Faustregel für Anionen ist die Betrachtung der Stabilität der Halogenide: Das Fluorid-Ion sollte demnach als harte Base mit harten Metall-Ionen stabile Verbindungen bilden, während umgekehrt weiche Säuren das weiche Iodid bevorzugen sollten.
Beispiele
[Bearbeiten | Quelltext bearbeiten]- Eine klassische harte Säure ist das Proton, eine harte Base das Fluorid-Ion. Eine wässrige Lösung von Fluorwasserstoff weist demnach eine geringere Dissoziation als die höheren Halogenwasserstoffe auf.
- Weich sind hingegen das Cadmium(II)-Ion als Säure und das Sulfid-Ion als Base. Cadmiumsulfid sollte also ein eher schlecht in Wasser lösbarer Stoff sein.
Die Bindung zwischen Lewis-Säure und Lewis-Base in Addukten, die von weichen Spezies gebildet wird, hat einen eher kovalenten Charakter, die Bindung zweier harter Spezies ist eher elektrostatisch (ionisch) zu beschreiben.
Anwendung
[Bearbeiten | Quelltext bearbeiten]Das Konzept dient meist mehr der qualitativen als der quantitativen Beschreibung von chemischen Reaktionen. Es wurden aber auch einige erfolgreiche quantitative Modelle etabliert, um die Dissoziationsenergien von Lewis-Säure-Base-Addukten zu bestimmen.
Praktische Anwendung findet das HSAB-Konzept beispielsweise in der qualitativen Analyse (Trennungsgang). Obwohl der klassische Trennungsgang weit älter ist als das HSAB-Konzept, kann seine Funktionsweise großenteils mit dem HSAB-Konzept verstanden werden. Außerdem ist es sehr hilfreich beim Verständnis der Strukturen und Reaktionsweisen von Komplexen. Auch in der Goldschmidt-Klassifikation in der Geologie bestätigen sich die Vorhersagen des Pearson-Konzeptes.
Beispiele
[Bearbeiten | Quelltext bearbeiten]- Das Silber-Kation ist eine weiche Säure; demnach sollte die Stabilität der Silberhalogenide von Fluor nach Iod zunehmen. Tatsächlich bestätigt sich dies: Während Silberfluorid leicht löslich ist, bilden Chlorid, Bromid und Iodid zunehmend stabilere (zunehmend schwerlöslichere) Verbindungen mit hohen kovalenten Bindungsanteilen.
- Nach HSAB sollte Flusssäure HF eine schwache Säure sein, weil die Bindung zwischen H und F starke ionische Anteile hat. In der Tat steigt die Stärke der Halogenwasserstoffsäuren von HF mit pKs von rund +3 bis zum HI mit einem pKs von −10; demnach ist Iodwasserstoffsäure 10 Billionen mal saurer als HF.
Grenzen
[Bearbeiten | Quelltext bearbeiten]Trotz vieler richtiger Vorhersagen kann das HSAB-Konzept versagen, wenn andere Effekte überwiegen:
- Nach HSAB sollten Natrium-Ionen mit Hydroxid oder Fluorid stabile Salze bilden; diese sind aber leicht in Wasser löslich, weil es zur Hydratation durch das Lösemittel kommt.
- Bei der Perchlorsäure sollte sich ähnlich wie bei HF eine niedrige Säurestärke feststellen lassen; die Perchlorsäure ist tatsächlich aber eine der stärksten Säuren, die es gibt. Hier überwiegt die große Stabilität des hochsymmetrischen Perchlorat-Anions.
Selbst für qualitative Aussagen müssen also konkurrierende Effekte in die Überlegungen miteinbezogen werden.
Einteilung einiger Säuren und Basen
[Bearbeiten | Quelltext bearbeiten]| Säuren | Basen |
|---|---|
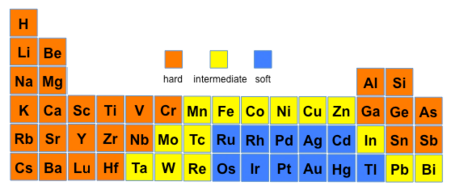
|
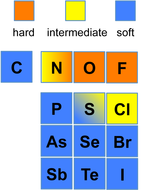
|
| harte Säuren und Basen | |
| Säuren und Basen im Grenzbereich | |
|
|
|
| weiche Säuren und Basen | |
Literatur
[Bearbeiten | Quelltext bearbeiten]- Ralph G. Pearson: The HSAB Principle – more quantitative aspects. In: Inorganica Chimica Acta. Vol. 240, No. 1/2, 1995, ISSN 0020-1693, S. 93–98.
- Duward F. Shriver, Peter W. Atkins, Cooper H. Langford: Anorganische Chemie. 2. Auflage. Wiley VCH, Weinheim 1997, ISBN 3-52729250-0.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ R. G. Pearson: Hard and Soft Acids and Bases. In: Journal of the American Chemical Society. Bd. 85, Nr. 22, 1963, S. 3533–3539, doi:10.1021/ja00905a001.
- ↑ Eintrag zu hard acid. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.H02740 – Version: 2.3.2.
- ↑ Eintrag zu soft base. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.H02742 – Version: 2.3.2.






































