Bis(3-aminopropyl)amin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | Bis(3-aminopropyl)amin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H17N3 | |||||||||||||||
| Kurzbeschreibung |
farblose bis hellgelbe Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 131,22 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
mischbar mit Wasser, löslich in Diethylether und Ethanol[3] | |||||||||||||||
| Brechungsindex |
1,481 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Bis(3-aminopropyl)amin ist ein Polyamin, das eine sekundäre und zwei primäre Aminogruppen aufweist und in wässriger Lösung stark basisch reagiert. Wie andere Polyamine wird Dipropylentriamin als Härter für Epoxidharze, sowie als Ausgangsstoff für Vulkanisationsbeschleuniger, Emulgatoren und Korrosionsschutzmittel verwendet. Einige Derivate weisen in vitro antibakterielle[5] und krebshemmende[6] Eigenschaften auf.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Bis(3-aminopropyl)amin (Norspermidin) kommt im Gegensatz zu dem unsymmetrischen Polyamin Spermidin nicht in tierischen Zellen, sondern nur in einfachen Organismen, wie z. B. Bakterien, vor.[7]
Durch Addition von Acrylnitril an Ammoniak wird bei geeigneter Verfahrensführung (30%ige wässrige Ammoniaklösung) Bis(2-cyanoethyl)amin in Ausbeuten von über 90 % erhalten.[8][9]

Die katalytische Hydrierung der beiden Nitrilgruppen liefert Dipropylentriamin.[10]
Bei der Reaktivdestillation von Propan-1,3-diamin mit Wasserstoff bei erhöhten Drücken (5 bis 10 bar) und Temperaturen (140 bis 160 °C) in Gegenwart von Palladium auf Zirkondioxid als Hydrierkatalysator entsteht Dipropylentriamin mit Selektivitäten über 70 % und 1,3-Diaminopropan-Umsätzen größer 50 %.[11]

Durch die Reaktivdestillation wird die Bildung höherer Propylenamine, wie z. B. Tris(3-aminopropyl)amin, unterdrückt.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bis(3-aminopropyl)amin ist eine aminartig riechende klare Flüssigkeit, die sich vollständig mit Wasser mischt und in Diethylether und Ethanol löslich ist.[3] Im Vergleich zu dem homologen Spermidin ist Norspermidin sehr giftig und vermutlich mutagen.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Das trifunktionelle Polyamin Dipropylentriamin (DPTA) findet – meist zusammen mit anderen mehrwertigen Aminen – Verwendung als Härter für Epoxidharze, z. B. in Bodenbeschichtungen.[12]
Als Reduktionsmittel bei der Vulkanisation von Synthesekautschuk und Naturkautschuk werden ebenfalls Polyamine, wie z. B. Dipropylentriamin eingesetzt.[13]
Amphiphile Derivate des Bis(2-aminoethyl)amins mit langen (C12–C18) Seitenketten, z. B. Dodecyldipropylentriamin, sind bakterizid bzw. antimikrobiell wirksam.[5] Sie hemmen die Bildung von Biofilmen und werden als Desinfektionsmittel und Biozide verwendet.[14][15]
Mehrkernige Komplexe von Norspermidin mit zweiwertigem Platin Pt(II) und insbesondere zweiwertigem Palladium Pd(II) weisen tumorhemmende Eigenschaften auf Brustkrebs-Zellen auf.[6]
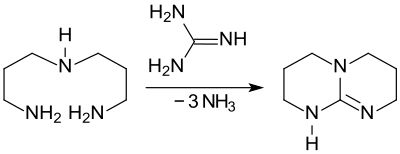
Bis(2-aminoethyl)amin ist Ausgangsverbindung für die bicyclische anellierte Guanidin-Base Triazabicyclodecen TBD.[16]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Datenblatt Bis(3-aminopropyl)amine, 98 % bei Sigma-Aldrich, abgerufen am 25. November 2018 (PDF).
- ↑ a b c d e f g h i Eintrag zu 4-Azaheptan-1,7-diamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. November 2018. (JavaScript erforderlich)
- ↑ a b Eintrag zu 3,3'-Diaminodipropylamine bei TCI Europe, abgerufen am 25. November 2018.
- ↑ Eintrag zu Dipropylentriamin im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 30. Dezember 2018. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b B. Brycki, I. Kowalczyk, J. Werner, T. Pospieszny, A. Kozirog: Synthesis and structural analysis of novel norspermidine derivatives. In: Int. J. Org. Chem. Band 7, Nr. 2, 2017, S. 106–139, doi:10.4236/ijoc.2017.72010.
- ↑ a b T.M. Silva, S. Andersson, S.K. Sukumaran, M.P. Marques, L. Persson, S. Oredsson: Norspermidine and novel Pd(II) and Pt(II) polynuclear complexes of norspermidine as potential antineoplastic agents against breast cancer. In: PLOS ONE. Band 8, Nr. 2, 2013, S. e55651, doi:10.1371/journal.pone.0055651.
- ↑ A. J. Michael: Polyamines in eukaryotes, bacteria, and archaea. In: J. Biol. Chem. Band 291, Nr. 29, 2016, S. 14896–14903, doi:10.1074/jbc.R116.734780.
- ↑ Patent US4055586: Process for the manufacture of bis-(2-cyanoethyl)-amine. Angemeldet am 20. Oktober 1976, veröffentlicht am 25. Oktober 1977, Anmelder: Ruhrchemie AG, Erfinder: H. Feichtinger, W. Payer, B. Cornils, J. Weber.
- ↑ Patent US6342492B1: Anti-viral triaza compounds and compositions. Angemeldet am 16. Februar 1996, veröffentlicht am 29. Januar 2002, Anmelder: The Research Foundation of State University of New York, Erfinder: T.W. Bell.
- ↑ R.J. Bergeron, J.R. Garlich: Amines and polyamines from nitriles. In: Synthesis. Band 9, 1984, S. 782–784, doi:10.1055/s-1984-30973.
- ↑ Patent WO2006082203A1: Verfahren zur Herstellung von Bis(3-aminopropyl)amin (Dipropylentriamin, DPTA). Angemeldet am 1. Februar 2006, veröffentlicht am 10. August 2006, Anmelder: BASF AG, Erfinder: J.-P. Melder, T. Krug.
- ↑ MC-DUR rapid Primer-Komponente B. (PDF; 203nbsp;KB) In: mc-bauchemie.de. MC-Bauchemie Müller GmbH&Co. KG, archiviert vom (nicht mehr online verfügbar) am 18. Dezember 2018; abgerufen am 1. Dezember 2018.
- ↑ Patent DE4037814B4: Verfahren zum Vulkanisieren von Gummilatex mit Peroxid unter Benutzung von Acrylatester als Beschleuniger. Angemeldet am 28. November 1990, veröffentlicht am 25. August 2005, Anmelder: Japan Atomic Energy Research Institute, Erfinder: K. Makkuuchi, F. Yoshii, I. Ishigaki, S. Iskandar.
- ↑ Triameen Y12D-30. (PDF; 60nbsp;KB) In: akzonobel.com/sc. AkzoNobel Surface Chemistry AB, abgerufen am 1. Dezember 2018 (englisch).
- ↑ Triameen Y12D – The high performing, non-sensitizing biocide without MRL. (PDF; 90nbsp;KB) In: akzonobel.com/sc. AkzoNobel Surface Chemistry AB, abgerufen am 1. Dezember 2018 (englisch).
- ↑ S. Usachev, A. Gridnev: Convenient preparation of bicyclic guanidines. In: Synth. Commun. Band 41, Nr. 24, 2011, S. 3683–3688, doi:10.1080/00397911.2010.519848.


