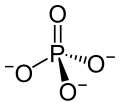
Bismut(III)-phosphat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bismut(III)-phosphat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | BiPO4 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 303,95 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
6,32 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Bismut(III)-phosphat ist eine anorganische chemische Verbindung des Bismuts aus der Gruppe der Phosphate.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Bismut(III)-phosphat kann durch Reaktion von Bismut(III)-nitrat mit Phosphorsäure gewonnen werden.[2]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bismut(III)-phosphat ist ein farbloser Feststoff.[1] Er wird von Wasser und verdünnten Säuren nur wenig gelöst und auch von siedendem Wasser nicht hydrolysiert. Er kristallisiert bei Raumtemperatur wasserfrei monoklin[2] mit einer Kristallstruktur vom Monazit-Typ. Daneben existieren noch eine ebenfalls monokline Hochtemperaturform, die sich ab 750 °C aus der Niedertemperaturform bildet und ein trigonales Hydrat.[3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Es wird zur Kopräzipitation von Polonium, für Untersuchungen des Zusammenhangs zwischen Plutonium-Strahlenbelastung und Leukämie-Sterblichkeit sowie als Katalysator zur Ammonoxidation von Propylen und der Zersetzung von Dichlordifluormethan verwendet.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Datenblatt Bismuth(III) phosphate, 99.99% bei Sigma-Aldrich, abgerufen am 2. Januar 2014 (PDF).
- ↑ a b c Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 603.
- ↑ Jane E. Macintyre: Dictionary of Inorganic Compounds, Supplement 4. CRC Press, 1996, ISBN 0-412-75020-1, S. 7 (eingeschränkte Vorschau in der Google-Buchsuche).
