Botulinumtoxin
| Botulinumtoxin Serotyp A (Clostridium botulinum) | ||
|---|---|---|
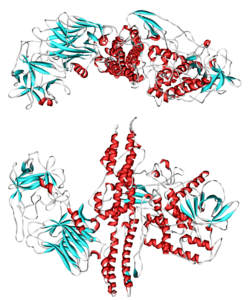
| ||
| Bändermodell nach PDB 3BTA | ||
|
Vorhandene Strukturdaten: siehe UniProt-Eintrag | ||
| Masse/Länge Primärstruktur | 447+848 AS (L+S) | |
| Sekundär- bis Quartärstruktur | Heterodimer L+S | |
| Kofaktor | Zn2+ | |
| Präkursor | 1296 Aminosäuren; 146 kDa | |
| Bezeichner | ||
| Gen-Name(n) | BoNT/A | |
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | M03AX01 | |
| DrugBank | DB00083 | |
| Wirkstoffklasse | Muskelrelaxans | |
| Transporter-Klassifikation | ||
| TCDB | 1.C.8 | |
| Bezeichnung | Botulinum/Tetanus Toxinfamilie | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.24.69, Metalloprotease | |
| MEROPS | M27.002 | |
| Reaktionsart | Hydrolyse | |
| Substrat | Proteine der Neuroexozytose, Synaptobrevine, Syntaxine | |
| Produkte | Spaltprodukte | |
| Vorkommen | ||
| Homologie-Familie | Botulinumtoxin | |
| Übergeordnetes Taxon | Clostridium | |
Botulinumtoxin (BTX), auch Botulinum-Neurotoxin (BoNT), Botox (umgangssprachlich), Botulismustoxin, Botulinustoxin, Botulin ist ein Sammelbegriff für mehrere sehr ähnliche neurotoxische Proteine. Die Neurotoxine werden von verschiedenen Stämmen der Bakterienspezies Clostridium botulinum, Clostridium butyricum, Clostridium baratii sowie Clostridium argentinense[1] gebildet und ausgeschieden; es sind damit Exotoxine.[2]
Die Wirkung dieser Proteine beruht auf der Hemmung der Erregungsübertragung von Nervenzellen, was neben Störungen des vegetativen Nervensystems insbesondere eine Muskelschwäche bis hin zum Stillstand der Lungenfunktion zur Folge haben kann. Botulinumtoxin ist für Lebewesen wie den Menschen ein tödliches Gift. Die LD50-Werte für Mäuse betragen 3 ng/kg bei Inhalation[3] bis 4 ng/kg bei subkutaner Aufnahme.[4]
Die Vergiftung mit Botulinustoxinen wird Botulismus genannt und ist eine gefürchtete Lebensmittelvergiftung. Sie kann auch infolge von Darminfektionen und Wundinfektionen mit C. botulinum auftreten. Seit den 1980er-Jahren werden die von dem Bakterium erzeugten toxischen Proteine zu medizinischen Zwecken eingesetzt, vorwiegend zur Behandlung neurologischer Bewegungsstörungen (Dystonie, Spastik, Sialorrhoe). Die Verwendung in der kosmetischen Medizin zur vorübergehenden Abschwächung von Falten (Wirkungsdauer 3–6 Monate) ist in Deutschland seit 1993 zugelassen,[5] wird aber aufgrund der dadurch bedingten massiven Zunahme von Tierversuchen heftig kritisiert.[6][7][8] Außerdem besteht das Risiko gravierender Nervenschäden ohne medizinische Notwendigkeit für den Eingriff.
Clostridium botulinum kommt ubiquitär im Erdboden wie im Sediment von Gewässern vor und bildet widerstandsfähige Endosporen, ebenso wie Clostridium tetani, welches das strukturell ähnliche Tetanustoxin produziert. Welchen evolutionären Nutzen solche für den Wirt pathogenen Wirkstoffe dem parasitierenden Mikroorganismus bringen, ist Gegenstand der Diskussion.[9]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Der Botulismus wurde im Februar 1815 vom württembergischen Arzt und Dichter Justinus Kerner das erste Mal wissenschaftlich beschrieben. Kerner erkannte 1820 den Wirkungsmechanismus des Toxins als Hemmung der Nervenleitung und schlug 1822 das Gift, das er als „Fettgift“ und „Fettsäure“ bezeichnete,[10] in extrem niedrigen Dosen als Arzneistoff für verschiedene nervöse Störungen vor.[11] Die Mediziner Rupprecht und Müller bezeichneten 1868 die Vergiftung erstmals als Botulismus.[12]

Das die Vergiftungen verursachende Bakterium wurde 1895–1897 von Emile van Ermengem, einem belgischen Bakteriologen, bei der Untersuchung von Schinken, der damit befallen war und zu drei Todesfällen führte, isoliert. Van Ermengem nannte den Mikroorganismus zunächst Bacillus botulinus, heute wird er als Clostridium botulinum bezeichnet. Schon 1897 stellte Walter Kemper das erste Antiserum gegen Botulinustoxin A her.[10]
Nachdem ab den 1920er-Jahren Botulinumtoxine in größeren Mengen gewonnen werden konnten, gelang 1946 Carl Lammanna in Fort Detrick (Maryland) am USAMRIID die Reindarstellung des Toxintyps A. Dabei wurde der schon früher vermutete Aufbau aus zwei verschiedenen Proteinketten verifiziert.
1949 wiesen Burgen, Dickens und Zatman in London die Hemmung der Acetylcholinsekretion als Ursache der Muskellähmung durch Botulinumtoxin A nach.[13] Bis um 1970 wurden insgesamt sieben verschiedene Neurotoxin-Serotypen (A, B, C1, D, E, F und G) isoliert.
1973–1978 wurde das Protein erstmals unter Schantz nach einem durch die FDA zugelassenen Verfahren an Freiwilligen als Arzneistoff getestet und 1980 durch Scott erstmals zur Medikation von Strabismus (Schielen) eingesetzt. 1989 erteilte die US-amerikanische Zulassungsbehörde FDA die erste Arzneimittelzulassung für ein Botulinumtoxin-Präparat. Unter dem Namen Oculinum wurde Botulinumtoxin A für die Indikationen Nystagmus („Augenzittern“) und Blepharospasmus (Lidkrampf) zugelassen. Nachdem die Firma Allergan das Produkt 1991 vom damaligen Hersteller übernommen hatte, wurde der Handelsname 1992 in Botox abgeändert. 1993 erfolgte die Zulassung von Botox in Deutschland, ebenso die des Wettbewerberprodukts Dysport (Ipsen).[14][15] Im Jahr 1995 wurde in Deutschland von der Firma Merz Pharmaceuticals das Produkt Xeomin zugelassen.
Innerhalb weniger Jahre kamen als weitere Indikationen Spastiken der Gesichtsmuskulatur und Beine, Torticollis spasmodicus (zervikale Dystonie, „Schiefhals“) sowie Sialorrhoe („vermehrter Speichelfluss“) hinzu.[10]
1992 veröffentlichten J. und A. Carruthers einen Bericht[16] über einen vorübergehenden abschwächenden Effekt von Botulinustoxin A auf Hautfalten (Wirkungsdauer 3–6 Monate).[17] Seither wurde das Toxin im kosmetischen Bereich off-label eingesetzt. Eine Zulassung für diese Verwendung erhielten Präparate erst ab 2002.[6]
Seit 2001 wird auch Botulinumtoxin B zur Behandlung der zervikalen Dystonie verwendet.[13]
Etymologie
[Bearbeiten | Quelltext bearbeiten]Die Namen für das Bakterium und das Toxin sind von dem lateinischen Wort botulus ‚Wurst‘ abgeleitet, ebenso wie die schon zuvor eingeführte Bezeichnung Botulismus für das Krankheitsbild bei einer Wurstvergiftung. Der Grund ist, dass Vergiftungen mit dem Botulinumtoxin früher häufig im Zusammenhang mit Wurst oder Wurstkonserven standen. Darauf beruht auch die historische Bezeichnung Wurstgift (englisch sausage poison).[18]
Das hauptsächlich den Botulismus verursachende Bakterium Clostridium botulinum ist ubiquitär als Spore anzutreffen.[19] Das Bakterium benötigt nichtsaure, extrem sauerstoffarme Milieubedingungen, um auszukeimen und das Toxin zu produzieren. Solche Bedingungen sind in Wurst- und Gemüsekonserven sowie vakuumverpackten Lebensmitteln meist gegeben; zudem gilt die anaerobe Kernzone von Fleisch und Wurst meist als exzellentes Substrat für das Wachstum von Clostridium.[20]
Struktur
[Bearbeiten | Quelltext bearbeiten]
Botulinumtoxine sind hochmolekulare Proteinkomplexe aus der Gruppe der AB-Toxine, die aus zwei Teilen bestehen: Teil A als der leichten Kette, dem eigentlichen lähmend (paralytisch) wirkenden Neurotoxin, sowie Teil B als der schweren Kette, einem nichttoxischen Protein, das eine Bindung an Nervenzellen und eine Aufnahme vermittelt. Über eine Disulfidbrücke sind die beiden Bestandteile miteinander verbunden. Der leichtere neurotoxische Teil ist eine zinkhaltige Endopeptidase. Der B-Teil bindet an die präsynaptische Membran von Nervenzellen.[20] Nach Aufnahme in Synaptische Vesikel bildet der N-Terminus der schweren Kette durch die Absenkung des pH-Werts eine Membranpore. Zudem wird die Disulfidbrücke gespalten, wodurch die neurotoxische leichte Kette ins Cytosol diffundieren kann.
Der B-Teil schützt das Neurotoxin vor dem proteolytischen Abbau im sauren Milieu des Magens nach oraler Applikation, so dass das Toxin biologisch verfügbar bleibt und Vergiftungen auslösen kann.[21] Der Komplex dissoziiert jedoch bei neutralem pH-Wert des Gewebes und ist nicht mehr stabil.[22] Ebenfalls instabil wird das Protein bei längerem Erhitzen. Bei der therapeutischen Applikation des Botulinumtoxins haben die Komplexproteine daher keine wesentliche Funktion und tragen nicht zur Wirksamkeit bei. Diskutiert wird allerdings, ob Unterschiede in der klinischen Wirksamkeit der zugelassenen Medikamente (zum Beispiel die Diffusionskapazität bzw. Ausbreitungsfähigkeit) auf die unterschiedlichen Arten der vorhandenen Hüllproteine zurückzuführen sein können.
Toxintypen
[Bearbeiten | Quelltext bearbeiten]Serologisch unterscheidet man die Botulinumtoxine in die Typen A bis G, von denen A und B medizinisch genutzt werden. Lediglich die Typen A, B, E und F sind toxisch für den Menschen.[23] Die Botulinumtoxine besitzen eine große Ähnlichkeit in Bezug auf ihre Struktur und biochemische Wirkung mit dem ebenfalls von Clostridien (Clostridium tetani) gebildeten Tetanustoxin.[24]
| Typ | Einige Organismen, in denen der Typ wirksam ist[24] | Toxisch für Menschen[23] | UniProt / UNII | Varianten, Anmerkungen |
|---|---|---|---|---|
| A | Mensch (hauptsächlich USA), Küken | ja | UniProt P0DPI0 UniProt P0DPI1 (A1) UniProt Q45894 (A2) UNII: E211KPY694 |
Das medizinisch genutzte BoNT/A existiert in verschiedenen nativen, d. h. komplexierten Formen[A 1][A 2][A 3][A 4][A 5] sowie auch aufgereinigten Formen, die frei von Komplexproteinen[A 6][A 7][A 8] sind.[25] |
| B | Mensch (hauptsächlich Europa), „Kinder-Botulismus“, Pferde, Rinder | ja | UniProt P10844 (B) UniProt B1INP5 (B1) UNII: 0Y70779M1F |
Rimabotulinumtoxin B[A 9] |
| C | Wasservögel (C1); Rinder, Pferde, Nerze (C2) |
nein | UniProt P18640 UNII: FPM7829VMX |
Botulinumtoxin C1 (Botulinumneurotoxin C)[A 10] Botulinumtoxin C2[A 11][A 12] |
| D | Rinder, Geflügel | nein | UniProt P19321 UNII: 331HTW151K |
|
| E | Mensch | ja | UniProt Q00496 UniProt P30995 UNII: T579M564JY |
|
| F | Mensch | ja | UniProt A7GBG3 UniProt P30996 UNII: U1R2P71O7G |
|
| G | Vergiftungsfälle bisher unbekannt | nein | UniProt Q60393 UNII: 2C3DD06QGJ |
Gebildet von Clostridium argentinense[A 13] |
Neben den bisher sieben allgemein anerkannten „klassischen“ BoNT-Serotypen wurden mehrere neuartige BoNT-Typen postuliert. 2013 gab eine Forschergruppe in den USA an, in der Stuhlprobe eines Kindes einen weiteren Serotyp entdeckt zu haben, den sie als ‚Typ H‘ bezeichneten (BoNT/H).[26] Die DNA-Struktur wurde trotz ihrer Entschlüsselung zunächst geheim gehalten.[27][28] Untersuchungen des Centers for Disease Control and Prevention (CDC) zeigten später, dass es sich um einen Hybridtyp handelt mit strukturellen Ähnlichkeiten zu den Serotypen A und F.[29] BoNT/X[30] ist ein neuer Serotyp, der ebenfalls von C. botulinum gebildet wird. Eine auf molekularer Ebene den Botulin-Neurotoxinen ähnliche Variante ist das eBoNT/J[31] (auch BoNT/En genannt) das jedoch durch ein Gen des Enterococcus faecium codiert wird.[32]
Durch Fortschritte in der DNA-Sequenzierungs-Technik konnten ferner Unterschiede innerhalb einzelner Serotypen aufgezeigt werden, was zur Einführung von Subtypen führte. Solche Subtypen können sich innerhalb eines Serotyps auf Aminosäureebene um bis zu 36 % unterscheiden. Bis 2019 wurden in der Literatur mehr als 40 Subtypen beschrieben. Es wurde gezeigt, dass sich die Subtypen eines Serotyps in ihrer biologischen Aktivität unterscheiden, beispielsweise in der Kinetik der Aufnahme und Substratspaltung, der Affinität zu Rezeptoren oder der Gesamtaktivität.[32]
Wirkungsmechanismus
[Bearbeiten | Quelltext bearbeiten]Botulinumtoxin hemmt die Erregungsübertragung von Nervenzellen auf andere Zellen, insbesondere an den Synapsen zu Muskelzellen, wodurch eine Kontraktion des Muskels schwächer wird oder ganz ausfällt. Botulinumtoxine sind Proteine, die im Bakterium zunächst als lange Polypeptidketten hergestellt und durch Proteasen gespalten aktiviert werden. Sie bestehen dann aus zwei Protein-Untereinheiten, leichte (L-, ca. 50 kDa) bzw. schwere (S-, ca. 100 kDa) Kette genannt.[23]
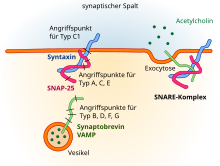
Von Strukturmerkmalen der schweren Kette hängt die Gewebespezifität des Giftes ab. Denn hiermit bindet sich Botulinumtoxin an den präsynaptischen Teil eines Neurons, das Acetylcholin als Neurotransmitter verwendet – wie an einer neuromuskulären Endplatte. Anteile der schweren Kette vermitteln auch, dass das Gift durch Endocytose in die präsynaptische Endigung aufgenommen wird.
Die in den Zellinnenraum der Nervenzelle gelangende leichte Kette ist der aktive Teil des Toxins. Sie trägt Strukturmerkmale mit katalytischer Aktivität und wirkt nun als Zink-Endopeptidase. Damit ist sie in der Lage, bestimmte Funktionsproteine der Zelle zu zerlegen, die für die synaptische Vesikelfusion gebraucht werden. Durch diese Wirkung behindert das Gift die Exozytose als den Vorgang, mit dem der in Vesikeln enthaltene Botenstoff in den synaptischen Spalt abgegeben wird. Die Übertragung von neuronalen Signalen auf Muskelzellen wird somit blockiert.
Das Membranprotein Synaptobrevin (VAMP2), das ein wesentlicher Bestandteil sekretorischer Vesikel ist, wird bereits durch die Anwesenheit weniger Botulinumtoxinmoleküle der Typen B, D, F und G aufgrund der katalytischen Wirkung aufgespalten, ohne dass sich das Botulinumtoxin dabei selbst verbraucht. Die Botulinumtoxine A und E spalten das Synaptisch-assoziierte Protein SNAP-25; der Serotyp C zerstört Syntaxine.[34]
Wenn synaptische Vesikel nicht mehr mit der Membran fusionieren können, wird ihr Transmitter Acetylcholin nicht mehr in den synaptischen Spalt ausgeschüttet. Die betroffene Nervenzelle kann somit die zugeordnete Muskelfaser nicht mehr hinreichend erregen und es kommt dadurch zu einer Lähmung des Muskels, an dem das Gift wirkt.[35] Bei der Reaktivierung der unterbrochenen neuromuskulären Transmission übernehmen zunächst neuauswachsende präsynaptische Endigungen vorübergehend die Funktion der gestörten Axonterminalen des Nervenzellfortsatzes.[36]
Vergiftung
[Bearbeiten | Quelltext bearbeiten]Jährlich wurden vor 2009 in Deutschland 20–40 Fälle von Botulismus gemeldet, von denen 1–2 tödlich endeten.[23] Im Jahr 2018 kam es zu neun Fällen und 2019 zu sieben Erkrankungen.[37] Selten tritt der „viszerale Botulismus“ auf, der als „Säuglingsbotulismus“ oder „infantiler Botulismus“ bei Säuglingen[38] und als „adulter infektiöser Botulismus“ bei Erwachsenen mit seltener Prädisposition als Infektion vorkommt. Dabei entwickelt sich das Bakterium aus über die Nahrung aufgenommenen Sporen im Dünndarm und produziert dort die Toxine.[39] Als Antidot für alle Formen des Botulismus kommt entweder ein trivalentes (Typen A, B, E) oder ein polyvalentes Antiserum (Typen A–G) zum Einsatz,[23] in den USA auch das Heptavalent Botulism Antitoxin. Alle drei werden aus Pferden gewonnen.
Gefährdete Lebensmittel
[Bearbeiten | Quelltext bearbeiten]In erster Linie sind Lebensmittel gefährdet, die unter anaeroben Bedingungen gelagert sind und deren Milieu nur schwach sauer oder neutral ist (pH > 4,5). Begünstigt werden kann die Bildung des Toxins durch geringen Salzgehalt und Lagertemperaturen über 10 °C, wobei Letzteres bei Konserven oft gegeben ist. C. botulinum stellt zudem hohe Nährstoffansprüche und benötigt daher ein komplexes Nährmedium. Klassischerweise gefährdet sind demnach Fleisch- und Fischkonserven, Mayonnaise, aber auch schwachsaure Frucht- oder Gemüsekonserven. Nicht gefährdet sind bei den Fleischprodukten hingegen (stark) gepökelte Produkte, da das im Pökelsalz enthaltene Nitrit C. botulinum im Wachstum hemmt.
Kennzeichen kontaminierter Produkte
[Bearbeiten | Quelltext bearbeiten]Ein wichtiges Indiz bei Konserven ist die Bombage (bzw. Bombierung), die Wölbung der Konservendeckel nach außen durch den entstehenden Innendruck.[24] Entweichende Gase beim Öffnen eingemachter Produkte deuten ebenfalls auf eine Kontamination hin; in den meisten Fällen sind sie mit einem unangenehmen Geruch verbunden. Obwohl solche Konserven sofort entsorgt werden müssen, lassen sich hieraus keine Rückschlüsse über den Befall mit Botulinumtoxin erzeugenden Bakterien ziehen, denn gerade die Produktion des Giftes unter anaeroben Bedingungen und ohne Entwicklung von Gasen stellt eine große Gefahr dar. Besteht Unsicherheit, ob die beschriebenen Kennzeichen zutreffen, ist es empfehlenswert, aus Sicherheitsgründen den Konserveninhalt einige Minuten (5 Minuten bei 100 °C sind bei normalen Konservenvolumen sicher[23]) durchzukochen. Als hitzelabiles Protein wird das Botulinumtoxin dadurch denaturiert und unwirksam.
Symptome beim Menschen
[Bearbeiten | Quelltext bearbeiten]Die ersten Erscheinungen der als Botulismus bezeichneten Vergiftung treten nach 12 bis 40 Stunden auf und umfassen in der Regel Kopf- und Magenschmerzen, Übelkeit und Erbrechen[24] sowie Schluck-, Sprech- und Sehstörungen, gefolgt von Muskellähmungen.[23] Insbesondere die Lähmung der Augen- (Doppelsehen)[34] und der Nackenmuskulatur (Halssteifigkeit) sind deutliche Hinweise auf Botulismus. In diesem Stadium der Vergiftung kann eine Bekämpfung mit Antitoxin noch möglich sein. Ohne Behandlung tritt in 50 % der Fälle nach 3–6 Tagen der Tod durch Atemlähmung ein.[23]
Meldepflicht
[Bearbeiten | Quelltext bearbeiten]In Deutschland ist der direkte oder indirekte Nachweis des Toxins nach § 7 Absatz 1 des Infektionsschutzgesetzes namentlich meldepflichtig.
Vorbeugende Maßnahmen
[Bearbeiten | Quelltext bearbeiten]Das Toxin ist ein Protein, das beispielsweise durch Erhitzen denaturiert und damit inaktiviert werden kann. Seine Hitzestabilität ist am höchsten bei einem pH-Wert von etwa 5,5; auch unter diesen Bedingungen wird das Botulinumtoxin selbst thermisch inaktiviert bei Kerntemperaturen von über 85 °C für 5 Minuten oder länger.[40]
Die Sporen der toxinproduzierenden Bakterien, von Clostridium botulinum, sind hitzeresistent und können auch kochendes Wasser einige Zeit überleben. Das anaerobe Bakterium wächst nur bei Abwesenheit von Sauerstoff und in schwach sauren bis basischen Umgebungen (pH-Wert über 4,6). Durch verschiedene geeignete Maßnahmen kann die Vermehrung des Bakteriums – und damit das Auftreten von Botulismus – zuverlässig verhindert werden.[40]
Sterilisierung
[Bearbeiten | Quelltext bearbeiten]Da früher die Sterilisierungstechnik nicht weit entwickelt war, kam es immer wieder vor, dass Sporen von Clostridum botulinum das „Konservieren“, also Erhitzen der Konserven überlebten und während der Lagerung der Konserve mit entsprechenden Folgen auskeimten. Heute wird bei kritischen Produkten der sogenannte „Botulinum-Cook“ durchgeführt;[41] die Lebensmittel werden erhitzt und für 3 Minuten bei 121 °C gehalten (3-facher F0-Wert). Damit werden auch Sporen zuverlässig abgetötet.
Haushalt (Herstellung von Konserven, Einmachen)
[Bearbeiten | Quelltext bearbeiten]- Produkt ausreichend säuern (pH < 4,5)
- Produkt salzen und pökeln[23]
- Konserven bei tiefen Temperaturen lagern (optimal bei < 5 °C)
- Tyndallisierung: Nach dem Einkochen mit einem normalen Kochtopf bei 100 °C kann eine Wiederholung des Einkochprozesses 1 bis 2 Tage später die aus den Sporen hervorgegangenen Bakterien abtöten
Insbesondere die Säuerung ist ein wichtiges Mittel, um C. botulinum zu inaktivieren. Mit einer sorgfältig und ausreichend lange durchgeführten Sterilisation bei Temperaturen über 100 °C können die Sporen ebenfalls sicher abgetötet werden.
Industrie
[Bearbeiten | Quelltext bearbeiten]- Allgemeine Regeln der Arbeitshygiene beachten
- Möglichst wenig verunreinigte Rohware verwenden
- Umsetzung des 3F-Konzepts (Sterilisation 3 Minuten bei 121 °C, F0-Wert) oder 5-minütiges Erhitzen bei 100 °C.[23]
In der Industrie werden bei der Zubereitung gefährdeter Lebensmittel durch entsprechend langes Erhitzen bei Temperaturen über 100 °C das Bakterium und seine Sporen abgetötet und das Toxin inaktiviert.
Therapeutische Anwendung
[Bearbeiten | Quelltext bearbeiten]Indikationen und Wirksamkeit
[Bearbeiten | Quelltext bearbeiten]In der Neurologie wird Botulinumtoxin seit Anfang der 1980er-Jahre als zugelassenes Arzneimittel primär in der Behandlung von speziellen Bewegungsstörungen, den sog. fokalen Dystonien, eingesetzt. Dies sind Erkrankungen wie der Blepharospasmus (Lidkrampf), die oromandibuläre Dystonie (Mund-, Zungen-, Schlundkrampf), der Torticollis spasmodicus (Schiefhals) und andere zervikale Dystonien, der Graphospasmus (Schreibkrampf) und die spasmodische Dysphonie (Stimmbandkrampf). Weiterhin sind auch bei segmentalen oder sekundären Dystonien und Spastiken die Fokalsymptome mit Botulinumtoxin behandelbar.[42] Hierzu zählen etwa der Spasmus hemifacialis, Bewegungsstörungen nach peripherer Affektion des Nervus facialis sowie bestimmte spastische Syndrome bei Erwachsenen und Kindern, beispielsweise bei spastischem Spitzfuß, bei Patienten mit Zerebralparese, bei der Armspastik nach Schlaganfall bzw. bei fokaler Spastik von Hand und Handgelenk nach Schlaganfall. Bei diesen Indikationen wird immer intramuskulär oder subkutan injiziert. Ein Behandlungserfolg mit Besserung bis zum zeitweiligen Verlust der Symptome liegt beim Lidkrampf bei etwa 90 %, beim Schiefhals zwischen 60 und 80 %.[43]
Weitere Anwendungsgebiete:
- Strabismus (Schielen)[44]
- Behandlung von Spannungskopfschmerzen und Migräne (bei chronischer Migräne Leistung der GKV)[45][46]
- Verringerung der Hyperhidrose (übermäßige Schweißproduktion)[47][48]
- Sialorrhoe (Erhöhte Speichelproduktion) (z. B. bei Patienten mit M. Parkinson oder amyotropher Lateralsklerose)[49]
- Bei der Therapie der Achalasie, einer Speiseröhrenengstellung,[50] sowie bei diffusem Ösophagusspasmus (Spasmus der Speiseröhre)[51]
- Bei Patienten mit einer Sphincter-oddi-Dysfunktion (SOD) Typ II[51]
- Zur Behandlung des Morbus Hirschsprung (Aganglionose des Dickdarms)[51]
- Bei Analfissuren[51]
- Bei Blasenfunktionsstörungen (seit 2018 Leistung der GKV)[52]
- Zahlreiche weitere Anwendungsgebiete sind in der Erprobung, z. B. orthopädische Krankheiten[53] (Epicondylitis humeroradialis und humeroulnaris, Plantarfasziitis[54], myofasciale Triggerpunkte der Wirbelsäule u. a.) oder dermatologische Probleme, bei denen jeweils durch eine Muskelrelaxation eine Verbesserung erreicht werden kann.
Zertifizierte ärztliche Ausbildungen werden u. a. vom Arbeitskreis Botulinumtoxin der Deutschen Gesellschaft für Neurologie (DGN) und von der Sektion Schmerz (IGOST)[55] der Deutschen Gesellschaft für Orthopädie und Orthopädische Chirurgie (DGOOC) angeboten.
Wirkmechanismus
[Bearbeiten | Quelltext bearbeiten]Botulinumtoxine sind von Bakterien produzierte Exotoxine. Werden sie in einen Muskel gespritzt, so blockieren sie dort gezielt durch Zerstörung von Proteinkomplexen die Freisetzung des Neurotransmitters Acetylcholin. Dadurch kann der entsprechende Muskel nicht mehr wie gewohnt angespannt werden. Andere Nervenfunktionen – wie das Fühlen oder Tasten – werden nicht beeinflusst. Nach einer therapeutischen Injektion baut sich die Wirkung langsam auf und erreicht – je nach Produkt, Indikation und Dosis – nach etwa zehn Tagen ihren Höhepunkt. Nach zwei bis sechs Monaten ist die Neuaussprossung der Nervenenden beendet, wodurch die Muskeln wieder aktiviert werden können. Die Injektion kann mit gleichzeitiger Messung eines Elektromyogrammes (EMG) im Muskel, der sogenannten Stimulationstechnik, ultraschallgesteuert oder nach anatomischer Kenntnis erfolgen. Es gibt eine Anzahl von Patienten mit Nerven-Muskelkrankheiten, bei denen der Körper nach vorhergehender langer und hochdosierter Anwendung neutralisierende Antikörper gegen den Subtyp A bildet; die Wirksamkeit der Medikamente nimmt dadurch ab oder geht ganz verloren. Seit 2001 sind auch Subtyp-B-Präparate (Neurobloc bzw. Myobloc, Zulassung 2001 gegen Schiefhalssyndrom) verfügbar. Diese besitzen allerdings eine deutlich kürzere Wirkungsdauer.
Überdosierung, Nebenwirkungen und weitere Nachteile
[Bearbeiten | Quelltext bearbeiten]Die therapeutische Breite des Toxins ist bei einem durch Versuche mit Affen ermittelten LD50-Wert von etwa 2000 ng bei intraorbitaler (in die Augenhöhle) Injektion groß; dies entspricht etwa 50 Ampullen Botulinumtoxin.[56] Bei einer Überdosierung, oder wenn das Toxin in die Blutbahn gelangt, steht ein polyvalentes Botulismus-Antitoxin vom Pferd zur Verfügung. Es gehört in größeren Krankenhäusern zum Notfalldepot. Meist erfolgt die intravenöse Injektion aber zu spät und der Patient kann sich nicht sofort vollständig erholen. Eine künstliche Beatmung über längere Zeit ist unabdingbar.
Als Nebenwirkungen bei subkutaner oder intramuskulärer Injektion werden relativ häufig eine Ptosis (beim Lidkrampf), vorübergehende Muskelschwäche, lokale, aus der Injektion resultierende Schmerzen, Mundtrockenheit, Störungen der Akkommodation des Auges sowie Hämatome genannt.[56]
Bei kosmetischer Verwendung wurden am häufigsten Schluckstörungen (Dysphagie) und in Einzelfällen unter anderem Sarkoidose (eine Erkrankung des Bindegewebes) an der Injektionsstelle sowie Blutergüsse durch arterielle Schäden (Pseudoaneurysma) berichtet.[57] In einer systematischen Übersichtsarbeit von 2015 über bekannte Komplikationen bei kosmetischer Verwendung von Botulinumtoxin wurde gefordert, die Patienten vor einem Eingriff über folgende mögliche, ernste Nebenwirkungen aufzuklären: Syndrom des trockenen Auges (Keratoconjunctivitis sicca), Schielen (Strabismus), Doppelsehen (Diplopie), Pseudoaneurysma der oberflächlichen Schläfenarterie (Arteria temporalis superficialis), Nackenschwäche (neck weakness), Stimmstörung (Dysphonie) und Schluckstörungen.[58]
Die lokale Injektion vermindert die Gefahr von Nebenwirkungen (im Gegensatz zu einer wenig sinnvollen systemischen Behandlung), verlangt aber dennoch einen hohen Kenntnisstand beim Anwendenden. Oft wird eine sogenannte Titrierung angewandt, d. h., es wird zunächst eine zu geringe Dosis injiziert, die in zwei- bis dreiwöchigem Abstand durch eine jeweils höhere Menge ergänzt wird.[43]
Lähmt Botulinumtoxin die emotionale Mimik, dann schränken auch gefühlsverarbeitende Hirnregionen – wie die linke Amygdala – ihre Aktivität ein. Dies verhindert das mimische Nachspielen und damit das Verstehen von Emotionen („embodied emotion“, „verkörpertes Gefühl“).[59]
Nachgewiesen ist die systemische Ausbreitung von Botulinumtoxin von der Stelle der lokalen Anwendung in andere Bereiche des Körpers, insbesondere im Nervensystem. Obwohl dieser Ausbreitung bereits Störungen und Schädigungen zugeordnet wurden, sind die zugrundeliegenden Mechanismen der Ausbreitung und ihrer Folgen bisher (Stand 2016) nahezu unerforscht.[57]
Zahnmedizin
[Bearbeiten | Quelltext bearbeiten]Vor der Anwendung von Botulinumtoxin zur Behandlung von Bruxismus (Zähneknirschen), der kraniomandibulären Dysfunktion (Kiefergelenksbeschwerden) sowie zur optischen Verschlankung des Gesichts wird gewarnt, da sie zu massiven Schäden am Kieferknochen führen kann. Botulinumtoxin wird hierzu in den Musculus masseter gespritzt, der die Muskelspannung reduzieren soll. Eine Zeitspanne von drei Monaten zwischen den Injektionen, die üblicherweise eingehalten wird, reiche nicht aus, den verloren gegangenen Knochen wieder zu regenerieren. Teilweise zeigen die Ergebnisse, dass der Kieferknochen auch längerfristig nicht mehr regeneriert. Der Knochenabbau kann zur Zahnlockerung – bis hin zum Zahnverlust – führen und erhöht die Frakturgefahr des Kieferknochens. Die amerikanische Food and Drug Administration (FDA) hat bislang (Stand Januar 2017) die Anwendung von Botulinumtoxin in diesem Bereich nicht zugelassen.[60][61] In der aktuellen S3-Leitlinie Stand 2019 zum Bruxismus wird dagegen der Einsatz von Botulinumtoxin eher positiv bewertet[62].
Faltenunterspritzung
[Bearbeiten | Quelltext bearbeiten]Faltenunterspritzungen im Stirn-, Augen- und Halsbereich, zur Lippen- und Faltenunterfüllung und zur Therapie der Migräneerkrankung sind approbierten Ärzten und Heilpraktikern erlaubt, Zahnärzten und anderen Heilberufsangehörigen sowie Laien hingegen untersagt.[63]
In einem Fall jahrelanger Verstöße gegen das Verbot der Faltenunterspritzung für Zahnärzte bejahte das Oberverwaltungsgericht für das Land Nordrhein-Westfalen die für den Approbationsentzug vorausgesetzte Unzuverlässigkeit eines Zahnarztes.[64] Man hielt dem Zahnarzt sein langjähriges und hartnäckiges Verhalten vor, was er nur durch einen ernsthaften Einstellungswandel hätte beseitigen können.
Zugelassene Medikamente mit Botulinumtoxin als Wirkstoff
[Bearbeiten | Quelltext bearbeiten]Das Botulinumtoxin wird als Medikament von verschiedenen Firmen hergestellt:
| Bezeichnung | Wirkstoff | Hersteller | Zugelassene Anwendungsgebiete |
|---|---|---|---|
| Xeomin (D, A, CH u. a.) | Toxin A | Merz | zervikale Dystonie mit überwiegend rotatorischer Komponente „Schiefhals“ (Torticollis spasmodicus), Lidkrampf (Blepharospasmus) und Spastik der oberen Extremitäten bei Erwachsenen, Chronischer, beeinträchtigender Sialorrhoe „vermehrter Speichelfluss“ bei Kindern von 2–17 Jahren und Erwachsenen |
| Bocouture (D, A, CH u. a.) | Toxin A | Merz | Vorübergehende Verbesserung des Aussehens von mittelstarken bis starken Falten der oberen Gesichtshälfte (Glabellafalten, Krähenfüße, horizontale Stirnfalten) bei Erwachsenen unter 65 Jahren bei erheblicher psychologischer Belastung |
| Botox (D, A, CH u. a.) | Toxin A | Allergan | Symptomatische Behandlung diverser Spastiken (fokale Spastizität von Hand- und Fußgelenk bei Erwachsenen, fokale Spastizität bei Patienten mit Zerebralparese ab 2 Jahren), Spasmen (Blepharospasmus, hemifazialer Spasmus) und Dystonien (zervikal, fokal); Linderung der Symptomatik bei chronischer Migräne) |
| Botox Cosmetics (USA) Vistabel (D, A, CH u. a.) |
Toxin A | Allergan | Vorübergehende Verbesserung des Aussehens von mittelstarken bis starken Falten der oberen Gesichtshälfte (Glabellafalten, Krähenfüße, horizontale Stirnfalten) bei Erwachsenen bei erheblicher psychologischer Belastung |
| Dysport (D) | Toxin A | Ipsen | Symptomatische Behandlung diverser Spastiken (obere Extremitäten und Fußgelenk bei Erwachsenen, untere Extremitäten bei gehfähigen Patienten mit Zerebralparese ab 2 Jahren), Spasmen (Blepharospasmus, hemifazialer Spasmus) und Dystonien (zervikal, fokal) |
| Azzalure (D) | Toxin A | Ipsen | Vorübergehende Verbesserung des Aussehens von mittelstarken bis starken Falten der oberen Gesichtshälfte (Glabellafalten, Krähenfüße) bei Erwachsenen unter 65 Jahren bei erheblicher psychologischer Belastung |
| Nuceiva (CA, EU) Jeuveau (USA) |
Toxin A | Evolus | Behandlung der Falten zwischen den Augenbrauen (Glabellafalten) bei psychologischer Belastung |
| Daxxify (USA) | Toxin A | Revance Therapeutics | Vorübergehende Verbesserung des Aussehens von mäßigen bis schweren Glabellafalten, die mit der Aktivität des Musculus corrugator und/oder Musculus procerus bei erwachsenen Patienten zusammenhängen |
| Letybo (D, A, USA) | Toxin A | Croma Pharma, Hugel | Behandlung von Glabellafalten |
| Myobloc (USA) | Toxin B | Elan | Behandlung von zervikaler Dystonie bei Erwachsenen zur Reduzierung des Schweregrads der abnormen Kopfposition und Nackenschmerzen |
| Neurobloc (EU) | Toxin B | Eisai | Behandlung von zervikaler Dystonie (Torticollis) bei Erwachsenen |
Seit April 2009 müssen alle in den USA verkauften Botulinumtoxinpräparate – nach Festlegung durch die FDA aufgrund von Berichten über Nebenwirkungen – einen Warnhinweis tragen. Für jedes zugelassene Produkt ist weiterhin eine Risk Evaluation and Mitigation Strategy (REMS) notwendig. Die betroffenen Präparate sind Xeomin, Bocouture, Botox und Botox Cosmetic, Myobloc und Dysport.[65]
Der Hersteller Eisai warnt vor Off-Label-Anwendung von „Neurobloc“ (Toxin B), da dies zu Schluckstörungen und Atembeschwerden führen könne, wenn sich das Nervengift auf benachbarte Strukturen ausbreite.[66]
Jede Charge von Produktionseinheiten eines Botulinumtoxin-Medikaments muss auf Grund der hohen Giftigkeit routinemäßig einer Prüfung unterzogen werden. Hierbei ist der klassische LD50-Test zugelassen, bei dem mindestens 100 Mäusen das Gift in das Abdomen injiziert wird. Nach 3 bis 4 Tagen wird der LD50-Wert über die Anzahl der getöteten Tiere ermittelt. Die Tiere erleiden Muskellähmungen, Sehstörungen und Atemnot, bevor sie ersticken. Weltweit werden jedes Jahr rund 600.000 Mäuse dazu verwendet.[67][68]
Im Europäischen Arzneibuch sind folgende alternative Testverfahren beschrieben:[69]
- Ein Nervus-phrenicus-Zwerchfell-Präparat, bei dem Nerven aus zuvor getöteten Mäusen oder Ratten herauspräpariert (ex vivo) und als Testobjekt verwendet werden.
- Der Endopeptidase-Test, ein molekularbiologisches in-vitro-Verfahren, bei dem das Gift ein synthetisches Protein SNAP-25 spaltet.
- Eine lokale Muskellähmung, bei der das Gift den Mäusen in die Hautfalte zwischen Bauch und Hinterbein gespritzt und das Ausmaß der Lähmungen des Hinterbeins beurteilt wird (Bestimmung der Wirksamkeit an der Maus mit paralytischem Endpunkt).
- Bestimmung in Zellkulturen
Weitere Verfahren sind:[6]
- Zellkulturtests mit einer Zelllinie aus Mäusekrebszellen (Neuroblastoma)
- Der immunchemische ELISA-Test mit Antikörpern aus Versuchstieren[44]
Das Tierversuchsverbot für Kosmetika greift nicht, da Botulinumtoxin-Produkte als Medikamente zugelassen sind sowie für die Anwendung injiziert und nicht bloß aufgetragen werden.[6]
Bei Tierversuchen mit Mäusen und Ratten wurde festgestellt, dass sich Botulinumtoxin im Zentralnervensystem verbreitet.[70][71]
Gewinnung und Lagerung
[Bearbeiten | Quelltext bearbeiten]Botulinumtoxin A wird aus Kulturen von Clostridium botulinum gewonnen. Bei einem pH-Wert von 3,5 wird das Protein aus dem Kulturmedium ausgefällt; durch eine Abfolge mehrerer Zentrifugations-, Fällungs- und Adsorptionsschritte wird das Toxin gereinigt. Die Gewinnung weiterer Botulinumtoxine erfolgt analog aus anderen Clostridium-Arten und -Stämmen. Das gereinigte Toxin kann bei −70 °C für längere Zeit gelagert und ohne Aktivitätsverlust aufgetaut werden. Eine aus dem festen Protein und steriler isotonischer Kochsalzlösung hergestellte Injektionslösung kann im Kühlschrank für maximal 24 Stunden aufbewahrt werden.[44] Danach müssen Lösungsreste sowie nicht verwendete Injektionslösungen entsorgt werden, da diese keine Konservierungsmittel enthalten.[72]
Einsatz als Kampfstoff
[Bearbeiten | Quelltext bearbeiten]Aufgrund der hohen Letalität bei verhältnismäßig einfacher Herstellung und Transport besteht die Gefahr, dass Botulinumtoxin als Biologische Waffe eingesetzt wird.[73][74] Es wird durch das CDC als Stoff eingestuft, von dem eine hohe Gefahr durch Verwendung bei Bioterrorismus ausgeht.[75] Botulinumtoxin könnte dabei in Lebensmitteln, als Aerosol oder über die Trinkwasserversorgung verbreitet werden.[76] Gelöst in Wasser ist das Toxin farblos, geruchlos und geschmacklos.[77]
Im Rahmen der UNSCOM-Inspektionen nach dem 2. Golfkrieg stieß man im Irak auf Programme zur Herstellung von biologischen Waffen, u. a. auch Botulinumtoxin.[78] In Deutschland unterliegt Botulinumtoxin dem Kriegswaffenkontrollgesetz.[79]
Nachweis
[Bearbeiten | Quelltext bearbeiten]Der Nachweis des Toxins wurde früher meist aufwendig über eine Kulturbestimmung des Bakteriums C. botulinum (Erregerisolierung aus Stuhl oder Wundmaterial) durchgeführt; eine schnellere Nachweismethode ist die RT-PCR.[80] Ein direkter Nachweis des Botulinumtoxins aus Blut, Stuhl, Mageninhalt oder Erbrochenem ist über Bioassay-Methoden (ELISA oder Maus-Bioassay) möglich, das heißt, es wird die Wirkung von Proben auf Labortiere wie Mäuse bestimmt.[81]
Dokumentarfilm
[Bearbeiten | Quelltext bearbeiten]- Antje Christ: Botox – ein Gift macht Karriere. D, 2010, 55 Minuten[82]
Literatur
[Bearbeiten | Quelltext bearbeiten]- S1-Leitlinie Ästhetische Botulinumtoxin-Therapie der Deutschen Dermatologischen Gesellschaft (DDG). In: AWMF online (Stand 2018)
- Dirk Dressler: Botulinum toxin therapy, 31 tables, Foreword by Mitchell F. Brin, Thieme Verlag, Stuttgart, New York 2000, Andere Ausgabe: Dt. Ausg. u.d.T.: Dressler, Dirk: Botulinum-Toxin-Therapie, ISBN 978-3-13-117691-2, ISBN 978-0-86577-816-0 (New York).
- Matthias auf dem Brinke et al.: Therapeutenhandbuch Botulinumtoxin und Spastik. Thieme, Stuttgart 2011, ISBN 978-3-13-166791-5.
- Boris Sommer, Dorothee Bergfeld, Gerhard Sattler: Botulinumtoxin in der ästhetischen Medizin. Thieme, Stuttgart 2015. 5. akt. Aufl., ISBN 978-3-13-137675-6.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Bewegungsstörungen - M. Parkinson / Botulinum-Toxin Therapie / Tiefe Hirnstimulation, Klinik für Neurologie mit Experimenteller Neurologie, Charité
- S. Krupa, G. Gopinathrao / reactome: Botulinum neurotoxicity.
- Arbeitskreis Botulinumtoxin: Therapeutische Anwendungen des Botulinumtoxins
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]Anmerkungen zur Tabelle Botulinumtoxin-Serotypen
- ↑ USAN: Onabotulinumtoxin A, CAS-Nr.: 1309378-01-5
- ↑ USAN: Abobotulinumtoxin A, CAS-Nr.: 953397-35-8
- ↑ USAN: Letibotulinumtoxin A, CAS-Nr.: 1800016-51-6, UNII: W5O50S8A59 ( vom 24. Februar 2020 im Internet Archive)
- ↑ USAN: Nivobotulinumtoxin A, CAS-Nr.: 1638949-86-6
- ↑ USAN: Prabotulinumtoxin A
- ↑ USAN: Incobotulinumtoxin A
- ↑ USAN: Daxibotulinumtoxin A
- ↑ USAN: Evabotulinumtoxin A
- ↑ USAN: Rimabotulinumtoxin B, CAS-Nr.: 93384-44-2, Eintrag zu Rimabotulinumtoxin B in der DrugBank der University of Alberta, abgerufen am 24. Februar 2020.
- ↑ CAS-Nr.: 107231-13-0
- ↑ CAS-Nr.: 107231-14-1
- ↑ Das Botulinumtoxin Typ C2 zählt nicht zu den Neurotoxinen. Vgl. Lance Simpson (Hrsg.): Botulinum Neurotoxin and Tetanus Toxin, Academic Press, 1989, S. 7. (eingeschränkte Vorschau in der Google-Buchsuche) da ein anderer Wirkmechanismus besteht. Botulinumtoxin C2 hemmt die Bildung von Actinfilamenten, wodurch das Zellskelett geschädigt wird und actinvermittelte Transportprozesse zum Erliegen kommen.
- ↑ Ab 1959 wurden alle Botulinum-Neurotoxin (Typ A-G) produzierenden Clostridien der Art C. botulinum zugerechnet. Phäno- und genotypischer Heterogenitäten innerhalb der Spezies führten 1988 zu Neuklassifizierung der Clostridium-botulinum-Typ-G-Stämme zu der neue Art C. argentinense. Vgl. J.C. Suen et al.: Clostridium argentinense sp.nov.: a genetically homogeneous group composed of all strains of Clostridium botulinum type G and some nontoxigenic strains previously identified as Clostridium subterminale or Clostridium hastiforme. Int. J. Sys. Bacteriol, Band 38 (1988), S. 375–381. doi:10.1099/00207713-38-4-375
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ E. J. Schantz, E. A. Johnson: Properties and use of botulinum toxin and other microbial neurotoxins in medicine. In: Microbiol Rev. 1992;56, S. 80–99.
- ↑ Kent R. Olson: Poisoning & drug overdose. 4. Auflage, McGraw-Hill Professional, 2004, ISBN 0-8385-8172-2, S. 136–138.
- ↑ Diane O. Fleming, Debra Long Hunt: Biological Safety: Principles and Practices. ASM Press, 2000, S. 267.
- ↑ H. Bigalke, H. Müller, F. Dreyer: Botulinum A neurotoxin unlike tetanus toxin acts via a neuraminidase sensitive structure. In: Toxicon : official journal of the International Society on Toxinology. Band 24, Nummer 11–12, 1986, S. 1065–1074, doi:10.1016/0041-0101(86)90133-9, PMID 3564058.
- ↑ Lydia Leipert: Faltenkiller Botox. In: Der Spiegel. 11. Oktober 2008, ISSN 2195-1349 (spiegel.de [abgerufen am 2. November 2023]).
- ↑ a b c d e Botox – Tierqual für eine fragwürdige Schönheit. In: Ärzte gegen Tierversuche.
- ↑ K. Botrill: Growing old disgracefully: The cosmetic use of botulinum toxin. In: ATLA. 31 2003, S. 381–391.
- ↑ M. Balls: Botulinum toxin testing in animals: the questions remain unanswered. In: Alternatives to laboratory animals: ATLA. Band 31, Nummer 6, Dezember 2003, S. 611–615, PMID 15560750 (Review).
- ↑ B. R. Levin: The evolution and maintenance of virulence in microparasites. In: Emerging infectious diseases. Band 2, Nummer 2, 1996 Apr-Jun, S. 93–102, doi:10.3201/eid0202.960203, PMID 8903208, PMC 2639826 (freier Volltext).
- ↑ a b c Boris Sommer, Gerhard Sattler: Botulinumtoxin in der ästhetischen Medizin. 3. Auflage, Georg Thieme Verlag, 2006, ISBN 3-13-137673-2, S. 1–2.
- ↑ Peter Moore, Markus Naumann: Handbook of botulinum toxin treatment. 2. Auflage, Wiley-Blackwell, 2003, ISBN 0-632-05957-5, S. 3.
- ↑ Aus der Natur: die neuesten Entdeckungen auf dem Gebiet der Naturwissenschaften. Band 31–34, 1868, S. 346.
- ↑ a b Peter Moore, Markus Naumann: Handbook of botulinum toxin treatment. 2. Auflage, Wiley-Blackwell, 2003, ISBN 0-632-05957-5, S. 4.
- ↑ Martina Kerscher: Dermatokosmetik. Steinkopff Verlag, 2. Auflage, 2009. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Mitchell F. Brin: History of Onabotulinumtoxin A. In: Botulinum Toxin. Procedures in Cosmetic Dermatology, 3 Auflage, 2013. S. 1–7.
- ↑ J. Carruthers, A. Carruthers: Treatment of Glabellar Frown Lines with C. Botulinum-A Exotoxin. In: J. Dermatol. Surge Oncol. 18:(1992), S. 17–21.
- ↑ J. E. Frampton, S. E. Easthope: Botulinum toxin A (Botox Cosmetic): a review of its use in the treatment of glabellar frown lines. In: American journal of clinical dermatology. Band 4, Nummer 10, 2003, S. 709–725, PMID 14507232 (Review).
- ↑ Frank J. Erbguth, Markus Naumann: Historical aspects of botulinum toxin: Justinus Kerner (1786–1862) and the "sausage poison". In: Neurology. Vol. 53, Issue 8, 1. November 1999, S. 1850.
- ↑ Giuseppe Merialdi, Mattia Ramini, Giovanni Parolari, Silvana Barbuti, Maria Angela Frustoli: Study on Potential Clostridium Botulinum Growth and Toxin Production in Parma Ham. In: Italian Journal of Food Safety. Band 5, Nr. 2, 19. April 2016, S. 5564, doi:10.4081/ijfs.2016.5564, PMID 27800441, PMC 5076734 (freier Volltext).
- ↑ a b Eintrag zu „Botulismus“ im Lexikon der Ernährung. Wissenschaft-Online-Lexika, abgerufen am 11. Dezember 2009.
- ↑ Ralf Stahlmann: Botulinumtoxine. In: Deutsche Apothekerzeitung, Nr. 34, S. 46, 2012.
- ↑ Flora Chen, Geoffrey M. Kuziemko, Raymond C. Stevens: Biophysical Characterization of the Stability of the 150-Kilodalton Botulinum Toxin, the Nontoxic Component, and the 900-Kilodalton Botulinum Toxin Complex Species. In: Infect Immun., 1998 Jun; 66(6), S. 2420–2425.
- ↑ a b c d e f g h i j G. Eisenbrand (Hrsg.), P. Schreier (Hrsg.): RÖMPP Lexikon Lebensmittelchemie. 2. Auflage, Thieme-Verlag, 2006, ISBN 3-13-736602-X, S. 148–149.
- ↑ a b c d Botulinustoxin. In: Lexikon der Biologie. Wissenschaft-Online-Lexika; abgerufen am 11. Dezember 2009.
- ↑ R. Stahlmann: Botulinumtoxine. Deutsche Apothekerzeitung, 34/2012 vom 23. August 2012.
- ↑ Jason R. Barash, Stephen S. Arnon: A Novel Strain of Clostridium botulinum That Produces Type B and Type H Botulinum Toxins. J Infect Dis. (2013), 7. Oktober 2013, doi:10.1093/infdis/jit449.
- ↑ Botox: Neues Toxin mit Publikationsverbot belegt. In: Deutsches Ärzteblatt, 14. Oktober 2013.
- ↑ Marieke Degen: Gift ohne Gegengift. DLF – Forschung aktuell, 6. November 2013.
- ↑ S.E. Maslanka et al.: A novel botulinum toxin, previously reported as serotype H, has a hybrid structure of known serotypes A and F that is neutralized with serotype A antitoxin. J Infect Dis Band 213 (2016) S. 379–85 (online Veröffentlichung im Juni 2015).
- ↑ UniProt P0DPK1
- ↑ UniProt A0A242DI27
- ↑ a b L. von Berg et al.: Functional detection of botulinum neurotoxin serotypes A to F by monoclonal neoepitope-specific antibodies and suspension array technology. Scientific Reports, Nr. 9 (2019), s. 5531 doi:10.1038/s41598-019-41722-z
- ↑ Amber Scarlatos, Bruce A. Welt, Brian Y. Cooper, Douglas Archer, Thomas DeMarse, Khe V. Chau: Methods for Detecting Botulinum Toxin with Applicability to Screening Foods Against Biological Terrorist Attacks. In: Journal of Food Science. Band 70, Nr. 8, 2005, S. 121–130, doi:10.1111/j.1365-2621.2005.tb11525.x.
- ↑ a b Eintrag zu „Botulismus“ im Lexikon der Neurologie. Wissenschaft-Online-Lexika, abgerufen am 11. Dezember 2009.
- ↑ J. Wang, J. Meng, M. Nugent, M. Tang, J. O. Dolly: Neuronal entry and high neurotoxicity of botulinum neurotoxin A require its N-terminal binding sub-domain. In: Scientific Reports. Band 7, 03 2017, S. 44474, doi:10.1038/srep44474, PMID 28295026, PMC 5353748 (freier Volltext).
- ↑ Anton de Paiva, Frédéric A. Meunier, Jordi Molgó, K. Roger Aoki, J. Oliver Dolly: Functional repair of motor endplates after botulinum neurotoxin type A poisoning: Biphasic switch of synaptic activity between nerve sprouts and their parent terminals. In: PNAS. 1999, Vol. 96, S. 3200–3205. PMID 10077661
- ↑ Epidemiologisches Bulletin, Nr. 3/2020. (PDF; 2,5 MB) Robert Koch-Institut, 16. Januar 2020
- ↑ Werner Köhler, Rainer Ansorg: Medizinische Mikrobiologie. 8. Auflage, Elsevier, Urban&Fischer, 2001, ISBN 3-437-41640-5, S. 402.
- ↑ Stellungnahme der „DVG-Fachgruppe Rinderkrankheiten“ zur Diskussion um das Thema „viszeraler Botulismus“ als Ursache von Bestandserkrankungen bei Rindern. (PDF) DVG (PDF; 55 kB)
- ↑ a b Fact sheets - Botulism. In: World Health Organization (WHO). 10. Januar 2018, abgerufen am 13. Mai 2020.
- ↑ Eintrag zu „botulinum cook“. ( vom 27. August 2009 im Internet Archive) In: businessdictionary.com, abgerufen am 11. Dezember 2009.
- ↑ Michael Abele, Andres Ceballos-Baumann: Bewegungsstörungen. 2. Auflage, Georg Thieme Verlag, 2005, ISBN 3-13-102392-9, S. 156–171.
- ↑ a b Peter Berlit: Klinische Neurologie. Springer, 1999, ISBN 3-540-65281-7, S. 902–903.
- ↑ a b c F. von Bruchhausen, S. Ebel, E. Hackenthal, U. Holzgrabe: Hagers Handbuch der pharmazeutischen Praxis. Band 4: Stoffe A–K. 5. Auflage, Springer, 1999, ISBN 3-540-62644-1, S. 164–165.
- ↑ Deutsche Gesellschaft für Neurologie: Migräne: Bakteriengift hilft chronisch Kranken. Deutsche Gesellschaft für Neurologie, Pressemitteilung vom 25. September 2009 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 15. September 2015.
- ↑ Hartmut Göbel: Die Kopfschmerzen: Ursachen, Mechanismen, Diagnostik und Therapie in der Praxis. 2. Auflage, Springer, 2003, ISBN 3-540-03080-8, S. 481–483.
- ↑ Boris Sommer, Gerhard Sattler: Botulinumtoxin in der ästhetischen Medizin. 3. Auflage, Georg Thieme Verlag, 2006, ISBN 3-13-137673-2, S. 68–73.
- ↑ Hamid Abdolvahab-Emminger: Exaplan, Band 2. 5. Auflage, Elsevier, Urban&Fischer, 2008, ISBN 978-3-437-42462-5, S. 2064.
- ↑ Gudrun Bartolome, Heidrun Schröter-Morasch: Schluckstörungen: Diagnostik und Rehabilitation. 3. Auflage, Elsevier, Urban&Fischer, 2006, ISBN 3-437-47160-0, S. 215–216.
- ↑ Franziska Kaestner, Justine Warzok, Christian Zechmann: Crashkurs innere Medizin: Repetitorium zum Gegenstandskatalog 3 mit Einarbeitung der wichtigsten Prüfungsfakten. Elsevier, Urban&Fischer, 2004, ISBN 3-437-43510-8, S. 166.
- ↑ a b c d S. Kahl, G. Kähler, A. Dormann: Interventionelle Endoskopie. Lehrbuch und Atlas. Elsevier, Urban&Fischer, 2006, ISBN 3-437-23620-2, S. 249.
- ↑ Neue Leistung ab 2018: Botoxbehandlung bei Blasenfunktionsstörung. Archiviert vom (nicht mehr online verfügbar) am 13. Februar 2020; abgerufen am 13. Februar 2020.
- ↑ Axel Schulz, Stephan Grüner, Marcela Lippert-Grüner: Botulinumtoxin – mögliche Indikationen in O & U. Deutscher Ärzte-Verlag, abgerufen am 13. Februar 2020.
- ↑ Einsatz von Botulinumtoxin bei chronischer Plantarfasziitis. Abgerufen am 13. Februar 2020.
- ↑ Home - Igost. Abgerufen am 13. Februar 2020.
- ↑ a b Boris Sommer, Gerhard Sattler: Botulinumtoxin in der ästhetischen Medizin. 3. Auflage, Georg Thieme Verlag, 2006, ISBN 3-13-137673-2, S. 15.
- ↑ a b E. Yiannakopoulou: Serious and long-term adverse events associated with the therapeutic and cosmetic use of botulinum toxin. In: Pharmacology. Band 95, Nummer 1–2, 2015, S. 65–69, doi:10.1159/000370245, PMID 25613637 (freier Volltext) (Review).
- ↑ E. P. Sorensen, C. Urman: Cosmetic complications: rare and serious events following botulinum toxin and soft tissue filler administration. In: Journal of drugs in dermatology: JDD. Band 14, Nummer 5, Mai 2015, S. 486–491, PMID 25942667 (Review).
- ↑ Andreas Hennenlotter, Christian Dresel, Florian Castrop, Andres O. Ceballos-Baumann, Afra M. Wohlschläger, Bernhard Haslinger: The Link between Facial Feedback and Neural Activity within Central Circuitries of Emotion—New Insights from Botulinum Toxin–Induced Denervation of Frown Muscles. Cereb. Cortex, Band 19, Heft 3, S. 537–542; doi:10.1093/cercor/bhn104.
- ↑ K. G. Raphael, A. Tadinada u. a.: Osteopenic consequences of botulinum toxin injections in the masticatory muscles: a pilot study. In: Journal of Oral Rehabilitation. 41, 2014, S. 555, doi:10.1111/joor.12180.
- ↑ Is Botox Safe and Effective for TMD? The TMJ Association, abgerufen am 13. Juni 2016.
- ↑ S3-Leitlinie Diagnostik und Behandlung von Bruxismus. (PDF) AWMF, abgerufen am 13. Februar 2020.
- ↑ Anna Stenger: Botulinum- und Hyaluronsäure-Injektionen – Wer darf was? (PDF, 735kb). face, 1(2017), S. 76–78.
- ↑ Beschluss vom 17. Mai 2017 – Az.: 13 A 168/16. Oberverwaltungsgericht Nordrhein-Westfalen
- ↑ FDA Requires Boxed Warning for All Botulinum Toxin Products. FDA News & Events, 30. April 2009.
- ↑ Mitteilung an die Angehörigen von Heilberufen zu Risiken bei der „Off-Label“ Anwendung von NeuroBloc (Botulinumtoxin Typ B). (PDF; 727 kB) In: akdae.de, 25. Februar 2013.
- ↑ S. Bitz: The Botulinum Neurotoxin LD50 Test. Problems and Solutions. ( vom 7. April 2014 im Internet Archive; PDF; 212 kB) In: Altex, 27, 2/2010, S. 114–116.
- ↑ Botox-Mäuse: Qualvoller Tod für weniger Falten. In: Kassensturz, Sendung vom 20. November 2007.
- ↑ Europäisches Arzneibuch. 8. Ausgabe. Grundwerk 2014, S. 2538 f., Monographie Botulinum-Toxin Typ A zur Injektion
- ↑ Study Finds Botulinum Toxin Spreads to CNS Tissue in Mice. In: journals.lww.com
- ↑ Gisela Telis: Have Botox, Will Travel. ( vom 13. September 2011 im Internet Archive) In: sciencemag.org, 2. April 2008.
- ↑ Botox entsorgen - Abfallmanager Medizin. 1. März 2023, abgerufen am 2. November 2023 (deutsch).
- ↑ RKI - Hintergrundinformation des Robert Koch Instituts zu bioterroristisch relevanten Agenzien - Botulismus. Abgerufen am 8. Oktober 2023.
- ↑ Botulinum Toxin (Botulism). Abgerufen am 7. März 2018 (englisch).
- ↑ Biological and Chemical Terrorism:Strategic Plan for Preparedness and Response. Abgerufen am 7. März 2018.
- ↑ Bernd D. Domres, Andreas Manger, Rainer Wenke, Stefan Brockmann, Mike Kay, Horst Miska: GEMAESS - CBRN-Gefahrenlagen. Hrsg.: Johanniter-Unfall-Hilfe e.V. 2010, S. 89 (web.archive.org [PDF; 1000 kB; abgerufen am 9. August 2021]).
- ↑ John Pike: Botulinum Toxins – Biological Weapons. Abgerufen am 7. März 2018 (englisch).
- ↑ H. Russmann: Toxine. In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. Band 46, Nr. 11, 1. November 2003, S. 989–996, doi:10.1007/s00103-003-0716-0.
- ↑ Kriegswaffenkontrollgesetz, Anlage (zu § 1 Abs. 1), II. Biologische Waffen, 3.1 c) Clostridium botulinum 3.1 d) Clostridium-botulinum-Toxine.
- ↑ U. Messelhäusser, R. Zucker, H. Ziegler, D. Elmer-Englhard, W. Kleih, C. Höller, U. Busch: Nachweis von Clostridium botulinum Typ A, B, E und F mittels real-time-PCR. (Abstract). In: Journal für Verbraucherschutz und Lebensmittelsicherheit, Mai 2007, Vol. 2, Iss. 2, S. 198–201; doi:10.1007/s00003-007-0174-y.
- ↑ Clostridium botulinum (Botulismus). ( vom 25. September 2016 im Internet Archive) Landeszentrum Gesundheit Nordrhein-Westfalen; abgerufen am 5. März 2013.
- ↑ Botox – Ein Gift macht Karriere. Dokumentation Deutschland 2010.