Pest
| Klassifikation nach ICD-10 | |
|---|---|
| A20 | Pest |
| ICD-10 online (WHO-Version 2019) | |

Korrelation mit festgestelltem Vorkommen der Pest bei Tieren
Die Pest (lateinisch pestis „Seuche,[1] Epidemie, Beulenpest,[2] Pestplage“; altgriechisch λοιμός loimós; englisch plague), veraltet auch Pestilenz genannt (mittelhochdeutsch pestilencie entlehnt von lateinisch pestilentia),[3] ist eine hochgradig ansteckende Infektionskrankheit, die insbesondere durch das Bakterium Yersinia pestis hervorgerufen wird. Diese Erkrankung kann in verschiedenen Formen auftreten, unter anderem als Beulenpest (Bubonenpest) und als Lungenpest.
Während im Lateinischen und im Altgriechischen die genannten Wörter für jede als Seuche auftretende ansteckende Krankheit verwendet wurden,[1][4] bezeichnet Pest im engen Sinn heute eine bestimmte Infektionskrankheit, deren Erreger erst 1894 entdeckt wurde und seit 1944 Yersinia pestis heißt. Ursprünglich ist diese Erkrankung eine Zoonose, also eine von Tieren auf Menschen und umgekehrt übertragbare Krankheit, und geht von Nagetieren wie Murmeltieren, Ratten, Eichhörnchen aus, in deren Populationen sie enzootisch sein kann. Der Übertragungsweg zum Menschen ist indirekt, klassischerweise über den Biss eines infizierten Flohs, der als Vektor dient; es ist aber auch eine direkte Mensch-zu-Mensch-Ansteckung über Tröpfcheninfektion möglich.
Eine Impfung gegen den Erreger mit dem derzeitigen Pestimpfstoff wird von der WHO nur für Risikogruppen empfohlen. Für die Behandlung einer Infektion stehen verschiedene Antibiotika zur Verfügung, doch es werden zunehmend Resistenzen beobachtet. In Deutschland, Österreich und der Schweiz ist die Pest eine meldepflichtige Erkrankung.
Die Pest führte als sogenannter Schwarzer Tod im 14. Jahrhundert zu einer der verheerendsten Pandemien[5] der Menschheitsgeschichte und bereits im 6. Jahrhundert als Justinianische Pest zu großen Epidemien im Mittelmeerraum. Ein historischer Überblick über die Krankheit und weitere, ebenfalls als Pest bezeichnete Seuchen, die viele Menschenleben forderten, ist unter Geschichte der Pest nachzulesen.
Erreger
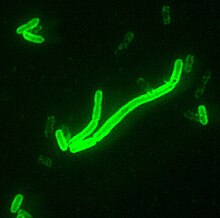
Die Pest wird bei Mensch und Tier durch das Bakterium Yersinia pestis (früher unterteilt in Yersinia pestis orientalis, Yersinia pestis antiqua und Yersinia pestis medievalis) ausgelöst. Dieses Bakterium, eine Mutation des für den Menschen relativ ungefährlichen Bakteriums Yersinia pseudotuberculosis, ist sehr anpassungsfähig, und es werden sehr viele verschiedene Varianten beschrieben. Die krankmachenden Eigenschaften von Yersinia pestis entstehen durch Ektotoxin-, Endotoxin- und Bakterienkapselbildung.
Übertragungsweg
Infektionskette
Die Pest kann auf verschiedene Weisen perkutan, intravenös oder inhalativ übertragen werden. Nicht nur durch den Biss von mit Krankheitserregern befallenen Tieren wie Ratten oder Flöhen, auch durch den Kontakt mit Körperflüssigkeiten lebender und toter infizierter Tiere ist eine Infektion möglich. Neben dem für die Beulenpest klassischen Weg von Ratten über Flöhe auf den Menschen ist auch die Tröpfcheninfektion von Mensch zu Mensch, die zur Lungenpest führt, von Bedeutung.[6]
Flöhe
Vektor bei der Übertragung von Ratten auf Menschen ist meistens der Floh. Als erster entdeckte diesen Zusammenhang 1898 Paul-Louis Simond.[7] An erster Stelle steht die tropische Flohart Xenopsylla cheopis (Rattenfloh). Über die Bedingungen und Mechanismen der Verbreitung der Pest durch diesen Floh siehe dort. Diese Flohart kommt in Europa wegen der für diese Art zu kühlen Witterungsbedingungen nicht vor. A. W. Bacot vermutete, dass der Menschenfloh (Pulex irritans), der in Europa verbreitet ist und sich durch eine große Variationsbreite in Bezug auf Wirtstiere auszeichnet, für die Übertragung verantwortlich sei.[8] Die Forscher Hariette Chick und C. J. Martin schlugen Nosopsyllus fasciatus (= Ceratopsyllus fasciatus) als Überträger vor. Diese Flohart macht die Hälfte der Flöhe in England aus.[9] Diese beiden Arten kommen mit tieferen Temperaturen weit besser zurecht als Xenopsylla cheopis. Hinzu kommt, dass dessen Eier bei 13 °C absterben, so dass Bacot meinte, dass mindestens 15,5 °C vorliegen müssten, um dessen Flohpopulation am Leben zu erhalten. Demgegenüber überlebte ein Teil der Eier von Pulex irritans noch bei 8 °C, und die Hälfte der Eier von Nosopsyllus fasciatus überstand sogar Temperaturen von 5 °C. Heute geht man von einem Temperaturfenster von 0 bis 40 °C für diesen Floh aus. Nosopsyllus fasciatus und Pulex irritans finden sich weit verbreitet in England, Wales, Schottland, den Shetlands, den Orkneys sowie in Irland.
Diese Floharten unterscheiden sich in ihrer Vektor-Effektivität. Damit bezeichnet man die Effektivität, mit der eine Flohart zur Krankheitsübertragung in der Lage ist. C. M. Wheeler und J. R. Douglas betrachteten die Vektoreffektivität als von drei Potentialen abhängig, deren jedes ein Maß für die jeweils nachgenannte Frage ist:
- Das Infektionspotential: Wie viele Individuen einer Flohpopulation saugen Blut mit Pestbakterien?
- Das infektiöse Potential: Wie viele dieser Flöhe können selbst eine Pest hervorrufen, weil ihr Verdauungstrakt blockiert ist?
- Das Übertragungspotential: Wie oft kann ein einzelner Floh die Infektion übertragen, bevor er selbst stirbt oder die Blockade aufgelöst wird?
Man führte dann den Vektor-Index ein, um die verschiedenen Floharten miteinander in diesem Punkte vergleichen zu können. Die Xenopsylla-Arten wurden zum Maßstab genommen.[10] Nosopsyllus fasciatus kommt diesen am nächsten. Dagegen zeigt Pulex irritans geringe Vektoreffektivität, ähnlich wie Katzen- und Hundeflöhe, weil bei ihnen die erforderliche Blockade durch Bakterienklumpen selten vorkommt. Bei Laborversuchen kam Nosopsyllus fasciatus auf den 2. Platz hinter Xenopsylla cheopis. Bei Pulex irritans kam es nur bei einem von 57 Exemplaren zur Blockade, und dieses Exemplar starb, bevor es seine Infektion weitergeben konnte. Georges Blanc und Marcel Baltazard gingen einen anderen Weg: In der Pest von 1940 in Marokko fingen sie Pulex irritans in Häusern Pestverstorbener in Marrakesch, zerdrückten sie und spritzten ihre Lösung in Meerschweinchen, die alsbald an Pest verstarben.[11] Damit lenkten sie den Blick auf die Möglichkeit, dass die Pest ohne Ratte vom Menschenfloh unmittelbar übertragen werden konnte, worauf sie in einer weiteren Veröffentlichung[12] hinwiesen. Die marokkanischen Häuser waren voll von Menschenflöhen. Von gut 3500 eingesammelten Flöhen waren 3000 Pulex irritans, während nur knapp 600 Exemplare Xenopsylla cheopis gefunden wurden.[13] Dagegen wandte Georges Girard ein, dass die Pestepidemien in Indien, Senegal und Madagaskar starke Unterschiede zu der marokkanischen aufwiesen, obgleich auch dort Pulex irritans in Mengen aufgetreten waren. Er bestritt im Übrigen aus seiner Erfahrung die Effektivität als Übertragungsvektor von Pulex irritans. Aber er hielt es für möglich, dass die Menge der Flöhe in Marokko den Mangel an Effektivität ausgeglichen habe.[14] Andere Untersuchungen von Pest in Nordafrika, besonders in Ägypten, zeigten, dass der Menschenfloh an der Verbreitung der Pest nicht beteiligt war, obgleich er in hohem Grad von der Pest infiziert war.[15] Atilio Macchiavello stellte andererseits das vollständige Fehlen von Xenopsylla cheopis bei einem Pestausbruch in Peru 1946 in 600–700 m Höhe fest.[16] Robert Pollitzer und Karl F. Meyer bestimmten dann die Pestübertragung durch Flöhe näher als massenhaften Befall von Flöhen, deren Saugwerkzeuge von vorherigem Befall von Nagern infiziert waren (mechanische Übertragung), oder als Bisse von im Verdauungssystem blockierten Flöhen (biologische Übertragung).[17] In Nordamerika ist der Hauptüberträger der Pest von Tier auf Mensch der Floh Oropsylla montana, obwohl bei diesem keine Blockade eintritt.[18]
Ein wesentlicher Faktor bei der Übertragung der Pest durch den Floh ist die Zahl der Bakterien, die er bei einem Biss injiziert. Ole Jørgen Benedictow ging von 25.000 Bakterien pro Biss eines blockierten Flohs aus.[19] Allerdings waren die Zahlen vor Einführung der PCR-Technik sehr ungenau. Mit dieser Methode hat man um die 100.000 Bakterien von Yersinia pestis in den infizierten Exemplaren gefunden.[20]
Auch wurde bei Untersuchungen von Flöhen in New Mexico und Colorado ein Zusammenhang zwischen Bakterienkonzentration und Mikromilieu der Flöhe festgestellt: Flöhe, die sich vom Wirtstier gelöst und in die Erde vergraben hatten, hatten höhere Konzentrationen als solche im Pelz des Wirtstieres. Die vom Boden aufgesammelten Flöhe waren nicht alle infiziert, aber die, die es waren, hatten eine ausreichende Konzentration für die Blockierung, während bei den Flöhen im Pelz eines Wirtstieres dies nur bei einem von 50 Flöhen der Fall war. Dafür war die Infektionsrate bei den Letzteren höher.[20]
Der Aufenthalt der Flöhe außerhalb von Wirtstieren in Nestern und im Boden ist jedoch keine besondere Verhaltensweise bestimmter Floharten, so dass die Unterscheidung zwischen Pelzfloh und Nestfloh nicht weiterführt. Pollitzer und Meyer stellten fest, dass es zwischen Nestflöhen und Pelzflöhen keine Trennungslinie gibt. Das unterschiedliche Verhalten in diesem Zusammenhang zwischen Xenopsylla cheopis und Nosopsyllus fasciatus beruht auf ihren Fressgewohnheiten: cheopis beißt oft und verlässt daher selten und nur kurz das Wirtstier, während fasciatus seltener beißt und daher längere Zeit auch ohne Wirtstier lebt. Nach Pollitzer und Meyer hängt dies aber nicht mit der Art, sondern mit dem Klima zusammen, in welchem die Flöhe leben: cheopis in tropischen Breiten, fasciatus in kühleren Gegenden. Von diesen Erkenntnissen ausgehend ist fasciatus nicht unbedingt ein schlechterer Pestvektor als cheopis.[17]
Warmblütige Wirtstiere
Es hat sich gezeigt, dass die Pest über 200 Säugetierarten befallen kann, also nicht auf Ratten beschränkt ist. Sie wurde auch bei Hunden und Katzen festgestellt.[15] Neben der braunen bis schwarzen Hausratte (Rattus rattus) und der grau-braunen Wanderratte (Rattus norvegicus) wurde auch der Hausmaus (Mus musculus) die Auslösung von Epidemien zugeschrieben, so die in Südost-Russland in den 20er Jahren, in Brasilien 1936–1945 und in Saigon 1943. Gleichwohl spielt die Hausmaus in diesem Zusammenhang nur eine untergeordnete Rolle, da sie nicht die hohe Bakterienkonzentration im Blut entwickelt, die erforderlich ist (Pollitzer 1954 S. 299–300). Außerdem ist deren Floh Leptopsylla segnis ein schlechter Überträger. Er nimmt nur wenig Pestbakterien auf. Auch ist der Floh in hohem Grade auf die Maus fixiert.[15] Die Ratten standen daher immer im Vordergrund. Das beruhte auf der Beobachtung bei der Pest 1905 in Bombay, dass es zu dieser Zeit dort eine Überfülle von Ratten beider Arten gab. Die Kommission beobachtete, dass die Seuche zuerst die Wanderratte ergriff, etwa 10 Tage danach die Hausratte, und der Höhepunkt der Sterblichkeitsrate bei den Menschen knapp 1 Monat später auftrat.[21] 1910 starben einige Kilometer entfernt von Ipswich einige Personen an einer bakteriologisch identifizierten Pest. Daraufhin machte man Jagd auf Ratten, und von den 568 gefangenen Exemplaren wiesen 17 Pestbakterien auf.[22] Alle in dieser ländlichen Gegend waren Wanderratten. Aber man geht davon aus, dass die Schwarze Ratte der wichtigste Vermittler der Pestepidemie von Indien 1898 bis Madagaskar 1998 gewesen ist. Der Floh bleibt nur bei lebenden Tieren. Sobald das befallene Lebewesen erkaltet, verlässt der Floh den Wirt. Da in Südamerika häufig Meerschweinchen gegessen werden, kommt es auch in neuerer Zeit immer wieder zu Ansteckungen.[23][24]
Krankheitsentstehung
Wenn bei der Infektion ausreichend viele Bakterien in die Blutbahn gelangt sind, sodass die körpereigene Abwehr ihrer nicht mehr Herr wird, kommt es nach kurzer Zeit zu einer hohen Bakterienkonzentration im Blut, die dann zu einer Sepsis führt.
Die blutvergiftende Wirkung wird ausgelöst, wenn die Bakterien ihren normalen Lebenszyklus vollenden und absterben. Dabei werden große Mengen toxischen Sekrets direkt in den Blutkreislauf abgegeben; Nieren und Leber können nekrotisch werden, wenn sie versuchen, den Organismus von Toxinen zu reinigen. Am Ende erliegt das Opfer einem toxischen Schock.
Klinische Erscheinungen
Je nach befallenem Organ unterscheidet man etliche Erscheinungsformen der Pest:
Bei einer Pandemie treten alle Formen der Pesterkrankung auf, am häufigsten sind die Beulenpest und die Lungenpest. Aus einer Beulenpest entwickelt sich ohne Behandlung oftmals eine Pestsepsis, die zudem zu einer sekundären Lungenpest führen kann. Selten tritt die Pestmeningitis auf, wenn nach hämatogener Streuung die Hirnhäute befallen werden. Ebenfalls selten ist die primäre Hautpest mit Roseolen, Karbunkeln und oft ausgedehnten Haut- und Schleimhautblutungen, die zur Bezeichnung der Pest als Schwarzer Tod geführt haben.[25] Ebenfalls als Hautpest bezeichnet man die typischen sekundär auftretenden Hautveränderungen infolge der Beulenpest.
Beulenpest


Bei der Beulenpest erfolgt die Ansteckung gewöhnlich durch den Biss eines Flohs, der den Erreger als Zwischenwirt in sich trägt. Durch den Wirtswechsel wird das Bakterium von einem infizierten Wirt auf einen nicht infizierten Wirt übertragen, wobei es sich im Zwischenwirt vermehrt. Neben der Übertragung von Ratte oder Mensch über Rattenfloh auf Mensch oder Ratte besteht auch ein Übertragungsweg über den Menschenfloh von Mensch zu Mensch.
Die Inkubationszeit liegt bei wenigen Stunden bis sieben Tagen. Die Symptome sind zunächst Kopf- und Gliederschmerzen, Fieber, starkes Krankheitsgefühl, später Benommenheit, schließlich Bewusstseinsstörungen. Im Ableitungsbereich des Flohbisses, typischerweise am Hals, in den Achselhöhlen und in den Leisten, schwellen die Lymphknoten stark an (axilläre und inguinale Bubonen oder Pestbeulen). Diese Entzündung der Lymphknoten ist sehr schmerzhaft, die Schwellung kann einen Durchmesser von bis zu zehn Zentimetern erreichen und aufgrund innerer Blutungen blau-schwarz gefärbt sein. Die Geschwülste zerfallen nekrotisch, nachdem sie eitrig eingeschmolzen sind.
Pestsepsis
Die primäre Pestsepsis entsteht durch Eintritt der Bakterien in die Blutbahn. Dies geschieht in der Regel als Komplikation aus anderen schweren Verlaufsformen der Pestinfektion, zum Beispiel durch Platzen der Pestbeulen nach innen. Die Erreger werden mit dem Blutstrom im gesamten Körper verteilt. Die Sepsis bewirkt hohes Fieber, Schüttelfrost, Kopfschmerzen, Schwindel, später Schock und großflächige Haut- und Organblutungen mit Multiorganversagen. Die Lebenserwartung bei einer unbehandelten Pestsepsis liegt bei höchstens 36 Stunden, eine rechtzeitige Behandlung mit Antibiotika kann die Sterblichkeitsrate aber deutlich senken.
Lungenpest

Die durch Tröpfcheninfektion übertragene primäre Lungenpest ist die einzige Pestform mit direktem Ansteckungsweg ohne Zwischenwirt. Nur unter besonders begünstigenden Umständen kann eine Lungenpest zur Epidemie werden und nur ein kleiner Teil der pestinfizierten Bevölkerung bekommt Lungenpest.[26] Die Ansteckung erfolgt entweder von Mensch zu Mensch, häufiger aber durch Schoßtiere. Die meisten amerikanischen Lungenpestpatienten des 21. Jahrhunderts hatten sich bei ihrer infizierten Katze angesteckt. Die Inkubationszeit wird mit 1 bis 3 Tagen angegeben. Die Lungenpest verläuft fulminanter als die Beulenpest, weil die Lymphknoten bei direkter Infektion der Lunge umgangen werden. Die Symptome der Erkrankung sind Atemnot, Husten, Blaufärbung der Lippen und schwarz-blutiger Auswurf, der extrem schmerzhaft abgehustet wird. Daraus entwickelt sich rasch ein Lungenödem mit Kreislaufversagen, welches nach zwei bis fünf Tagen zum Tod führt.
Voraussetzung für eine Lungenpestinfektion ist eine physische Nähe zu einem Lebewesen mit Lungenpest. Der kritische Abstand für eine Ansteckung liegt bei 30 cm und darunter, da Pestbakterien in der Luft rasch absterben. Die Ausbreitung wird durch den schnellen Krankheitsverlauf vermindert, da die Infizierten versterben, bevor sie die Lungenpest auf viele Menschen übertragen. Die Sterblichkeitsrate liegt bei 95 %, der ansteckungsgefährliche Bluthusten tritt erst im fortgeschrittenen Stadium der Krankheit auf.
Gleichwohl sind im 20. Jahrhundert Lungenpestepidemien dokumentiert, die von pestinfizierten Reisenden ausgelöst wurden.[27] Die beiden größten Lungenpestepidemien traten Anfang des 20. Jahrhunderts in der chinesischen Grenzregion Mandschurei auf.[28] Das Auftreten war vor allem an ein kaltes Klima geknüpft.[29] Die Epidemie in der Mandschurei 1910–1911 fand im Winter (September bis April) statt und war an die Hauptverkehrswege geknüpft. Die Lungenpest wurde über 2.700 km innerhalb von 7 Monaten transportiert, es starben mindestens 60.000 Menschen.
Wu Lien-Teh beobachtete, dass die Lungenpest in der Mandschurei an die Jagd auf die Tabarganer oder auch Sibirischen Murmeltiere (Marmota sibirica) gekoppelt und auf den wertvollen Pelz zurückzuführen war. Der Preis für die Felle war vor 1910 um das Vierfache gestiegen.[30] Heutige Erfahrungen haben gezeigt, dass die Lungenpest regelmäßig mit der Erkrankung von Nagetierpopulationen auftritt. Der Zusammenhang zwischen der Lungenpest und einer vorangegangenen Nagererkrankung mit epidemischer Beulenpest ist gut dokumentiert.
Wenn die Erreger bei einer Beulenpest erst im Verlaufe einer Pestsepsis in die Lunge geraten, spricht man von sekundärer Lungenpest.
Abortive Pest
Die abortive Pest ist die harmlose Variante der Pest. Sie äußert sich meist nur in leichtem Fieber und leichter Schwellung der Lymphknoten. Nach überstandener Infektion werden Antikörper gebildet, die eine langanhaltende Immunität gegen alle Formen der Krankheit gewährleisten.[31]
Untersuchungsmethoden
Die Diagnose erfolgt über den Nachweis der Erreger im Blut, im Sekret der Beulen oder bei der Lungenpest im Auswurf. Das französisch-madagassische Forschungsteam um Suzanne Chanteau vom Institut Pasteur de Madagascar (IPM) hat sowohl für die Lungen- als auch die Beulenpest 2003 einen Schnelltest entwickelt, mit dem sich Antikörper schon innerhalb von 15 Minuten nachweisen lassen.[32] Davor ließen beide Erkrankungen sich erst nach einer 14-tägigen Auswertungsdauer nachweisen.
Bei den immerhin noch jährlich 4000 weltweit auftretenden Pestfällen ist eine rasche Diagnose innerhalb von 24 Stunden entscheidender Bestandteil einer erfolgreichen Behandlung. In 20 Ländern, vor allem in Afrika, tritt die Pest nach wie vor auf.
Die zunächst vieldeutigen und oft nur schwachen Symptome erforderten bislang in der Regel bakteriologische Untersuchungen, manchmal sogar über die DNA für eine eindeutige Zuordnung. Dabei sind Verwechslungen mit Blinddarmentzündung, Hirnhautentzündung und Streptokokkeninfektionen in den USA dokumentiert.[33]
Der mikrobielle Nachweis wird aus Sputum, Blut oder Bubonenaspirat (Eiter) erhoben.
Differenzialdiagnose
Im Frühstadium muss, wenn kein Labor zur Verfügung steht, differenzialdiagnostisch an eine „Tularämie [(‚Hasenpest‘)], Lymphknotentuberkulose, Yersiniose, Brucellose, Toxoplasmose, Katzenkratzkrankheit, Listeriose, HIV-Infektion und Lymphogranulomatose“[34] gedacht werden. „Wegen des hohen Fiebers kommen auch Typhus, Denguefieber, Malaria und Sepsis in Betracht. Eine Lungenpest ist gegen andere Pneumonien abzugrenzen.“[34] „Eine pustulöse Pest [aufgrund einer Septikämie] erfordert den Ausschluss von Variola bzw. Varizellen.“[34]
Epidemiologie
Die Verbreitung der Pest hängt von der Verbreitung der Zwischenwirte ab. Wo sie festgestellt werden, sind immer auch Pestfälle möglich. Ob diese zu Epidemien auswachsen können, hängt von mehreren Faktoren ab, wie beispielsweise Resistenz der Bakterien gegen Medikamente, den vorherrschenden hygienischen Verhältnissen und der Bekämpfung der lokalen Zwischenwirte.
Die Pestausbreitung in den Epidemien von 1910 und 1921 ist auch auf die Entwicklung der Transportmittel zurückzuführen. 1921 traten die Pestfälle vor allem an den Eisenbahnstationen von Harbin bis Wladiwostok auf. Harbin war der Knotenpunkt zwischen der Transsibirischen und der Ostchinesischen Eisenbahn und besonders betroffen. Aber auch die Reise zu Pferd verbreitete die Pest über weite Strecken, wie die Pestausbrüche in den Jahren 1878–1925 in Astrachan und dem südlichen Ural beweisen, wo es keine Eisenbahnverbindungen gab. Es starben über 5000 Menschen, davon 70 % an Lungenpest.[30] Schuld am Ausbruch waren dort die unhygienischen Wohnverhältnisse: dunkel, schmutzig und überbelegt. 10–15 Menschen wohnten auf ca. 10 m². Die Menschen wuschen sich selten oder nie und wechselten auch die Kleider nicht. Die Pestkranken wurden von vielen Menschen besucht, und die Gäste wischten den Auswurf mit Händen oder Kleidern ab. Dies galt auch für die Pestepidemie von 1910, wo sich als erste die Tarbagan-Jäger bei der Jagd nach Murmeltieren zur Gewinnung der Murmelfelle an den verseuchten Tieren ansteckten. Sie schliefen in besonders kleinen Hütten, bis zu 40 Mann in Kojen, was die Weiterverbreitung begünstigte.[30] Ein weiteres Indiz waren die Verhältnisse an den Bitumen-Gruben am See Dalai Nur. Während der Pestepidemie von 1921 arbeiteten dort 4.000 Chinesen und 2.000 Russen. Von den insgesamt 1.027 Toten waren nur 4 Russen. Die Chinesen lebten zusammengepfercht in kleinen Hütten, halb in die Erde eingegraben, die Russen lebten in oberirdischen Häusern. Die Übertragung der Lungenpest per Tröpfcheninfektion kam also am Anfang des 20. Jahrhunderts durchaus vor.[30]
Verlauf einer Epidemie
Der endemische Verlauf der Pest folgt einem für diese Seuche typischen Muster, das so bei keiner anderen Seuche festzustellen ist: Der Tod setzt bei Ratten nach Befall einer Kolonie mit der Zeit immer schneller ein. Während anfangs mit ca. 7 Flöhen pro Ratte diese einen normalen Krankheitsverlauf zeigen, wird der Befall mit der Dezimierung der Kolonie bei den verbleibenden Ratten immer stärker, so dass 50 bis 100 Flöhe pro Ratte vorkommen, was zu einer wesentlich höheren Verseuchung führt. Nach 10 bis 14 Tagen ist die Rattenkolonie so stark reduziert, dass die Flöhe kaum noch Wirte finden. Diese Dauer von 10 bis 14 Tagen ist die erste wichtige Phase der Verbreitung. Danach nehmen die Flöhe ungefähr 3 Tage lang kein Blut auf, bis ihr Drang so groß ist, dass sie, da sie keine Ratten finden, nunmehr den Menschen anfallen. Es folgt die Inkubationsperiode von 3 bis 5 Tagen. Ihr folgt die Krankheitsperiode von 3 bis 5 Tagen, die bei der Mehrzahl der Befallenen zum Tode führt. Von der Ansteckung bis zum Tode vergehen durchschnittlich 8 Tage. Von der Erstinfizierung einer Rattenkolonie bis zum ersten Todesfall vergehen also 20 bis 28 Tage, gewöhnlich sind es 24 Tage.
Der Kontakt zwischen verseuchten und frischen Rattenkolonien führt zu einer langsamen Ausbreitung. Wichtiger ist der Ausbreitungsprozess über die Besuchspersonen. Sie nehmen die verseuchten Flöhe nach Hause mit und stecken so die eigene Rattenkolonie an. Das bedeutet, dass diese Form der Ausbreitung sich erst auswirkt, wenn die Pest bei einem Menschen sichtbar ausgebrochen ist, so dass im Spätmittelalter diese Form der Ausbreitung mit Krankenwache, Totenwache, Begräbnisfeier und Erbteilung einsetzte. Dieser Zeitpunkt ist etwa 3 bis 4 Wochen nach dem Einschleppen der Pest an einen Ort erreicht. Eine Woche später hat sich die Pest auf die Heimathöfe der Besucher verteilt, und die epidemische Phase beginnt. Bis dahin sind also ungefähr 40 Tage oder 5½ Wochen vergangen.
Ein weiteres typisches Kennzeichen der Pestepidemie ist der Zusammenbruch im Winter. Es ist keine Epidemie der Beulenpest in einem Winter bekannt. Das hängt damit zusammen, dass bei Kälte die septische Bakteriendichte in den Ratten geringer ist, so dass die Flöhe weniger Bakterien aufnehmen, und damit, dass sich die Flöhe bei Kälte nicht vermehren. Das Ende von Pestepidemien, die durch Flöhe verbreitet werden, fällt regelmäßig auf die Wintermonate.[35] Wurde die Pest erst im Spätherbst eingeschleppt, brach sie erst im nächsten Frühjahr aus.
Wilde Nagetierpopulationen als Rückzugsgebiet des Pestbakteriums
Die Pestbakterien kommen auch heute noch in wild lebenden Nagetierpopulationen vor – wie beispielsweise bei den Präriehunden, Erdhörnchen und Murmeltieren. Diese Populationen sind die natürlichen Reservoire des Pestbakteriums, von denen aus gelegentlich häusliche Nager wie beispielsweise Ratten infiziert werden.
Während in Europa und Australien keine infizierten Tierpopulationen bekannt sind, kommen solche im Kaukasus, in Russland, in Südostasien, der Volksrepublik China, der Mongolei, Süd- und Ostafrika, Mittel- und Südamerika sowie im Südwesten der USA vor.
Nach Nordamerika gelangte der Erreger dabei über ein Handelsschiff während einer Pestepidemie, die ab 1894 in Südostasien grassierte. Obwohl nur sehr wenige Menschen in Nordamerika an der Pest erkrankten, infizierte der Erreger die amerikanische Eichhörnchenpopulation. Gelegentlich kommt es daher auch heute noch in Nordamerika zu Übertragungen von Tier zu Mensch. Meist sind es Jäger, die sich bei einem Nagetier anstecken. Norman F. Cantor verweist jedoch auch auf einen nordamerikanischen Fall aus den 1980er Jahren, bei dem eine Frau ein Grauhörnchen mit einem Rasenmäher überfuhr und sich dabei mit der Pest infizierte.
Weltweit registriert die Weltgesundheitsorganisation (WHO) etwa eintausend bis dreitausend Pestfälle pro Jahr, meistens in Form kleinerer, örtlich begrenzter Epidemien. In Europa gab es den letzten dokumentierten Pestausbruch im Zweiten Weltkrieg. Man nimmt an, dass die Pest in Europa nicht mehr existiert.
Behandlung
Behandelt wird die Pest heutzutage mit Antibiotika über 10 Tage. Bei frühzeitiger Diagnose bestehen gute Chancen auf Heilung. Eingesetzte Wirkstoffe sind beispielsweise Streptomycin oder Gentamicin und Chloramphenicol sowie Kombinationen aus Tetracyclinen und Sulfonamiden. Chloramphenicol ist zwar hochwirksam, gilt aber wegen seiner Nebenwirkungen nur als Reservemedikament. Prophylaktisch und über sieben Tage verabreicht kommen gegebenenfalls die auch zur Behandlung eingesetzten Antibiotika Doxycyclin und Ciprofloxacin in Betracht.[36] Die Letalität steigt exponentiell zum Fortschreiten der Erkrankung.
Vorbeugung und Meldepflicht
Es stehen Schutzimpfungen zur Verfügung, die aber eine Immunität lediglich für drei bis sechs Monate gewähren, und dies auch nur bei der Beulenpest, nicht aber bei der Lungenpest. Die Autoren Eberhard-Metzger und Ries weisen jedoch auf die schlechte Verträglichkeit dieser Schutzimpfungen hin. Die Weltgesundheitsorganisation empfiehlt die Impfung daher nur Risikogruppen, zu denen beispielsweise Bauern, Landarbeiter und Jäger in Regionen zählen, in denen infizierte Nagetierpopulationen verbreitet sind.
Weitere Maßnahmen, um eine Pestepidemie einzudämmen, sind verbesserte Hygiene, Bekämpfung der Ratten und die Verhinderung des Transports von Ratten auf Schiffen. Da nach dem Tod der Ratten die Flöhe ihren Wirt wechseln, müssen die Menschen mit Insektiziden vor den Flöhen geschützt werden.
Länderübergreifende Quarantäneregelungen für Schiff-, Luft-, Zug- oder Kraftfahrzeugverkehr sind in den Internationalen Gesundheitsvorschriften von 1971 festgehalten.
In Deutschland gehört die Lungenpest neben den von Mensch zu Mensch übertragbaren hämorrhagischen Fiebern (Ebola, Lassa und anderen) zu den zwei Absonderungs-Krankheiten nach § 30 Infektionsschutzgesetz (IfSG). Derart erkrankte Patienten oder dessen Verdächtige müssen in speziellen Infektionsabteilungen in einem Krankenhaus oder einer für diese Krankheiten geeigneten Einrichtung abgesondert werden. Ein Verdacht auf, die Erkrankung an oder der Tod durch Pest müssen namentlich gemeldet werden (§ 6 IfSG). Meldepflichtig sind die feststellenden Ärzte usw. (§ 8 IfSG).
In Österreich ist die Pest eine anzeigepflichtige Krankheit gemäß § 1 Abs. 1 Nr. 1 Epidemiegesetz 1950. Anzeigepflichtig sind Verdachts-, Erkrankungs- und Todesfälle. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz 1950).
In der Schweiz ist Pest ebenfalls eine meldepflichtige Krankheit und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Es bestehen die Pflichten zur Meldung eines klinischen Verdachts, zur Rücksprache mit Fachärztin oder Facharzt für Infektiologie und zur Veranlassung einer erregerspezifischen Labordiagnostik.
Geschichte
Erstes Auftreten

Neue DNA-Analysen von Überresten jungsteinzeitlicher Bauern aus Schweden deuten darauf hin, dass die Pest bereits am Bevölkerungsrückgang vor rund 5000 Jahren mitverantwortlich gewesen sein könnte. Analysen ergaben, dass 18 der 108 untersuchten Skelette aus dieser Zeit den Pesterreger aufwiesen.[37] Genetische Untersuchungen eines 3800 Jahre alten Grabes in der russischen Region Samara im Jahr 2018 konnten zwei Yersinia-pestis-Genome rekonstruieren, die gleichzeitig zirkulierten. Eines davon weist die Gene auf, die für die Beulenpest als charakteristisch gelten, und ist Vorfahre der heutigen Stämme. Das Alter dieser Abstammungslinie wurde auf 4000 Jahre berechnet.[38] Bei einer 2020 am Max-Planck-Institut für evolutionäre Anthropologie in Leipzig durchgeführte Analyse der Zähne der sterblichen Überreste eines Mannes, die in Großstorkwitz (Sachsen) durch das Landesamt für Archäologie Sachsen ausgegraben worden waren, konnten Spuren der DNA von Yersinia pestis im Inneren des ersten unteren rechten Backenzahns nachgewiesen werden. Das Alter des Mannes betrug etwa 35 bis 45 Jahre als er zwischen 2848 und 2572 v. Chr. starb; ob er auch tatsächlich an der Pest gestorben ist, konnte nicht festgestellt werden. Des Weiteren konnte Yersinia pestis bei einem Leichenfund in Vliněves (Tschechien) nachgewiesen werden. Auch hier handelt es sich um einen 40 bis 60 Jahre alten Mann, der zwischen 2885 und 2663 v. Chr. bestattet wurde. Beide Fälle reihen sich sowohl zeitlich, geografisch als auch phylogenetisch in eine Anzahl weiterer ähnlich alter Pestfälle ein, die aus Südosteuropa aus der nordkaukasischen Steppe, aus Südsibirien und vom Baikalsee bekannt sind. Zwar liegen auch aus Mitteleuropa weitere Nachweise für das Auftreten des Pesterregers im 3. Jt. v. Chr. vor, doch handelte es sich dabei nur Einzelfälle, so dass es nicht abzuschätzen ist, wie schwerwiegend das Auftreten der Pest für frühe Gemeinschaften war. Da aus Skandinavien und dem Baltikum noch ältere Nachweise der Pest vom Ende des 4. Jt. v. Chr. vorliegen, ist es wenig wahrscheinlich, dass die im 3. Jt. v. Chr. aus den eurasischen Steppenzonen eingewanderten Personen die Pest mit nach Mitteleuropa brachten.[39]
Sehr lange war umstritten, ob bereits die spätantike Justinianische Pest, die ab 541 n. Chr. Europa und Vorderasien schwer traf und um 770 n. Chr. wieder verschwand, durch einen Erreger vom Stamm Yersinia pestis verursacht wurde. Schließlich zeigte Anfang 2013 eine an verschiedenen Laboratorien parallel durchgeführte internationale Studie unter der Leitung von Michaela Harbeck und Holger C. Scholz anhand von DNA-Material aus Gräbern aus Aschheim, die eindeutig in das spätere 6. Jahrhundert datiert werden können, dass für diese erste historisch belegbare Pestpandemie im engeren Sinne tatsächlich ein heute ausgestorbener Strang des Erregers Yersinia pestis verantwortlich war.[40]
Zudem gelang eine phylogenetische Einordnung des betreffenden Erregers zwischen den frühen Stammbaum-Abzweigungen N03 und N05. Mithin kann es nach aktuellem Forschungsstand als nahezu gesichert gelten, dass ein Erreger vom Stamm Yersinia pestis an der Justinianischen Pest zumindest prominent beteiligt war und es sich bei der Seuche somit tatsächlich um die Pest gehandelt hat. Als erster Ausbruch der Krankheit hatte bis 2013 vielen Forschern der Schwarze Tod von 1347 bis 1351 gegolten.[41] Wieso die Pest um 770 n. Chr. für mehrere Jahrhunderte wieder aus Europa verschwunden zu sein scheint, ist bislang ungeklärt.
Forschungsgeschichte ab dem 19. Jahrhundert
Mit der Pestpandemie von 1890 in Indochina begann die moderne Beschreibung der Krankheit. Alexandre Yersin, der zur gleichen Zeit wie der Japaner Kitasato (Erforscher der Pest in Hongkong) forschte, hatte den später nach ihm benannten, bis 1944 Pasteurella pestis genannten Bazillus Yersinia pestis am 20. Juni 1894[42] entdeckt, isoliert und der Pest zugeordnet.[43] Gleichzeitig wurde in Indien von dem Franzosen Paul-Louis Simond die Übertragung von der Schwarzen Ratte (Rattus rattus) über den orientalischen Rattenfloh auf den Menschen entdeckt.[44]
Das führte zu einer Beschreibung der Pest als eine einheitliche Krankheit. Die Entdeckung der Ausbreitung der Pest in Indien hatte eine beherrschende Bedeutung in der Anschauung der Pest in ihrer heutigen Bedeutung als moderne Krankheit. Sie führte zunächst zu der Auffassung, dass es nur diese eine Art der Ausbreitung der Krankheit gebe. Inzwischen haben sich die Forschungen auf eine große Zahl von Nagern und eine große Zahl von Floharten ausgeweitet. Die hohe Sterblichkeit in den Kolonien führte zu erhöhten Forschungsanstrengungen mit einer Kartografie der epidemischen Züge. Dass es sich immer um die Pest handele, war nicht hinterfragter Ausgangspunkt. So wurde die Krankheit mit dem historischen Begriff Pest belegt und auch die Bakterien danach benannt. Die Identität der mittelalterlichen Pest mit der in Indien erforschten Seuche wurde vorausgesetzt. Bei der Erforschung der Pest und ihrer Ausbreitung waren die Vorgaben der englischen Pestforschungskommission maßgeblich, die 1905 nach Indien entsandt worden war.
Viele Forschergruppen reisten nach Indien, darunter auch eine deutsche mit Wissenschaftlern aus der Umgebung Robert Kochs. Diese stellten 1897 fest: „Aus vielen Orten ist berichtet, dass dem Ausbruch der Pest eine seuchenartige Krankheit und massenhaftes Sterben der Ratten voranging.“[45] Eine vom indischen Vizekönig eingesetzte englische Kommission verkündete 1910 definitiv, dass die Pestepidemie in Indien direkt von der Pest in der Rattenpopulation abhängig sei.[46] Für andere Tiere als Wirtstier wurden keine Belege gefunden. Dabei unterschied die Kommission zwischen Beulenpest und anderen klinischen Formen. Alle Beobachtungen deuteten darauf hin, dass die Pestepidemien ausschließlich in Form der Beulenpest auftraten.
Die Ansteckung der Ratten untereinander geschah nachweislich durch die Flöhe. (Zum Nachweis wurden gesunde und kranke Ratten getrennt gehalten, wobei die Trennung für die Flöhe durchlässig war). Hinsichtlich der Pest bei den Menschen zog die Kommission eine Reihe von Schlüssen: 1. Die Pest wird nicht von Mensch zu Mensch übertragen, denn die Pfleger in den Krankenhäusern steckten sich nicht an. 2. Die Epidemie war nach ihrer Meinung fest mit der Epidemie unter den Ratten verknüpft. 3. Die in Indien vorherrschende Flohart Pulex cheopis, heute Xenopsylla cheopis, hatte sich erwiesen als eine, die auch Menschen anfällt, insbesondere, wenn ihre natürlichen Wirtstiere fehlten. Wiederholte Versuche mit Meerschweinchen und Affen in pestverseuchten Häusern zeigten, dass sie erkrankten, wenn sie nicht gegen Flöhe geschützt wurden. Weder pestverseuchter Boden noch die Kleider oder das Bettzeug von Pestkranken waren im Stande, ohne Flöhe mit Pest anzustecken.[47] Da die Kommission experimentell feststellte, dass die Pestbakterien nur wenige Tage außerhalb eines Wirtstiers überleben konnten, kam sie zu dem Schluss, dass die Pest in den Landstädten von außerhalb hereingetragen worden sein musste. Da in den Großstädten die Pest auch außerhalb der pestgefährlichen Monate auftrat, meinte sie, dass die Pest dort in kleinen Rattenpopulationen oder einzelnen Menschen als Reservoir zwischen den Pestsaisonen erhalten blieb. Bei einem Untersuchungsgebiet in der Größe Indiens stellte sich die Frage nach den Ausbreitungswegen. Da die Ratten kaum große Distanzen zurücklegen konnten, meinte die Kommission, dass die Verbreitung in bislang pestfreie Zonen über den Warenverkehr stattgefunden haben müsse.[48] Diese Untersuchungen und Schlussfolgerungen bezogen sich ausschließlich auf die in Indien damals aufgetretene Beulenpest.
Genomentschlüsselung

2011 wurde das Genom des Yersinia-pestis-Stammes beschrieben, der von 1348 bis 1350 während der Zeit des „Schwarzen Todes“ Menschen in England infiziert hatte.[49]
Mit den Ergebnissen kann die Evolution von Krankheitserregern besser nachvollzogen werden. Laut Studie veränderten sich die Pesterreger seit der Epidemie zwischen 1348 und 1353 kaum. Vermutungen, der Erreger sei in Ostasien im 13. oder 14. Jahrhundert entstanden, was bedeutete, dass frühere Pestepidemien wie die Justinianische Pest, die im 6. Jahrhundert weltweit zum Tod von mehr als 100 Millionen Menschen führte, von einem anderen, bisher nicht identifizierten Erreger verursacht worden wären,[41] stellten sich Anfang 2013 als falsch heraus: Auch die Infektionen aus dem 6. Jahrhundert sind auf den Erreger Yersinia pestis zurückzuführen.[40] Das Erbmaterial der jahrhundertealten Pesterreger gewannen die Forscher aus den Skeletten von Pestopfern, die im Mittelalter auf dem East-Smithfield-Friedhof in London begraben worden waren. Dieser Friedhof gilt als der am besten dokumentierte Pestfriedhof in ganz Europa; er wurde nur drei Jahre lang – von 1348 bis 1350 – benutzt.
2022 wurden die Untersuchungen zu den Yersinia-pestis-Genomen von Friedhöfen in der Nähe des Yssykköl-Sees im heutigen Kirgisistan veröffentlicht. Grabinschriften geben „Pest“ als Todesursache an und werden auf die Jahre 1338–1339 datiert. Die Synthese der Daten zeigt eine eindeutige Beteiligung des Pestbakteriums Yersinia pestis und wird als jüngster gemeinsamer Vorfahre der späteren großen Genom-Diversifizierung identifiziert, d. h. die Lokalisierung des Ausbruchs der zweiten bekannten Pestpandemie wird auf Zentralasien und auf die Zeit dieser Gräber eingegrenzt.[50]
Die Pest heute
Die Pest gehört heute zu den „vergessenen“ Krankheiten, die gut behandelbar sind, aber bei zu später Entdeckung noch immer tödlich verlaufen. Neben den traditionellen Wirts- und Zwischenwirtsträgern wie Flöhen und Ratten, die sich u. a. mit Hygienemaßnahmen gut bekämpfen lassen, sind die Ausbrüche heute oft an Murmeltiere, Präriehunde, Erdhörnchen, aber auch an wild lebende Katzen, Hasen und Kaninchen gebunden. Ausbrüche kommen deshalb fast weltweit vor, sind aber selten und konnten mit Ausnahme von Madagaskar meist schnell eingegrenzt werden und erreichen nur niedrige Fallzahlen. Eine große Gefahr ist im Frühstadium der Erkrankung aufgrund erster Symptome die Verwechslung mit einer Erkältung,[51] die am besten durch eine ärztliche Differenzialdiagnostik (Krankheitssymptome und Zugehörigkeit zu einer Risikogruppe) ausgeschlossen werden kann.[52] Von 1978 bis 1992 meldete die Weltgesundheitsorganisation (WHO) 1451 Todesfälle in 21 Ländern. In den USA gab es beispielsweise 1992 dreizehn Infektionen und zwei Todesfälle. Für den Zeitraum 2010 bis 2015 verzeichnete die WHO 3248 Fälle weltweit, darunter 584 an der Pest Verstorbene.[53]
Regionale Pestereignisse in verschiedenen Ländern
Eine größere Pestepidemie ereignete sich von August bis Oktober 1994 im indischen Surat. Die WHO zählte 6344 vermutete und 234 erwiesene Pestfälle mit 56 Toten. Der dort festgestellte Pesterreger wies dabei bislang noch nicht beobachtete Eigenschaften auf. Er zeichnete sich durch eine schwache Virulenz aus und gilt aufgrund einiger molekularbiologischer Besonderheiten als neuartiger Erregerstamm.
Im Jahr 2003 kam es in Algerien nach 50 Jahren wieder zu einem Pestausbruch.[54]
Im Februar 2005 breitete sich die Lungenpest in Bas-Uele im Norden der Demokratischen Republik Kongo aus. Nach Berichten der WHO gab es 64 Tote. Durch das Eingreifen der Organisation Ärzte ohne Grenzen konnte eine weitere Verbreitung verhindert werden.[55] Am 14. Juni 2006 wurden im Kongo 100 Pesttote gemeldet, wobei die am stärksten betroffene Region der Distrikt Ituri im Nordosten war mit bis zu 1000 Fällen pro Jahr, sowohl Lungenpest als auch Beulenpest.[56]
Im November 2008 wurde ein erneuter Ausbruch der Erkrankung in Uganda von den lokalen Zeitungen gemeldet.[57] Betroffen waren insgesamt zwölf Menschen, von denen drei starben.
In den südwestlichen US-amerikanischen Bundesstaaten treten immer wieder Pestfälle auf. Das silvatische (von lateinisch silva „Wald“) Erregerreservoir bilden hier Präriehunde. Werden erkrankte Präriehunde von Hauskatzen erbeutet, so erkranken diese in 10 % der Fälle an Lungenpest und scheiden große Mengen des Erregers aus. Sie sind dann eine Infektionsquelle für den Tierbesitzer und andere Kontaktpersonen.[58] Insgesamt erkranken in den USA jährlich zehn bis zwanzig Menschen an der Pest, wobei die Zahlen rückläufig sind. Dies wird vom Osloer Biologen Nils Christian Stenseth auf den Klimawandel zurückgeführt.[59][60] Anfang August 2009 wurde in Ziketan in der tibetisch geprägten Provinz Qinghai im Nordwesten Chinas bei elf Menschen die Infektion mit Lungenpest festgestellt. Ein Mensch starb. 2014 wurde eine chinesische Kleinstadt unter Quarantäne gestellt, nachdem ein Mann an der Pest gestorben war.[61][62]
Anfang Juni 2018 wurde laut dem Nachrichtenmagazin Stern im US-Bundesstaat Idaho bei einem Menschen die Beulenpest festgestellt. Der letzte Fall der Beulenpest in Idaho lag bis dahin 26 Jahre zurück.[63]
2019 starb in der Mongolei ein Ehepaar nach Verzehr eines vermutlich infizierten Murmeltieres.[64]
Pestvorkommen in Madagaskar seit 2008

Anfang 2008 brach auch in Madagaskar die Pest aus, 18 Menschen fanden dabei den Tod. 2010 starben 18 Menschen. Von Jahresbeginn bis März 2011 waren 60 Menschen gestorben und 200 weitere erkrankt.[65] Betroffen sind vor allem abgeschiedene Regionen wie der Bereich um das Städtchen Ambilobe im Nordwesten, weitere Fälle gab es im Osten und im Hochland.[66]
Ende 2013 starben im abgelegenen Norden der Tropeninsel Madagaskar im Distrikt Mandritsara 20 Menschen an der Lungenpest. Seit September 2013 sind in vier verschiedenen Distrikten auf Madagaskar 36 Menschen der Infektionskrankheit zum Opfer gefallen.
Im Jahr 2014 starben in Madagaskar, in einem Mitte November noch grassierenden Pestausbruch, erneut mindestens 40 Menschen.[67]
Ende Oktober 2017 wurde gemeldet, dass die Zahl der Toten durch den jüngsten Pestausbruch auf Madagaskar auf 107 gestiegen ist. Mehr als 1100 Menschen haben sich mit der Krankheit infiziert, knapp 700 davon konnten bislang geheilt werden. Seit 2010 sind auf Madagaskar rund 600 Menschen an Pest gestorben.[68][69]
Die Pest in Kunst und Kultur

Seit der Pestepidemie von 1348 entstanden Pestbilder, die den göttlichen Zorn, meist in Form von Pfeilen oder Lanzen malerisch dargestellt, als Erklärung für die Erkrankungen versinnbildlichen sollten. Oft ist auf diesen Bildern eine vor diesem Gotteszorn schützende Schutzmantelmadonna abgebildet oder es werden die Schutzheiligen Sebastian oder auch Rochus gezeigt.[70] Zum Dank für das Erlöschen von Pestepidemien wurden vielerorts prachtvolle Pestsäulen aufgestellt.

Die Oberammergauer Passionsspiele finden als Einlösung eines Versprechens nach der überstandenen Pest 1634 statt. Seit 1680 finden sie im zehnjährigen Rhythmus statt und zählen zu den weltweit bekanntesten Passionsspielen. In ähnlicher Weise wird in der Stadt Flörsheim am Main seit 1666 bis in die Gegenwart am letzten Montag im August der sogenannte „Verlobte Tag“ zum Dank für die Verschonung der Bevölkerung von der Pest als örtlicher Feiertag begangen.
1827 wurde in Mailand Alessandro Manzonis Roman I Promessi Sposi veröffentlicht. In diesem vom Herbst 1628 bis etwa 1631 spielenden Buch ist eine Beschreibung der Pest von 1630 in Mailand enthalten, die „in ihrer unpathetischen Direktheit zu den stärksten Eindrücken des Romans“ gehört und „einer der Höhepunkte der italienischen Prosa überhaupt“[71] ist.

Am 5. März 1838 wurde die Oper Guido et Ginevra, ou La Peste de Florence von Fromental Halévy nach einem Libretto Eugène Scribes an der Pariser Oper uraufgeführt. Die Handlung spielt in der Toscana im Jahre 1552. 1881 veröffentlichte der dänische Schriftsteller Jens Peter Jacobsen die Novelle Pesten i Bergamo („Die Pest in Bergamo“). Arnold Böcklin schuf zu diesem Thema 1898 in Italien das Bild Die Pest oder auch Der Schwarze Tod, das heute im Kunstmuseum Basel ausgestellt ist. Böcklin personifiziert die Pest in seinem Bild als einen auf einem fliegenden Ungeheuer reitenden Sensenmann, vor dem es kein Entrinnen gibt. Die Sense und die skelettartige Gestalt greifen auf die mittelalterliche Todesallegorie zurück.
Nach einem Drehbuch von Fritz Lang entstand 1919 als erster Film der Monumentalfilmreihe Decla-Weltklasse der Stummfilm Die Pest in Florenz, in dem die Pest das Florenz der Renaissance heimsucht. In der letzten Sequenz des Filmes zieht eine Personifikation der Pest tanzend und Geige spielend als eine Form des Totentanzes durch die Stadt. Die Darstellung der Pest dabei zeigt sehr deutliche Bezüge zu Arnold Böcklins Gemälde. 1921/1922 drehte Friedrich Wilhelm Murnau den Stummfilm Nosferatu – Eine Symphonie des Grauens, in dem ein Vampir symbolisch mit der Pest gleichgesetzt wird und deren bildhaft-körperliche Personifizierung darstellt. Noch deutlicher wird diese Metaphorik in Werner Herzogs Tonfilm-Adaption Nosferatu – Phantom der Nacht (1979) mit Klaus Kinski in der Titelrolle herausgearbeitet. Veit Harlan schildert in seinem 1938 gedrehten Seuchendrama Verwehte Spuren, einer Adaption des gleichnamigen Hörspiels von Hans Rothe, einen angeblich authentischen Pestfall während der ersten Pariser Weltausstellung im Jahr 1867. Ingmar Bergman drehte 1957 Das siebente Siegel (Det sjunde inseglet) mit Max von Sydow; der Film behandelt eine Pestepidemie im Schweden des 14. Jahrhunderts.
Albert Camus schrieb den Roman Die Pest (französisch La Peste) über einen neuzeitlichen Pestausbruch in der algerischen Stadt Oran (publiziert 1947). Darin trifft ein Arzt trotz der Aussichtslosigkeit und Absurdität des Kampfes gegen die Pest auf Menschlichkeit und Solidarität. Die Pest wird hierbei oft als Symbol für den Nationalsozialismus interpretiert. Vier Jahre zuvor veröffentlichte Raoul Maria de Àngelis den Roman La peste a Urana („Die Pest in Urana“).[72] Auch Marcel Pagnol schrieb eine Erzählung über die Pest. Sie hat die Verwüstung von Marseille 1720 zum Thema. Les Pestiférés erschien postum 1977 in Band IV der Souvenirs d’Enfance, Le Temps des Amours. 1973 entstand das 1975 in Spoleto aufgeführte Theaterstück Il sonno dei carnefici („Der Traum der Totengräber“) des Biologen und Schriftstellers Giorgio Celli, das sich mit der Pest in Sevilla befasst.[73]
Der Pesterreger als biologische Waffe
Der Pesterreger wird von der Weltgesundheitsorganisation zu den zwölf gefährlichsten biologischen Kampfstoffen gezählt. Zu diesen sogenannten dreckigen Dutzend gehören auch die des Milzbrands und der Tularämie sowie Pocken-, Ebola- und Marburg-Viren.
Es gibt die populäre Hypothese, dass die Pest als biologische Waffe bereits im 14. Jahrhundert zum Einsatz kam – als 1346 in der genuesischen Hafenstadt Kaffa auf der Krim der Tatarenführer Dschanibek Pestleichen über die Mauern der Stadt werfen ließ und die Belagerten vor der Pest nach Italien flüchteten. Nach einem Bericht von Gabriel des Mussis aus Piacenza[74] sollen bei der Belagerung Kaffas beteiligt gewesene Genuesen und Venezianer die Seuche mit Galeeren nach Messina, Pisa, Genua und Venedig eingeschleppt haben, von wo aus sie sich dann über ganz Italien verbreitete.[75] Dies wird jedoch kontrovers beurteilt und ist nicht eindeutig belegt.
Während des zweiten Chinesisch-Japanischen Krieges stellte die Japanische Armee im Einheit 731 genannten Gefangenenlager bei Harbin in der Mandschurei biologische Waffen her, die aus mit dem Pesterreger infizierten Flöhen bestanden und deren Einsatz in der Republik China in den Jahren 1940 bis 1942 lokale Pestausbrüche verursachte. Bei der Zerstörung der Produktionsstätten durch die japanische Armee 1945 bei Kriegsende kamen mit Pest infizierte Ratten frei und lösten in den chinesischen Provinzen Heilongjiang und Jilin eine Epidemie mit über 20.000 Todesopfern aus.
Während des Kalten Krieges beschäftigten sich sowjetische Wissenschaftler des Direktorium-15 im militärischen Forschungskomplex Biopreparat unter Leitung von Ken Alibek mit dem Einsatz von Pesterregern als biologische Waffe.
In Deutschland beschäftigt sich das Robert Koch-Institut mit den Gefahren durch biologische Kampfführung. Dort wurde auch die Informationsstelle des Bundes für biologische Sicherheit (IBBS) eingerichtet. Wie groß die Gefahr eines Angriffs mit biologischen Kampfstoffen tatsächlich ist, ist umstritten. Die IBBS rät nicht zu einer Impfung gegen die Pest in Deutschland. Diese Empfehlung gilt sowohl für die Bevölkerung insgesamt als auch für Risikogruppen.
Am 28. August 2014 berichtete die Zeitschrift Foreign Policy von einem in einem Versteck der Organisation „Islamischer Staat“ gefundenen Computer, der unter anderem Anleitungen zur Erstellung von Beulenpest-Waffen enthalten haben soll.[76]
Siehe auch
Literatur
- Alan M. Barnes, Thomas J. Quan, Jack D. Poland: Plague in the United States. In: Morbidity and Mortality Weekly Report 1985, S. 9–14.
- Ole Jørgen Benedictow: Svarte Dauen og senere Pestepidemier i Norge, Oslo 2002. ISBN 82-7477-108-7
- Ole Jørgen Benedictow: The Black Death: 1346–1353. The Complete History. Boydell Press: Woodbridge [u. a.] 2004; Reprint 2006.
- Klaus Bergdolt: Der Schwarze Tod in Europa. C.H. Beck, München 1994; 4. Auflage, mit dem Untertitel Die Große Pest und das Ende des Mittelalters, ebenda 2017, ISBN 978-3-406-70594-6.
- Klaus Bergdolt: Die Pest 1348 in Italien. Fünfzig zeitgenössische Quellen. Heidelberg 1989.
- Klaus Bergdolt: Pest. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1122–1127.
- Konrad Goehl, Johannes Gottfried Mayer: Was tun, wenn die Pest kommt: Götter lästern oder Juden brennen? In: Konrad Goehl, Johannes Gottfried Mayer (Hrsg.): Editionen und Studien zur lateinischen und deutschen Fachprosa des Mittelalters. Festgabe für Gundolf Keil zum 65. Geburtstag. Königshausen & Neumann, Würzburg 2000 (= Texte und Wissen. Band 3), ISBN 3-8260-1851-6, S. 127–166.
- Friedrich Hoffmann: Gründliche Untersuchung Von der Pest, Uhrsprung und Wesen: Nebst angehängten Bedencken, Wie man sich vor selbiger præserviren, und sie sicher curiren könne? Rüdiger, Berlin 1710 (Digitalisat).
- Stefan Leenen, Alexander Berner u. a.: Pest! Eine Spurensuche. (= Begleitband zur gleichnamigen Ausstellung im LWL-Museum für Archäologie, 20. September 2019 – 10. Mai 2020). wbg Theiss, Stuttgart 2019, ISBN 978-3-8062-3996-6.
- J. D. Marshall, R. J. T. Joy, N. V. Ai et al.: Plague in Vietnam 1965–1966. In: American Journal of Epidemiology. Band 86, 1967, S. 603–616.
- William Hardy McNeill: Plagues and Peoples. Penguin 1979.
- Claudia Eberhard Metzger, Renate Ries: Verkannt und heimtückisch – Die ungebrochene Macht der Seuchen. Birkhäuser, Basel 1996, ISBN 3-7643-5399-6.
- Volker Reinhardt: Die Macht der Seuche. Wie die Große Pest die Welt veränderte. C. H. Beck, München 2021, ISBN 978-3-406-76729-6.
- Michael Schaper: Die Pest. Leben und Sterben im Mittelalter. (= GEO Epoche. Heft 75). Gruner + Jahr, Hamburg 2015, ISBN 978-3-652-00444-2.
- Franz Schnyder: Pest und Pestverordnungen im alten Luzern. Stans 1932 (zugleich Dissertation Basel).
- Klaus Schwarz: Die Pest in Bremen. Epidemien und freier Handel in einer Deutschen Hansestadt 1350–1710. Staatsarchiv, Bremen 1996, ISBN 3-925729-19-4.
- Manfred Vasold: Die Pest. Theiss, Stuttgart 2003, ISBN 3-8062-1779-3.
- Volker Zimmermann: Krankheit und Gesellschaft: Die Pest. In: Sudhoffs Archiv. Band 72. 1988, S. 1–13.
- Karl Georg Zinn: Kanonen und Pest. Westdeutscher Verlag, Opladen 1989, ISBN 3-531-12107-3.
Weblinks
- Pest – Informationen des Robert Koch-Instituts
- Roger Seiler: Pest. In: Historisches Lexikon der Schweiz.
- V. J. Schuenemann, K. Bos u. a.: Targeted enrichment of ancient pathogens yielding the pPCP1 plasmid of Yersinia pestis from victims of the Black Death. In: PNAS. Band 108, Nummer 38, September 2011, S. E746–E752. doi:10.1073/pnas.1105107108. PMID 21876176. PMC 3179067 (freier Volltext).
- Johannes Krause, Verena Schünemann: Bakterium „Yersinia pestis“ zweifelsfrei als Erreger des Schwarzen Todes belegt (PDF; 167 kB) Information der Universität Tübingen, 30. August 2011
- Grafik über die Ausbreitung der Pest in Europa. aerzteblatt.de, August 2008
- Nina Weber: Schwarzer Tod in Europa: 650 Jahre altes Erbgut enttarnt Pest-Erreger. Spiegel Online, 30. August 2008
- Molekularbiologie: Auf den DNA-Spuren der Pest. deutschlandfunk.de, Forschung aktuell, 31. August 2016, Michaela Harbeck im Gespräch mit Lennart Pyritz
- A. Rakin: Yersinia pestis. Eine Bedrohung für die Menschheit. (PDF; 328 kB) In: Bundesgesundheitsblatt, Band 46, Nr. 11, 2003, S. 949–955. Archivlink abgerufen am 16. Juli 2024
- Pest plagte Menschen schon vor 5000 Jahren
- Frühe Belege
Einzelnachweise
- ↑ a b Karl Ernst Georges: Pest. In: Ausführliches lateinisch-deutsches Handwörterbuch. 8., verbesserte und vermehrte Auflage. Band 2. Hahnsche Buchhandlung, Hannover 1918, Sp. 1668–1669 (Digitalisat. zeno.org).
- ↑ Georg Deininger: Beitrag zur Pestlehre im 15. Jahrhundert. In: Deutsches Archiv für Geschichte der Medicin und medicinische Geographie. Band 3, 1880; Neudruck Olms, Hildesheim / New York 1971, S. 348–356 („Beulenpest“). Heinrich Schipperges: Die Kranken im Mittelalter. Beck, München 1990, S. 105 („jede gefährliche Seuche“, „Schwarzer“ Tod, vor allem „Bubonenpest“).
- ↑ Pestilenz, f.. In: Jacob Grimm, Wilhelm Grimm (Hrsg.): Deutsches Wörterbuch. 16 Bände in 32 Teilbänden, 1854–1960. S. Hirzel, Leipzig (woerterbuchnetz.de).
- ↑ Wilhelm Pape, Max Sengebusch (Bearb.): Handwörterbuch der griechischen Sprache. 3. Auflage, 6. Abdruck. Vieweg & Sohn, Braunschweig 1914 (zeno.org [abgerufen am 3. Mai 2021]).
- ↑ Gundolf Keil: Pest im Mittelalter: die Pandemie des „Schwarzen Todes“ von 1347–1351. In: Walter Buckl (Hrsg.): Das 14. Jahrhundert – Krisenzeit. Regensburg 1995 (= Eichstätter Kolloquium. Band 1), S. 95–107.
- ↑ Ratgeber Pest des Robert Koch-Instituts.
- ↑ Andreas Plettenberg: Dermatologische Infektiologie. Stuttgart 2004, S. 397.
- ↑ A. Bacot: LXIX. A study of the bionomics of the common rat fleas and other species associated with human habitations, with special reference to the influence of temperature and humidity at various periods of the life history of the insect. In: The Journal of hygiene. Band 13, SupplJanuar 1914, S. 447–654.15, ISSN 0022-1724. PMID 20474557. PMC 2167455 (freier Volltext).
- ↑ H. Chick, C. J. Martin: The Fleas Common on Rats in Different Parts of the World and the Readiness with which they Bite Man. In: The Journal of hygiene. Band 11, Nummer 1, März 1911, S. 122–136, ISSN 0022-1724. PMID 20474438. PMC 2167231 (freier Volltext).
- ↑ C. M. Wheeler und J. R. Douglas: Sylvatic plague studies V, The determination of vector efficiency. In: The Journal of Infectious Diseases, 77, 1945, S. 1–12.
- ↑ Georges Blanc, Marcel Baltazard: Recherches experimentales sur la peste. In: Comptes rendus des séances de l’Académie des Sciences, 213, 1941, 813–814.
- ↑ Georges Blanc, Marcel Baltazard: Recherches sur le mode de transmission naturelle de la peste bubonique et septicémique. In: Archives de l’Institut Pasteur du Maroc, 111, 5, 1945, S. 173–348.
- ↑ Georges Blanc, Marcel Baltazard: Recherches …, S. 192.
- ↑ Georges Girard: Les ectoparasites de l’homme dans l’épidémiologie de la peste. In: Bulletin de la Société de Pathologie Exotique XXXVI, 1943, S. 4–41.
- ↑ a b c Robert Pollitzer: Plague. WHO Genf 1954 S. 623–654; und: 1960 S. 387–400.
- ↑ A. Macchiavello: A Focus of Sylvatic Plague on the Peruvian-Ecuadorian Frontier. In: Science. Band 104, Nummer 2710, Dezember 1946, S. 522, ISSN 0036-8075. doi:10.1126/science.104.2710.522. PMID 17840540.
- ↑ a b Robert Pollitzer und Karl F. Meyer: The Ecology of Plague. In: Jacques M. May (Hrsg.): Studies in Disease Ecology, Studies in Medical Geography. Band 2, New York 1961, S. 433–590.
- ↑ R. J. Eisen, S. W. Bearden u. a.: Early-phase transmission of Yersinia pestis by unblocked fleas as a mechanism explaining rapidly spreading plague epizootics. In: Proceedings of the National Academy of Sciences, Band 103, Nummer 42, Oktober 2006, S. 15380–15385, ISSN 0027-8424. doi:10.1073/pnas.0606831103. PMID 17032761. PMC 1592641 (freier Volltext).
- ↑ Ole Jørgen Benedictow: Plague in the Late Medieval Nordic Countries. Oslo 1992, S. 241.
- ↑ a b D. M. Engelthaler, K. L. Gage: Quantities of Yersinia pestis in fleas (Siphonaptera: Pulicidae, Ceratophyllidae, and Hystrichopsyllidae) collected from areas of known or suspected plague activity. In: Journal of medical entomology. Band 37, Nummer 3, Mai 2000, S. 422–426, ISSN 0022-2585. PMID 15535587.
- ↑ Journal of Hygiene VII, 6, 1907 S. 724–762.
- ↑ J. Black, D. Black: Plague in east Suffolk 1906-1918. In: Journal of the Royal Society of Medicine. Band 93, Nummer 10, Oktober 2000, S. 540–543, ISSN 0141-0768. PMID 11064697. PMC 1298133 (freier Volltext).
- ↑ Meerschweinchen – Eine Spezialität, die das Leben kosten kann. In: Süddeutsche Zeitung. 11. Mai 2010, abgerufen am 14. März 2018.
- ↑ Pest – Übertragung und Symptome des „schwarzen Tods“. In: Bild der Frau. 6. April 2017 ., Archivlink vom 16. Juli 2024
- ↑ Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 9–223, hier: S. 220 f.
- ↑ Klaus Bergdolt: Pest. 2005, S. 1122.
- ↑ T.-H. Thieh: Primary Pneumonic Plague in Mukden, 1946, a Report of 39 Cases with 3 Recoveries. In: Journal of Infectious Diseases 82, 1948 S. 52–58.
- ↑ H. M. Jettmar: Erfahrungen über die Pest in Transbaikalien. In: Medical Microbiology and Immunology, Band 97, Januar 1923, S. 322–329.
- ↑ Dan C. Cavanaugh und James E. Williams: Plague: Some Ecological Interrelationships. In: R. Traub, H. Starcke (Hrsg.): Fleas, Proceedings of the International Conference on Fleas. Ashton Wold, Peterborough UK, 21–25 June 1977. Rotterdam 1980, S. 245–256, 251.
- ↑ a b c d Wu Lien-Teh: A Treatise on Pneumonic Plague. In: Publications of the League of Nations III. 13, Genève 1926.
- ↑ Wilhelm Kirch: Encyclopedia of Public Health, Volume 1: A – H, Springer 2008, ISBN 1-4020-5614-1, S. 1 unter „Abortive Plague“ eingeschränkte Vorschau in der Google-Buchsuche
- ↑ S. Chanteau, L. Rahalison u. a.: Development and testing of a rapid diagnostic test for bubonic and pneumonic plague. In: Lancet. Band 361, Nummer 9353, Januar 2003, S. 211–216, ISSN 0140-6736. doi:10.1016/S0140-6736(03)12270-2. PMID 12547544.
- ↑ W. P. Reed, D. L. Palmer u. a.: Bubonic plague in the Southwestern United States. A review of recent experience. In: Medicine. Band 49, Nummer 6, November 1970, S. 465–486, ISSN 0025-7974. PMID 4924535. (Review).
- ↑ a b c Meta Alexander: Pest. In: Hans Hornbostel, Werner Kaufmann, Walter Siegenthaler (Hrsg.): Innere Medizin in Praxis und Klinik. 4 Bände. 4., überarbeitete Auflage. Band 3: Blut und blutbildende Organe, Immunologie, Infektionen. Physikalische Einwirkungen. Georg Thieme:, Stuttgart / New York 1991, Kapitel 13.38
- ↑ H. Dubois: La dépression (XIVe et XVe siècles). In: Histoire de la population Française. 1988. S. 313–366. für Frankreich
- ↑ Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 159.
- ↑ Frederik Valeur Seersholm, Karl-Göran Sjögren, Julia Koelman, Malou Blank, Emma M. Svensson, Jacqueline Staring, Magdalena Fraser, Thomaz Pinotti, Hugh McColl, Charleen Gaunitz, Tatiana Ruiz-Bedoya, Lena Granehäll, Berenice Villegas-Ramirez, Anders Fischer, T. Douglas Price, Morten E. Allentoft, Astrid K. N. Iversen, Tony Axelsson, Torbjörn Ahlström, Anders Götherström, Jan Storå, Kristian Kristiansen, Eske Willerslev, Mattias Jakobsson, Helena Malmström, Martin Sikora: Repeated plague infections across six generations of Neolithic Farmers. In: Nature. Band 632, Nr. 8023, August 2024, ISSN 1476-4687, S. 114–121, doi:10.1038/s41586-024-07651-2, PMID 38987589, PMC 11291285 (freier Volltext) – (nature.com [abgerufen am 19. November 2024]).
- ↑ Bislang ältestes Genom der Beulenpest entschlüsselt. Hochgefährlicher Pesterreger rund 1000 Jahre älter als bisher bekannt, Pressemitteilung des Max-Planck-Instituts für Menschheitsgeschichte, 8. Juni 2018.
- ↑ MENSCHEN UND IHRE KRANKHEITEN IN SCHRIFTLOSEN ZEITEN. Die Pest und weitere Krankheiten im 3. vorchristlichen Jahrtausend – Fallbeispiele aus Sachsen. In: „voices“ — Online-Plattform der Staatlichen Kunstsammlungen Dresden. Hrsg. Staatliche Kunstsammlungen Dresden (SKD), 7. Juli 2023, abgerufen am 10. September 2023 (vgl. Andrades Valtueña et al. 2022, Rascovan et al. 2019, Rascovan et al. 2019, Susat et al. 2021 und Trautmann 2021).
- ↑ a b M. Harbeck, L. Seifert u. a.: Yersinia pestis DNA from skeletal remains from the 6(th) century AD reveals insights into Justinianic Plague. In: PLoS pathogens. Band 9, Nummer 5, 2013, S. e1003349, ISSN 1553-7374. doi:10.1371/journal.ppat.1003349. PMID 23658525. PMC 3642051 (freier Volltext).
- ↑ a b Genom des Schwarzen Todes vollständig rekonstruiert. (PDF; 841 kB) Pressemitteilung der Universität Tübingen, 12. Oktober 2011 (mit Bildern)
- ↑ David J. Bibel, T. H. Chen: Diagnosis of Plaque: an Analysis of the Yersin-Kitasato Controversy. In: Bacteriological reviews, Band 40, Nr. 3, September 1976, S. 633–651, ISSN 0005-3678, PMID 10879, PMC 413974 (freier Volltext)
- ↑ Alexandre Yersin: La peste bubonique à Hong-Kong. In: Annales de l’institut Pasteur, Band 8, 1894, S. 662–667.
- ↑ M. Simond, M. L. Godley, P. D. Mouriquand: Paul-Louis Simond and his discovery of plague transmission by rat fleas: a centenary. In: Journal of the Royal Society of Medicine. Band 91, Nummer 2, Februar 1998, S. 101–104, ISSN 0141-0768, PMID 9602755, PMC 1296502 (freier Volltext).
- ↑ Deutsche Medizinische Wochenschrift, 23, (1897) S. 503.
- ↑ Journal of Hygiene, X 3, 1910, S. 566–568.
- ↑ Journal of Hygiene VI, 4 (1906) S. 509–518.
- ↑ Journal of Hygiene X, 3, 1910 S. 598.
- ↑ K. I. Bos, V. J. Schuenemann u. a.: A draft genome of Yersinia pestis from victims of the Black Death. In: Nature, Band 478, Nummer 7370, Oktober 2011, S. 506–510, doi:10.1038/nature10549, PMID 21993626, PMC 3690193 (freier Volltext).
- ↑ M. A. Spyrou, L. Musralina, G. A. Gnecchi Ruscone et al.: The source of the Black Death in fourteenth-century central Eurasia. Hrsg.: Nature. 2022, ISSN 0028-0836, doi:10.1038/s41586-022-04800-3.
- ↑ Fabian Schmidt: Die Pest – vergessen aber nicht ausgerottet. Deutsche Welle, 8. Juli 2020
- ↑ Pest. Ratgeber des Robert-Koch-Instituts, 2. November 2017
- ↑ Plague. World Health Organization, Oktober 2017, abgerufen am 6. Januar 2021.
- ↑ Angela Grosse: Die Pest geht wieder um. In: abendblatt.de. 9. August 2006, abgerufen am 26. Dezember 2014.
- ↑ OMS – Peste en République démocratique du Congo – bulletin n°4. In: who.int. , Archivlink abgerufen am 16. Juli 2024
- ↑ Plague in the Democratic Republic of the Congo. Abgerufen am 16. Juli 2024 (englisch).
- ↑ Pestausbruch in Uganda ( vom 9. Juli 2012 im Webarchiv archive.today)
- ↑ Heinrich Neubauer: Zoonosen in Deutschland. Ein Überblick über vorkommende und mögliche Erreger. In: Deutsches Tierärzteblatt. (Dt. TÄbl.) 56, 2008, S. 1342–1346.
- ↑ rme: USA: Klimawandel drängt Pest zurück. In: aerzteblatt.de. 21. September 2010, archiviert vom (nicht mehr online verfügbar) am 26. Dezember 2014; abgerufen am 16. März 2020.
- ↑ Tamara Ben Ari, Alexander Gershunov, Rouyer Tristan, Bernard Cazelles, Kenneth Gage, Nils C. Stenseth: Interannual Variability of Human Plague Occurrence in the Western United States Explained by Tropical and North Pacific Ocean Climate Variability. In: The American Journal of Tropical Medicine and Hygiene. Band 83, 1. September 2010, S. 624–632, doi:10.4269/ajtmh.2010.09-0775.
- ↑ Stadt wegen Ausbruch von Beulenpest abgeriegelt. In: welt.de. 22. Juli 2014, abgerufen am 26. Dezember 2014.
- ↑ Dagny Lüdemann: Beulenpest: China verhängt Ausgangssperre. In: zeit.de. 22. Juli 2014, abgerufen am 26. Dezember 2014.
- ↑ Junge erkrankt an Beulenpest – erster Fall seit 26 Jahren. In: stern.de. 15. Juni 2018 (stern.de [abgerufen am 15. Juni 2018]).
- ↑ siberiantimes.com, Alert on Russian border with Mongolia after two deaths from ‘bubonic plague’, Archivlink abgerufen am 16. Juli 2024
- ↑ Pest tötet in Madagaskar 60 Menschen. ( vom 1. April 2011 im Internet Archive) Tagesschau (ARD), 31. März 2011. Der Link ist nicht mehr erreichbar.
- ↑ Bereits 23 Pestopfer in Madagaskar. orf.at, 23. Februar 2011
- ↑ 40 Pesttote auf Madagaskar, ORF online. Abgerufen am 10. Juni 2022.
- ↑ Madagaskar: Zahl der Pesttoten steigt auf über 100. Spiegel Online, 23. Oktober 2017; abgerufen am 25. Oktober 2017.
- ↑ 19 Menschen sterben bei Ausbruch der Pest. In: Spiegel Online. 29. September 2017, abgerufen am 3. Oktober 2017.
- ↑ Peter Dinzelbacher: Pestbild. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. Walter de Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1128.
- ↑ Walter Jens (Hg.): Kindlers Neues Literatur Lexikon, Studienausgabe, Kindler, München [1996], ISBN 3-463-43200-5, Band 11, Seite 112, linke Spalte.
- ↑ Percy Eckstein: Die Pest ist ansteckend. In: Die Zeit, Nr. 6/1949.
- ↑ Michael Quick: ‚Le parole sono pietre‘. Medizinische Aspekte italienischer Literatur des 20. Jahrhunderts. In: Würzburger medizinhistorische Mitteilungen, Band 7, 1989, S. 5–34, hier S. 22.
- ↑ Heinrich Haeser: Geschichte der epidemischen Krankheiten. Jena 1865 (= Lehrbuch der Geschichte der Medizin und der epidemischen Krankheiten, II), S. 17–23.
- ↑ Klaus Bergdolt: Die Pest 1348 in Venedig. In: Würzburger medizinhistorische Mitteilungen 8, 1990, S. 229–244; hier: S. 229.
- ↑ Found: The Islamic State’s Terror Laptop of Doom. Foreign Policy