Harnstoff
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Harnstoff | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | CH4N2O | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser, kristalliner Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 60,06 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,34 g·cm−3[4] | |||||||||||||||||||||
| Schmelzpunkt |
133 °C (Zersetzung)[4] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
sehr gut in Wasser: | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Harnstoff[11] (lateinisch und englisch urea), chemisch das Diamid der Kohlensäure, ist eine organische Verbindung. Er spielt eine wichtige Rolle in vielen biologischen Prozessen wie dem Stoffwechsel von Proteinen. Bei Säugetieren ist Harnstoff ein harnpflichtiges Stoffwechselprodukt, das hauptsächlich mit dem Urin und in geringem Umfang mit dem Schweiß[12] ausgeschieden wird.
Reiner Harnstoff, 1828 erstmals synthetisch hergestellt, ist ein weißer, kristalliner, geruchloser, ungiftiger und hygienisch unbedenklicher Feststoff, der sich gut in Wasser löst. Mit einem Produktionsvolumen von etwa 200 Millionen Tonnen pro Jahr ist er eine der meisthergestellten Chemikalien. Harnstoff ist ein viel genutzter Stickstoffdünger und Ausgangsstoff für die chemische Industrie, etwa für die Herstellung von Harnstoffharzen, die als Klebstoff, zur Imprägnierung oder Isolierung eingesetzt werden. Harnstoff dient darüber hinaus als Grundlage für die Synthese von Melamin, Barbitursäure, Coffein, Hydrazin und weiteren Chemikalien.
In der Ernährung von Wiederkäuern lässt sich Harnstoff als Stickstoffquelle für die Bildung von Proteinen nutzen. Die Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation führt Harnstoff als in Salben und Cremes angewandtes, keratolytisches und hautanfeuchtendes Mittel bei trockenen, rissigen und juckenden Hautzuständen.
Die Herstellung von Harnstoff aus anorganischen Ausgangsmaterialien war ein wichtiger konzeptioneller Meilenstein der Chemie und gilt als die Geburtsstunde der Biochemie. Diese Synthese zeigte, dass ein Stoffwechselprodukt im Labor ohne biologische Ausgangsmaterialien hergestellt werden kann, und führte letztendlich zum Fall der Lehre vom Vitalismus.
Geschichte
[Bearbeiten | Quelltext bearbeiten]

Der Niederländische Chemiker Herman Boerhaave entdeckte 1727 bei der Untersuchung von Urin den Harnstoff, den er sal nativus urinae nannte, „natürliches Salz des Harns“.[13] Hilaire-Marin Rouelle gelang 1773 ebenfalls die Gewinnung von Harnstoff mit einer alkoholischen Fällung aus Urinrückständen.[14] 1797 zeigte William Cruickshank, dass im Urin eine kristallisierbare Substanz vorhanden ist, die durch Salpetersäure gefällt werden kann. Damit hatte er den Harnstoff dargestellt.[15][16] Louis-Nicolas Vauquelin wies (mit seinem Doktorvater A. F. de Fourcroy)[17] Harnstoff im Tierharn nach und berichtete im Jahr 1800 darüber. Er wies außerdem nach, dass die von Rouelle gefundene Substanz identisch war mit einer Substanz, die Carl Wilhelm Scheele durch die Behandlung von Urin mit konzentrierter Salpetersäure erhalten hatte, und nannte die Substanz Harnstoff. 1812 stellte der Zoologe John Davy, ohne zu wissen um was es sich bei dem Reaktionsprodukt handelte, aus Phosgen und Ammoniak künstlichen Harnstoff her.[17] William Prout bestimmte 1817 die chemische Zusammensetzung von Harnstoff.[18]
Friedrich Wöhler stellte Harnstoff erstmals 1828 durch die Reaktionen von Silbercyanat (AgOCN) und Ammoniumchlorid (NH4Cl)
beziehungsweise von Bleicyanat (Pb(OCN)2) und flüssigem Ammoniak her.[19]
Die Zwischenverbindung Ammoniumcyanat (NH4OCN) erkannte er dabei als die eigentliche Harnstoffquelle.

Harnstoff gilt als die erste aus anorganischen Ausgangsstoffen synthetisierte organische Verbindung. Das widersprach der damals verbreiteten Vorstellung, dass organische Substanzen grundsätzlich nur von Lebewesen durch die so genannte vis vitalis (Lebenskraft) hergestellt werden könnten. Genau genommen erbrachte Wöhler bereits 1824 durch die Hydrolyse von Dicyan zu Oxalsäure den Nachweis, dass es für die Synthese organischer Moleküle nicht der „Lebenskraft“ bedarf.[20]

Im Jahr 1868 beschrieb Alexander Basaroff erstmals die kommerziell anwendbare Herstellung von Harnstoff aus Ammoniumcarbamat, welches unter Druck aus Ammoniak und Kohlenstoffdioxid zugänglich ist.[21]
Die großtechnische Realisierung dieses Verfahrens gelang Carl Bosch im Jahr 1922, nachdem Ammoniak in großen Mengen durch das Haber-Bosch-Verfahren sowie die erforderliche Hochdrucktechnik zur Verfügung stand.[22] Mit dem weltweiten Bau von Haber-Bosch-Anlagen nach dem Zweiten Weltkrieg stieg die Produktion von Harnstoff parallel zur Produktion von Ammoniak rasch an.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Harnstoff synthetischer oder biologischer Natur, der in die Umwelt gelangt, wird meist schnell von Bakterien in Ammonium-, Nitrit- und Nitrationen umgesetzt und wird somit Teil des Stickstoffkreislaufs. Zusammen mit Harnsäure ist Harnstoff Bestandteil der Ausscheidungen von Vögeln und Fledermäusen und kommt in Fledermausguano (Chiropterit) sowie in geringen Mengen in Guano vor.[23]
Als Mineral ist Harnstoff nur unter ariden Bedingungen stabil. Harnstoff wurde 1973 als natürliches Sekundärmineral bei Toppin Hill am Lake Rason (Westaustralien) gefunden, vergesellschaftet mit Ammoniumaphthitalit, Ammoniumphosphaten und Weddellit.[24] Es wurde von der International Mineralogical Association (IMA) als eigenständiges Mineral anerkannt. Diese führt es gemäß der Systematik der Minerale nach Strunz (9. Auflage) als „Diverse organische Verbindungen“ unter der System-Nr. „10.CA.35“. Die im englischsprachigen Raum ebenfalls geläufige Systematik der Minerale nach Dana führt das Mineral unter der System-Nr. „50.4.6.1“.[25]
Herstellung
[Bearbeiten | Quelltext bearbeiten]
Harnstoff lässt sich im Labormaßstab durch Reaktion von Ammoniak mit Phosgen oder Kohlensäureestern herstellen oder durch Hydrolyse von Cyanamid. Industriell wird Harnstoff in großen Mengen hergestellt, im Jahr 2012 weltweit rund 184 Millionen Tonnen.[26] Nach Angaben der International Fertilizer Industry Association (IFA) wird zwischen 2013 und 2018 eine weitere Steigerung der Produktionskapazität um 41 Millionen Tonnen erwartet, davon 5 Millionen Tonnen in den Vereinigten Staaten. Der Kapazitätsausbau in den USA ist auf den Ausbau der Schiefergasförderung zurückzuführen.[27]
Zur Herstellung von Harnstoff dienen große Anlagen, die aus Erdgas, Luft und Wasser im Haber-Bosch-Verfahren zunächst Ammoniak und schließlich Harnstoff herstellen. Das vorher bei der Wasserstoffherstellung abgetrennte Kohlenstoffdioxid wird zu zwei Dritteln bei der Produktion von Harnstoff gebunden.[28]
Die industrielle Produktion von Harnstoff in einem Hochdruckverfahren geht auf Carl Bosch und Wilhelm Meiser zurück.[22] Die BASF nahm 1922 die erste Produktionsanlage in Betrieb, bei der sich in einem Hochdruckreaktor im ersten Schritt bei 150 bar aus Ammoniak und Kohlenstoffdioxid in einer mit −117 kJ·mol−1 exothermen Reaktion Ammoniumcarbamat (NH4CO2NH2) bildete:[29]
Ammoniumcarbamat reagiert in einer mit +15,5 kJ·mol−1 endothermen Reaktion weiter zu Harnstoff und Wasser:[29]
Es handelt sich um eine Gleichgewichtsreaktion. Zur Optimierung der Ausbeute wird mit einem Überschuss von Ammoniak gearbeitet. In den Prozess zurückgeführte Gase sollten möglichst wasserfrei sein, da Wasser das Gleichgewicht auf die Seite des Ammoniumcarbamats verschiebt.[29] Die Gesamtreaktion ist exotherm. Als Nebenprodukt entsteht unter anderem Isocyansäure.
Die Reaktion lässt sich durch Arbeiten in einem Ammoniaküberschuss unterdrücken.[30] Überschüssiges Ammoniak verwendete die BASF zunächst zur Herstellung von Ammoniumsulfat und Ammoniumnitrat. Ende der 1920er Jahre wurde das Verfahren verbessert und überschüssiges Ammoniak in den Produktionsprozess zurückgeführt. Hieraus entwickelten sich verschiedene Totalkreislaufverfahren, etwa von DuPont, Pechiney oder Stamicarbon.[28]
Die Prozesse unterscheiden sich in der Art der Zersetzung von Ammoniumcarbamat, der Abtrennung und Wiedergewinnung von Kohlenstoffdioxid und Ammoniak sowie der Verarbeitung des Harnstoffs.[28] Die Reaktionstemperaturen liegen je nach Prozess zwischen 170 und 220 °C, der Reaktionsdruck zwischen 125 und 250 bar.[30] Allen modernen industriellen Verfahren ist gemeinsam, dass die Überschussgase wieder in den Reaktor zurückgeführt werden, wobei Strippingverfahren eingesetzt werden.[28]
Für die Produktion von einer Tonne Harnstoff werden 0,58 Tonnen Ammoniak und 0,76 Tonnen Kohlenstoffdioxid benötigt. Je nach Prozess werden zwischen 85 und 160 kWh elektrischer Energie sowie zwischen 0,9 und 2,3 Tonnen Dampf benötigt.[28]
Eine wichtige Überlegung bei der Prozessauslegung ist die Begrenzung des Gehaltes an Biuret, das sich aus Harnstoff bei Temperatureinwirkung bildet und als Verunreinigung in industriell hergestelltem Harnstoff vorhanden ist. Der Gehalt an Biuret im Harnstoff muss begrenzt werden, meist kleiner als 1,0 %, da sich Biuret hemmend auf die Entwicklung von Saatgut und das gesunde Pflanzenwachstum auswirkt.[31][28]
Der zunächst in Lösung anfallende Harnstoff wird traditionell durch Prillieren, auch Sprühkristallisation genannt, in ein feinkörniges Schüttgut mit einer Korngröße von etwa zwei Millimetern umgewandelt und sackweise oder lose vertrieben. Dazu wird in einem Prillturm eine flüssige Harnstoffschmelze in kleine Tropfen zerteilt und dem freien Fall übergeben; große Ventilatoren am Kopf des Turms saugen kalte Frischluft im Gegenstrom an, wodurch die Flüssigkeit während des Falls zu festen Kügelchen erstarrt. Durch das Schmelzen und Erkalten bildet sich eine relativ kleine Oberfläche, der Harnstoff wird dadurch unter anderem weniger hygroskopisch und die Fließeigenschaften erhalten sich dadurch über mehrere Monate.[32] Da Prills besonders bezüglich Größe und Festigkeit Nachteile aufweisen, wird fester Harnstoff in neueren Düngemittelanlagen fast ausschließlich granuliert, wobei die Sprühgranulation in einem Fließbett die modernste und in Neuanlagen fast ausschließlich verwendete Technologie darstellt. Die größten Anlagen der Welt produzieren in einer Produktionslinie etwa 4000 Tonnen Harnstoff am Tag.[29]
Harnstoffanlagen mit Kapazitäten von 50 mtpd bis 6000 mtpd werden u. a. von der Firma thyssenkrupp Uhde in Lizenz gebaut. Diese Anlagen sind standardmäßig mit Granulationstechnologie von thyssenkrupp Fertilizer Technology ausgestattet, während für die Synthese die Technologie von Stamicarbon verwendet wird.
Harnstoff mit einem geringeren Gehalt an Biuret lässt sich durch die Kristallisation aus der Mutterlauge gewinnen. Das Biuret verbleibt in der wässrigen Phase und kann so abgetrennt werden. Die Weiterverarbeitung kann ebenfalls mittels Prillieren erfolgen.[33]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]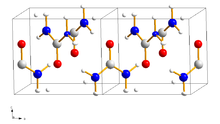
_ Sauerstoff, _ Stickstoff,
_ Kohlenstoff, _ Wasserstoff
Harnstoff ist unter Standardbedingungen ein farbloser kristalliner Feststoff mit einer Dichte von 1,32 g/cm3.[3] Er schmilzt im Bereich von 132,5 bis 134,5 °C unter Zersetzung. Der Dampfdruck bei 75 °C beträgt 0,2 Pascal.[4] Harnstoff löst sich sehr gut in Wasser und anderen polaren Lösungsmitteln; dabei löst sich ein Gramm Harnstoff in 1,5 ml Wasser, 10 ml Ethanol, 6 ml Methanol oder 2 ml Glycerin.[34]
Harnstoff kristallisiert im tetragonalen Kristallsystem mit der Raumgruppe P421m (Raumgruppen-Nr. 113) mit den Gitterparametern a = 564,6 pm, c = 470 pm und einem Verhältnis von a : c = 1 : 0,833.[35][36] Er entwickelt farblose bis blass-gelbe oder blass-braune, nadelförmige Kristalle.[36] Fester Harnstoff weist am Sauerstoffatom zwei N–H–O-Wasserstoffbrückenbindungen auf, die Distanz zwischen den Sauerstoff- und den Wasserstoffatomen beträgt 299 Pikometer und 304 Pikometer.[35] Unter hohem Druck brechen die vorhandenen Wasserstoffbrückenbindungen unter anschließender Ausbildung neuer Bindungen. Ab einem Druck von 4800 bar bildet sich eine orthorhombische Phase mit der Raumgruppe P212121 (Raumgruppen-Nr. 19).[37]
Die Kristallstruktur besteht aus Bändern in Helixform, die organische Verbindungen als Gastmoleküle einlagern können. In diesen Clathraten werden die organischen Gastmoleküle in den Kanälen, die durch interpenetrierende Helices von Wasserstoff-gebundenen Harnstoffmolekülen gebildet werden, gehalten. Dieses Verhalten kann zur Trennung von linearen und verzweigten Kohlenwasserstoffgemischen verwendet werden, beispielsweise in der Harnstoff-Extraktiv-Kristallisation.[38]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]- Harnstoff löst sich leicht in Wasser und Ethanol, aber nicht in Diethylether oder Benzol. Die wässrige Lösung reagiert neutral. Mit Säuren bildet sich die protonierte Form [NH2C(OH)NH2]+.[39] Die Harnstoffsalze der Salpetersäure sind Explosivstoffe. Beim Erhitzen der wässrigen Lösung mit Säuren zerfällt Harnstoff in Kohlenstoffdioxid und Ammoniumsalze, beim Erhitzen mit Laugen in Carbonate und Ammoniak.
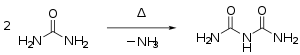
- Harnstoff kondensiert beim Erhitzen über den Schmelzpunkt unter Abspaltung von Ammoniak zunächst zu Isocyansäure, die mit Harnstoff weiter zu Biuret reagiert:[29]
Bei höheren Temperaturen bilden sich weitere Kondensationsprodukte wie Triuret, Guanidin und Melamin.[29]
Diese Transamidierungen sind wichtige Reaktionen zur generellen Darstellung von Harnstoffderivaten:[40]
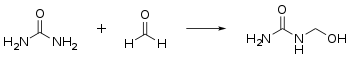
- Mit Formaldehyd reagiert Harnstoff in einer Additionsreaktion zu Methylolharnstoffen, die Hydroxymethylgruppen aufweisen:[29]
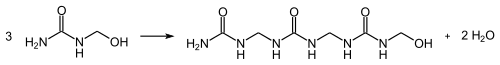
Diese reagieren in einer Kondensationsreaktion unter Freisetzung von Wasser und Ausbildung von Methylengruppen zu Harnstoffharzen:
- Harnstoff bildet mit Wasserstoffperoxid ein Wasserstoffperoxid-Harnstoff-Addukt, das Carbamidperoxid. Dies ist ein wasserlösliches kristallines Addukt, das sich bei der Umkristallisation von Harnstoff mit konzentrierter Wasserstoffperoxid-Lösung bildet. Es enthält etwa 35 % Wasserstoffperoxid.[41]
Der Wasserstoff lässt sich durch verschiedene Reaktionen teilweise oder ganz durch andere Substituenten ersetzen. Mit Benzoylchloriden etwa entstehen Imide wie Benzoylharnstoffe, durch Reaktion mit Sulfonylchlorid entstehen Sulfonylharnstoffe.
Durch Erhitzen auf etwa 200 bis 300 °C bildet sich Cyanursäure.[42]
- Durch Einleiten von Chlor in eine 20%ige Harnstofflösung und anschließender Zugabe von 20%iger Natronlauge entsteht Hydrazin in 50%iger Ausbeute in einer Hofmann-Umlagerung.[43]
- Harnstoff zerfällt bei sehr hohen Temperaturen zu Ammoniak und Kohlendioxid
Das dabei entstehende Ammoniak wird im SNR-Verfahren genutzt, um die in Abgasen von Kraftwerken und Verbrennungsmotoren enthaltenen Stickoxide zum elementaren Stickstoff zu reduzieren
Molekulare Eigenschaften
[Bearbeiten | Quelltext bearbeiten]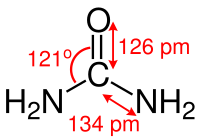
Das Kohlenstoff-Atom des Harnstoffmoleküls ist trigonal planar koordiniert (grob: sp2-hybridisiert), die Kohlenstoff-Stickstoff-Bindungen weisen einen signifikanten Doppelbindungscharakter auf und sind, verglichen mit den Kohlenstoff-Stickstoff-Bindungen in Alkylaminen, um etwa 10 Pikometer kürzer. Der Atomabstand zwischen Stickstoff und Wasserstoff beträgt 105 Pikometer, der Abstand zwischen Stickstoff und Kohlenstoff beträgt 134 Pikometer und der Abstand zwischen Kohlenstoff und Sauerstoff beträgt 126 Pikometer.[35] Der N–C–O-Winkel beträgt 121°.[35] Das Molekül weist insgesamt C2v-Symmetrie auf.[44]
Die Streckschwingung νN–H liegt im infraroten Bereich des Spektrums bei einer Wellenzahl von 3396 cm−1 und damit höher als bei Ammoniak, das eine Wellenzahl von 3372 cm−1 aufweist. Die νC=O-Streckschwingung liegt bei 1687 cm−1 und weist auf eine Resonanz zwischen einer Carbonyl- und Alkoholatstruktur hin. Die νC-N-Streckschwingung liegt bei 1465 cm−1.[45]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Eine industrielle Verwendungsmöglichkeit von Harnstoff ist die Herstellung von Melamin, das z. B. mit Formaldehyd zu Kunstharzen verarbeitet wird, und von Harnstoff-Formaldehyd-Harzen (Harnstoffharz, so genannte UF-Harze), die z. B. zur Produktion von Spanplatten eingesetzt werden.[46] Ansonsten dient Harnstoff überwiegend als Stickstoffdünger oder als Reduktionsmittel für Stickoxide beim SNCR-Verfahren.[47] Der Bedarf an Harnstoff stieg im Laufe der Jahre ständig an, allein zwischen 1960 und 1970 verdreifachte sich der Bedarf und die Produktionskapazität.[28] Zwischen 1990 und 2010 wuchs der Bedarf stetig um etwas mehr als 3 % jährlich, wobei die installierte Kapazität den Bedarf um circa 10 bis 20 % überstieg.[29] Treiber für eine weitere Steigerung der Nachfrage könnten sowohl steigende Anforderungen an die Stickoxidreduzierung im Straßenverkehr als auch der Ausbau der Biokraftstoffkapazität werden.[29]
Stickstoffdünger
[Bearbeiten | Quelltext bearbeiten]
Harnstoff weist mit 46,63 % den höchsten Stickstoffgehalt aller herkömmlichen Stickstoffdünger auf; das ebenfalls oft verwendete Ammoniumnitrat etwa besitzt einen Stickstoffgehalt von 35 %. Viele Bodenbakterien besitzen das Enzym Urease, das die Umsetzung von Harnstoff zu Ammoniak oder Ammoniumionen und Hydrogencarbonationen katalysiert.[48]
Um nicht als Gas in der Atmosphäre verloren zu gehen, muss Ammoniak mit Wasser oder einer Säure zum Ammoniumion fixiert werden:
Ammoniak-oxidierende Nitritbakterien wie Nitrosomonas oxidieren dieses unter Energiegewinn in der so genannten Nitrifikation zu Nitrit:[49]
Nitritoxidierer wie Nitrobacter oxidieren das entstehende Nitrit weiter zu Nitrat:
Pflanzen nehmen Ammoniumionen und Nitrat leicht auf; sie bilden die überwiegenden Stickstoffquellen für das Pflanzenwachstum.[50]
Harnstoff ist der global meistverwendete Stickstoffdünger, berechnet auf Basis des Stickstoffgehalts. In verschiedenen Regionen, etwa Asien, lag der prozentuale Anteil 1997 über 50 %.[51]
| Anteil verschiedener Stickstoffdünger am globalen Verbrauch (auf Basis Stickstoff; 1997)[51] | |
|---|---|
| Dünger | Prozentualer Anteil |
| Harnstoff | 44,22 |
| Ammoniumnitrat | 9,52 |
| Ammoniak | 5,67 |
| Ammoniumnitrat-Harnstoff-Lösung | 4,96 |
| Kalkammonsalpeter | 4,31 |
| Ammoniumsulfat | 3,06 |
| Andere | 28,26 |
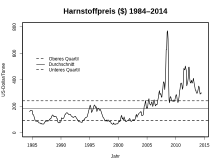
Der Verbrauch stieg besonders stark in asiatischen Ländern an. Im Jahr 2013 waren Indien, China und Pakistan die weltweit größten Konsumenten von Harnstoff.
| Liste der zehn Länder mit dem größten Harnstoffkonsum[53] | ||
|---|---|---|
| Land | Jahr | Verbrauch in Millionen Tonnen |
| Indien | 2013 | 30,60 |
| China | 2012 | 28,50 |
| Pakistan | 2013 | 5,89 |
| Vereinigte Staaten | 2013 | 5,60 |
| Indonesien | 2013 | 4,77 |
| Brasilien | 2013 | 4,56 |
| Kanada | 2013 | 3,38 |
| Thailand | 2013 | 2,37 |
| Ägypten | 2013 | 1,93 |
| Iran | 2013 | 1,84 |
Der Harnstoffpreis bewegte sich lange um 100 US-Dollar/Tonne, von 2003 bis zum Höhepunkt im August 2008 mit 770 $/t stieg er jedoch rasant an. Danach fiel er wieder und lag im Juni 2016 bei knapp 200 $/t.[52]
Medizinische Anwendungen
[Bearbeiten | Quelltext bearbeiten]In der Pharmazie dient Harnstoff als Keratolytikum (d. h. als hornlösender Wirkstoff). Diese Eigenschaft wird in verschiedenen Rezepturen genutzt. Beispielsweise wirkt er hochkonzentriert (40 %) in Pasten zusammen mit einem Antipilzmittel (Antimykotikum) gegen Nagelpilz (Onychomykose), wobei der Harnstoff den Nagel so weich macht, dass sich die infizierte Nagelsubstanz Stück für Stück abtragen lässt.[54] Weiter dient er als Feuchtigkeitsspender in Salben zur Bekämpfung von atopischen Ekzemen und Lichenerkrankungen. Früher wurde Harnstoff in wässriger Lösung als harntreibendes Mittel bei Rippenfellentzündung und Leberzirrhose verordnet.[55]
Harnstoff wird in der Ersten Hilfe als Komponente von Kältepacks genutzt, um Zerrungen oder Prellungen zu kühlen. Diese bestehen aus zwei abgetrennten Bereichen, von denen sich in einem Harnstoff befindet, im anderen Wasser. Wird die Trennung aufgehoben, löst sich der Harnstoff im Wasser. Da die Gitterenergie größer als die Hydrationsenergie ist, entzieht der Lösungsvorgang der Umgebung Energie und kühlt diese ab.[56]
Durch die Gabe von 13C-markiertem Harnstoff und dem nachfolgenden Nachweis von 13C-markiertem Kohlenstoffdioxid mittels eines 13C-Harnstoff-Atemtests gelingt der Nachweis von Helicobacter pylori im Magen. Das freigesetzte Kohlenstoffdioxid weist auf die Anwesenheit des Enzyms Urease hin, mit dem das Bakterium aus Harnstoff Ammoniak erzeugt und damit den pH-Wert der Magenumgebung erhöht. Das Bakterium ist einer der Verursacher von Ulcera.[57]

Einige Derivate des Harnstoffs sind Wirkstoffe in Arzneimitteln und Pflanzenschutzmitteln. Barbitursäure und Barbiturate sind Derivate des Harnstoffs, die aus Malonsäurediethylester und deren Derivaten und Harnstoff zugänglich sind.[58]
Sulfonylharnstoffe finden Anwendung als orale Antidiabetika, außerdem bilden sie eine wichtige Herbizidgruppe.[59]
Die Harnstoffkonzentration im Blut oder der damit über den Faktor 0,467 verknüpfte Blut-Harnstoff-Stickstoff gehören zu den Nierenretentionsparametern, die als medizinische Indikatoren in der Nephrologie zur Beurteilung der Leistungsfähigkeit der Niere bestimmt werden. Erhöhte Werte können auf eine eingeschränkte Nierenfunktion hinweisen, werden jedoch vielfältig beeinflusst, etwa durch die Proteinzufuhr.[60]
Das Harnstoff-Reduktionsverhältnis (Urea Reduction Ratio (URR)) ist ein Maß für die Eliminierung von gelösten Stoffen während der Hämodialyse. Das Harnstoff-Reduktionsverhältnis ist der Bruchteil der Blutharnstoffkonzentration, der in Relation zur gesamten Blutharnstoffkonzentration während einer Hämodialyse-Behandlung entfernt wird.[61]
Umweltschutz
[Bearbeiten | Quelltext bearbeiten]Harnstoff wird zur Reduktion von Stickoxiden im Abgas von Kraftwerken und Verbrennungsmotoren verwendet. In Kraftwerken wird – vornehmlich bei kleineren Anlagen – das SNCR-Verfahren (selektive nichtkatalytische Reduktion) angewandt.[47] Beim sogenannten SCR-Verfahren (selektive katalytische Reduktion), das in Kraftwerken und in der Abgasnachbehandlung bei Dieselmotoren eingesetzt wird, wird Harnstoff oder Ammoniak in den heißen Abgasstrom eingespritzt.[47] Der Harnstoff zersetzt sich zu Ammoniak, das in einem nachgeschalteten Katalysator die Stickoxide reduziert. In der Kraftfahrzeugtechnik wird eine wässrige Lösung mit 32,5 % Harnstoffanteil verwendet, die unter der Bezeichnung AUS 32 genormt ist. Der Verbrauch an Harnstofflösung beträgt etwa 2 bis 8 % des Treibstoffverbrauchs.[62]
Lebensmittelherstellung
[Bearbeiten | Quelltext bearbeiten]Harnstoff wird Lebensmitteln als Stabilisator zugesetzt. In der EU ist er als Lebensmittelzusatzstoff mit der Bezeichnung E 927b ausschließlich für Kaugummi ohne Zuckerzusatz zugelassen. Er wirkt im Mund durch Abspaltung von Ammoniak als Säureregulator.[63]
In der Rinderhaltung spielt Harnstoff eine Rolle als Stickstoffquelle. Harnstoff liefert zwar den Stickstoff für die Ernährung, zusätzlich benötigt die Kuh aber Energie und Mineralstoffe im Pansen, um daraus Proteine zu erzeugen. Aus 100 Gramm Harnstoff entstehen theoretisch 2875 Gramm Rohprotein. Harnstoff darf seit 2008 nur noch zur Beifütterung eingesetzt werden, wenn der Tierhalter bestimmte Voraussetzungen gemäß der Futtermittelhygieneverordnung erfüllt.[64]
Der Zusatz von Harnstoff in höheren Konzentrationen zu wässrigen Lösungen führt zu einer Denaturierung von Proteinen, Harnstoff wirkt daher als Denaturierungsmittel beziehungsweise als chaotrope Verbindung. Niedrige Konzentrationen von Harnstoff können jedoch die gegenteilige Wirkung entfalten, etwa den hydrophoben Effekt verstärken und somit die Proteinstruktur stabilisieren.[65]
Der Harnstoffgehalt von Rochen und Haien führt dazu, dass diese vor dem Verzehr zunächst mehrere Wochen fermentiert werden müssen, um den Harnstoff zu Ammoniak abzubauen und abzugasen. Fermentierter Rochen und Grönlandhaie, unter dem Namen Gammelrochen und Hákarl bekannt, gelten als isländische Spezialitäten.[66]
Sonstige Verwendung
[Bearbeiten | Quelltext bearbeiten]Harnstoff wird als Streusalz-Ersatz eingesetzt, was aber wegen seines höheren Preises nur in Sonderfällen erfolgt, zum Beispiel für die Bewegungsflächenenteisung auf Flughäfen. In der Schweiz ist der Einsatz nur auf Flughäfen erlaubt.[67]

Harnstoff wird in der Harnstoff-Extraktiv-Kristallisation, einem Verfahren zur Abtrennung linearer Paraffine aus Kohlenwasserstoffgemischen durch Bildung von Harnstoff-n-Paraffin-Clathraten, verwendet. Die Trennung dient der Erniedrigung des Stockpunkts von Mineralölprodukten, als Nebenprodukte fallen n-Paraffine in hoher Reinheit an.[68][69] Das Verfahren kann zur Trennung von Fettsäuren und Fettalkoholen angewendet werden.[70]
Die denaturierende Wirkung von Harnstoff auf Proteine wird bei der Urea-PAGE, der Harnstoff-Polyacrylamid-Gelelektrophorese genutzt.[71] Die dabei verwendeten Harnstoffkonzentrationen liegen in der Größenordnung von 4 bis 8-molar. Im Gegensatz zur SDS-PAGE ändert sich bei der Urea-PAGE die Ladung der Proteine praktisch nicht, was eine Trennung von Proteinen mit gleichen Molekülmassen, aber unterschiedlichen Ladungen ermöglicht. Das effektive Volumen der einzelnen Proteinmoleküle ist bei der Urea-PAGE größer als bei der Nativ-PAGE, und die Aggregate der Proteinmoleküle zerfallen in ihre Untereinheiten. Falls die Proteinmoleküle oder ihre Aggregate durch Disulfidbrücken stabilisiert werden, werden bei der Urea-PAGE reduzierende Thiole zugesetzt, ähnlich wie bei der SDS-PAGE.
Harnstoff wird wegen seiner hohen Wasserbindungsfähigkeit häufig als Feuchtigkeitsfaktor in Kosmetika eingesetzt, meist als Urea deklariert.[72]
Ein Feuerlöschpulver auf Basis von Kaliumhydrogencarbonat verwendet Harnstoff als Komponente. Das Pulver wird zur Bekämpfung von Feuern der Brandklassen BC verwendet. In Deutschland ist der Einsatz nicht zugelassen.[73]
Benzoylharnstoffe sind Insektizide, die als Chitininhibitor wirken.[74]
Ebenso hilft Urea in Forstbeständen bei der Vorbeugung von Pilzinfektionen.[75] Auf Baumstümpfe aufgetragen hält es beispielsweise Heterobasidion davon ab, in die toten Wurzeln des Baumstumpfes einzudringen und so die Wurzeln der noch stehenden Bäume zu erreichen.
In der direkten Harnstoff-Brennstoffzelle (Direct Urea Fuel Cell (DUFC)) dient Harnstoff als Wasserstofflieferant. Neben der Energieerzeugung eignet sich das Verfahren zur Entfernung von Harnstoff aus Abwässern.[76]
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]
Viele Wirbeltiere, etwa Plattenkiemer wie Haie und Rochen, Amphibien und Säugetiere produzieren Harnstoff als ein Endprodukt des Stoffwechsels von Stickstoffverbindungen wie Aminosäuren. Er gehört zu den harnpflichtigen Substanzen. Beim Aminosäureabbau entsteht zunächst Ammoniak, das in entsprechend hohen Konzentrationen giftig auf Zellen wirkt.
Die Bildung von Harnstoff findet in der Leber durch die Reaktion von äquimolaren Mengen Ammonium (NH4+) und Hydrogencarbonat (HCO3-) im Harnstoffzyklus statt. Von der Leber wird er zur Niere transportiert und mit dem Harn ausgeschieden. Der Feststoffgehalt im Harn besteht etwa zur Hälfte aus Harnstoff. Harnstoffzyklusdefekte sind erblich bedingte Stoffwechselerkrankungen, die mit einer Störung der Ammoniakumwandlung einhergehen. Sie führen zu einem erhöhten Ammoniakgehalt im Blut, der Nervenzellen schädigt. Geringe Mengen Harnstoff werden beim Menschen über Schweiß- und Darmsekretion ausgeschieden. Der menschliche Körper produziert pro Tag etwa 20 bis 30 Gramm Harnstoff.[29] Verschiedene Lebewesen verwenden Harnstoff als biogenes Gefrierschutzmittel. Haie und Rochen scheiden nicht allen Harnstoff aus, sondern nutzen ihn zur Osmoseregulation.[77]
Erkrankungen wie das akute oder chronische Nierenversagen, sowie eine diabetisch eingeschränkte Nierenfunktion, können zu erhöhten Harnstoffwerten im Serum/Plasma führen (Normalwert: 10–50 mg/dl). Bei (prä-)terminaler Niereninsuffizienz ist die Harnstoffkonzentration im Serum besser geeignet, den Schweregrad der Urämie abzuschätzen, als die Serumkreatininkonzentration.[78] Eine hohe Proteinzufuhr führt schon bei normaler Nierenfunktion zu erhöhten Harnstoffwerten im Blut, was ihn zu einem schlechten Nierenparameter macht.
Der Milchharnstoffgehalt ist der Gehalt von Harnstoff in Milligramm pro Liter Milch und ist ein wichtiger Maßstab für die optimale Eiweiß- und Energieversorgung der Kuh. Der Harnstoffgehalt der Milch wird durch die Fütterung mit Rohprotein je Tier und Tag, den Gehalt an Durchflussprotein und die im Pansen fermentierbaren Kohlenhydrate bestimmt und dient als Maß für die Verwertung des Futterrohproteins.[79] Eine relative Über- oder Unterversorgung mit Rohprotein deutet auf Managementfehler mit Gefahren für die Tiergesundheit hin.
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Harnstoff ist als praktisch nicht-toxisch anzusehen. In Fütterungsversuchen mit Ratten wurde bei einer Dosierung von 20 Gramm pro Kilogramm Körpergewicht sowie bei der Fütterung von Ferkeln mit bis zu 4 Gramm pro Kilogramm Körpergewicht über mehrere Tage keine Toxizität festgestellt. Es konnte kein Einfluss einer Harnstoffgabe auf die Entwicklung von Föten bei Ratten und Mäusen festgestellt werden.[80]
Die orale Gabe von hochdosierten Harnstofflösungen bei Hunden über mehrere Tage löste Schwäche, Appetitlosigkeit, Erbrechen und Würgen, Durchfall und eine verringerte Körpertemperatur aus, die zu einem Koma führten. Bei Versuchen mit Nacktmäusen, denen reiner Harnstoff auf die Haut aufgetragen wurde, konnten keine Veränderungen der Haut festgestellt werden. Harnstoff erhöht jedoch die Hautpenetration von anderen Stoffen.[80]
Nachweisverfahren
[Bearbeiten | Quelltext bearbeiten]Zum qualitativen Nachweis eignet sich die Fällung als Harnstoffnitrat. In essigsaurer Lösung lässt sich Harnstoff mit Xanthydrol in Dixanthylharnstoff überführen und ausfällen. Harnstoff kann mittels Urease enzymatisch in Kohlenstoffdioxid und Ammoniak gespalten werden. Diese Spaltung nutzt die Lebensmittelanalytik und Wasseranalytik durch den anschließenden quantitativen Nachweis von Ammoniak mittels des blaugefärbten Indophenol-Ions in der Berthelot-Reaktion.[81]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Dieter Fromm, Dietrich Lützow: Moderne Verfahren der Großchemie: Harnstoff. In: Chemie in unserer Zeit. 13. Jahrgang, Nr. 3, 1979, S. 78–81, doi:10.1002/ciuz.19790130303.
- Jozef Meessen: Urea. In: Ullmann’s Encyclopedia of Industrial Chemistry. Band 37, Wiley-VCH Verlag, Weinheim 2012, S. 657–695, doi:10.1002/14356007.a27_333.pub2.
- Jozef Meessen: Urea synthesis. In: Chemie Ingenieur Technik. 86. Jahrgang, Nr. 12, 2014, S. 2180–2189, doi:10.1002/cite.201400064. (Übersichtsartikel zur Geschichte, Thermodynamik und aktuellen Herstellverfahren).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Literatur von und über Harnstoff im Katalog der Deutschen Nationalbibliothek
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu UREA in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- ↑ Eintrag zu E 927b: Carbamide in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- ↑ a b Eintrag zu Harnstoff. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- ↑ a b c d e f Eintrag zu Harnstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ Walter Klöpffer: Verhalten und Abbau von Umweltchemikalien Physikalisch-chemische Grundlagen. John Wiley & Sons, 2013, ISBN 3-527-67212-5, S. 574 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Bordwell pKa-Table
- ↑ pKa Data, Compiled by R. Williams (PDF; 645 kB).
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Analytical Chemistry, S. 8-120.
- ↑ Eintrag zu Urea in der Hazardous Substances Data Bank (via PubChem), abgerufen am 23. April 2023.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- ↑ nicht zu verwechseln mit Harnsäure.
- ↑ Eintrag zu Schweiß. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. November 2019.
- ↑ Peter Shaw, Ephraim Chambers: A New Method of Chemistry. Band 2, J. Osborn and T. Longman, London 1727, (S. 193: Process LXXXVII. online).
- ↑ Louis Rosenfeld: William Prout: Early 19th Century Physician-Chemist. In: Clinical Chemistry. 49, 2003, S. 699–705, doi:10.1373/49.4.699.
- ↑ The results of the trials of various acids, and some other substances, in the treatment of the Lues Veneres etc. by William Cruickshank. In: John Rollo († 1809): An account of two cases of the diabetes mellitus … London 1797, Teil II, S. 141–225 (Digitalisat).
- ↑ William Coulson: On the diseases of the bladder and prostate gland. John Churchill, London 1857, S. 15 (Digitalisat).
- ↑ a b Peter Dilg: Harnstoffsynthese. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 535.
- ↑ William Prout: Observations on the Nature of some of the proximate Principles of the Urine; with a few remarks upon the means of preventing those diseases, connected with a morbid state of that fluid. In: Medico-chirurgical transactions. Band 8, 1817, S. 521–544, 596-7–596-9. PMID 20895332, PMC 2128986 (freier Volltext).
- ↑ Friedrich Wöhler: Ueber künstliche Bildung des Harnstoffs. In: Annalen der Physik und Chemie. 88, 1828, S. 253–256, doi:10.1002/andp.18280880206.
- ↑ Burchard Franck: 250 Jahre Chemie in Göttingen. In: Hans-Heinrich Voigt (Hrsg.): Naturwissenschaften in Göttingen. Eine Vortragsreihe. (Göttinger Universitätsschriften. Band 13). Vandenhoeck + Ruprecht, Göttingen 1988, ISBN 3-525-35843-1, S. 72. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ H. Kolbe, Dr. Wilm, Dr. Wischin, Mr. Irelan, Alexander Basaroff, Dr. Theilkuhl: XXV.—Chemical contributions. In: J. Chem. Soc. 21, 1868, S. 192–197, doi:10.1039/JS8682100192.
- ↑ a b Patent US1429483: Process of manufacturing urea. Veröffentlicht am 19. September 1922, Erfinder: Carl Bosch, Wilhelm Meiser.
- ↑ Eintrag zu Guano. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Mai 2012.
- ↑ Michael Fleischer: New Mineral Names. In: American Mineralogist. 59, 1974, S. 874–875.
- ↑ P. J. Bridge: Urea, a new mineral, and neotype phosphammite from Western Australia. In: Mineralogical Magazine 39, 1973, S. 346–348.
- ↑ Ceresana: Marktstudie Harnstoff, abgerufen am 17. Mai 2013.
- ↑ Food and Agriculture Organization of the United Nations: World fertilizer trends and outlook to 2018. Rome 2015, ISBN 978-92-5-108692-6, S. 16.
- ↑ a b c d e f g James A. Kent (Hrsg.): Riegel’s Handbook of Industrial Chemistry. Van Nostrand Reinhold, 1974, ISBN 0-442-24347-2, S. 104–111.
- ↑ a b c d e f g h i j Jozef Meessen: Urea. In: Ullmann’s Encyclopedia of Industrial Chemistry. Vol. 37, Wiley-VCH Verlag, Weinheim 2012, S. 657–695, doi:10.1002/14356007.a27_333.pub2.
- ↑ a b Jozef Meessen: Urea synthesis. In: Chemie Ingenieur Technik. 86, 2014, S. 2180–2189, doi:10.1002/cite.201400064.
- ↑ A. R. C. Haas, J. N. Brusca: Biuret, Toxic Form of Nitrogen. In: California Agriculture. 8, 1954, S. 11.
- ↑ Rudolf Gaedeke, Friedrich Wolf, Rita Otto: Zur Beeinflussung des Gefüges von Harnstoffprills durch Abkühlung von Schmelztropfen unter definierten Ausströmbedingungen Teil 1. In: Hercynia-Ökologie und Umwelt in Mitteleuropa. 20, 2014, S. 403–410.
- ↑ Patent US3025571: Process for producing prilled uea of low biuret content. Veröffentlicht am 20. März 1962, Erfinder: Jack E. Beecher, Robert J. Kallal u. a.
- ↑ Remington: The Science and Practice of Pharmacy. Verlag Lippincott Williams & Wilkins, 2006, ISBN 0-7817-4673-6, S. 1424.
- ↑ a b c d P. Vaughan, J. Donohue: The structure of urea. Interatomic distances and resonance in urea and related compounds. In: Acta Crystallographica. 5, 1952, S. 530–535, doi:10.1107/S0365110X52001477.
- ↑ a b mindat: Urea: Urea mineral information and data. Abgerufen am 13. Mai 2013.
- ↑ Anna Olejniczak, Kinga Ostrowska, Andrzej Katrusiak: H-Bond Breaking in High-Pressure Urea. In: The Journal of Physical Chemistry C. 113, 2009, S. 15761–15767, doi:10.1021/jp904942c.
- ↑ Kenneth D. M. Harris: Fundamental and Applied Aspects of Urea and Thiourea Inclusion Compounds. In: Supramolecular Chemistry. 19, 2007, S. 47–72, doi:10.1080/10610270600977706.
- ↑ M.J. Janssen: The structure of protonated amides and ureas and their thio analogues. In: Spectrochimica Acta. 17, 1961, S. 475, doi:10.1016/0371-1951(61)80102-1.
- ↑ Christian Nitschke, Günter Scherr: Urea Derivatives. In: Ullmann’s Encyclopedia of Industrial Chemistry. Vol. 38, Wiley-VCH Verlag, Weinheim 2010, S. 1–12, doi:10.1002/14356007.o27_o04.
- ↑ H. Heaney, F. Cardona, A. Goti, A. L. Frederick: Hydrogen Peroxide-Urea. e-EROS Encyclopedia of Reagents for Organic Synthesis, 2013, doi:10.1002/047084289X.rh047.pub3.
- ↑ Klaus Huthmacher, Dieter Most: Cyanuric Acid and Cyanuric Chloride. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005. doi:10.1002/14356007.a08_191
- ↑ Patent DE578486: Herstellung von Hydrazin. Veröffentlicht am 18. Oktober 1933, Erfinder: Egon Ihwe, Otto Seuffert.
- ↑ Mansel Davies, Leslie Hopkins: The bonding in urea and in the urea ion. In: Transactions of the Faraday Society. 53, 1957, S. 1563–1569, doi:10.1039/TF9575301563.
- ↑ Z. Piasek, T. Urbanski: The infra-red absorption spectrum and structure of urea. In: Bull. Pol. Acad. Sci-Tech. X, 1962, S. 113–120.
- ↑ Bernd Tieke: Makromolekulare Chemie: Eine Einführung. Verlag Wiley-VCH, 2014, ISBN 978-3-527-33216-8, S. 42–45.
- ↑ a b c Beschreibung unterschiedlicher Techniken und deren Entwicklungspotentiale zur Minderung von Stickstoffoxiden im Abgas von Abfallverbrennungsanlagen und Ersatzbrennstoff-Kraftwerken hinsichtlich Leistungsfähigkeit, Kosten und Energieverbrauch, Broschüre des Umweltbundesamts, 71. 2011 (online).
- ↑ Samuel L. Tisdale, Werner L. Nelson, James D. Beaton: Soil fertility and fertilizers. Macmillian, 1985, ISBN 0-02-420830-2, S. 161–168.
- ↑ K. L. Marsh, G. K. Sims, R. L. Mulvaney: Availability of urea to autotrophic ammonia-oxidizing bacteria as related to the fate of 14C- and 15N-labeled urea added to soil. In: Biology and Fertility of Soils. 42, 2005, S. 137, doi:10.1007/s00374-005-0004-2.
- ↑ Georg Fuchs: Allgemeine Mikrobiologie. George Thieme Verlag, 2014, ISBN 978-3-13-444609-8, S. 40.
- ↑ a b U.S. International Trade Commission: Ammonium Nitrate: A Comparative Analysis of Factors Affecting Global Trade. Investigation No. 332–393, October 1998, S. 2.
- ↑ a b Harnstoff monatlicher Preis - US-Dollar pro Tonne. IndexMundi, abgerufen am 8. Juli 2016.
- ↑ Urea, consumption (tonnes) – for all countries (online) (Seite nicht mehr abrufbar. Suche in Webarchiven).
- ↑ Hellmut Ruck: Handbuch für die medizinische Fußpflege. Karl F. Haug Verlag, 2012, ISBN 978-3-8304-7569-9, S. 121.
- ↑ G. Klemperer, E. Rost: Handbuch der Allgemeinen und Speziellen Arzneiverordnungslehre für Ärzte. Springer Verlag, 1929, S. 710. (Reprint: ISBN 978-3-642-52556-8)
- ↑ Robert T. Sataloff: Sataloffs Comprehensive Textbook of Otolaryngology. Jaypee Brothers, 2016, ISBN 978-93-5152-745-9, S. 412.
- ↑ Wolfgang F. Caspary, Manfred Kist, Jürgen Stein: Infektiologie des Gastrointestinaltraktes. Springer Medizin Verlag, 2006, ISBN 3-540-41359-6, S. 166.
- ↑ Adolf Baeyer: Untersuchungen über die Harnsäuregruppe. In: Annalen der Chemie und Pharmacie. 131, 1864, S. 291–302, doi:10.1002/jlac.18641310306.
- ↑ Hans G. Drobny, Martin Schulte, Harry J. Strek: 25 Jahre Sulfonylharnstoff-Herbizide – ein paar Gramm veränderten die Welt der chemischen Unkrautbekämpfung. In: Julius-Kühn-Archiv. Band 434, 2012, S. 21–33, doi:10.5073/jka.2012.434.002.
- ↑ Walter H. Hörl: Dialyseverfahren in Klinik und Praxis: Technik und Klinik. Thieme Verlag, 2003, ISBN 3-13-497706-0, S. 17.
- ↑ Lynda Anne Szczech, Edmund G. Lowrie, Zhensheng Li, Nancy L. Lew, J. Michael Lazarus, William F. Owen: Changing hemodialysis thresholds for optimal survival. In: Kidney International. 59, 2001, S. 738–745, doi:10.1046/j.1523-1755.2001.059002738.x.
- ↑ Robert Bosch GmbH: Kraftfahrtechnisches Taschenbuch. Springer Vieweg, 2014, ISBN 978-3-658-03800-7, S. 719.
- ↑ Robert Ebermann, Ibrahim Elmadfa: Lehrbuch der Lebensmittelchemie und Ernährung. Springer, 2008, ISBN 978-3-211-48649-8, S. 663.
- ↑ Katrin Mahlkow-Nerge: Futterharnstoff in Milchkuhrationen – Sorgfalt beim Einsatz ist wichtig. April 2013, archiviert vom am 30. Juli 2016; abgerufen am 7. Mai 2023.
- ↑ M. Holz, M. Mayele: Influence of Additives on Hydrophobic Association in Polynary Aqueous Mixtures. In: DFG Research Report. Thermodynamic Properties of Complex Fluid Mixtures. Wiley-VCH, 2004, ISBN 3-527-27770-6, S. 150–183.
- ↑ Ralf Quibeldey: Wikingers Weihnacht. In: Spiegel online. 25. Dezember 2004 (online).
- ↑ Chemikalien-Risikoreduktions-Verordnung, Anhang 2.7, Stand 1. Dezember 2022.
- ↑ F. Bengen, W. Schlenk: Über neuartige Additionsverbindungen des Harnstoffs. In: Experientia. 5, 1949, S. 200, doi:10.1007/BF02172488.
- ↑ Wilhelm Keim, Arno Behr, Günter Schmitt: Grundlagen der Industriellen Chemie. Technische Produkte und Prozesse. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2, S. 250.
- ↑ R. Rigamonti, V. Riccio: Trennung von Fettsäuren und Triglyceriden mit Hilfe der Harnstoff-Additionsverbindungen. In: Fette und Seifen. 54, 1952, S. 193, doi:10.1002/lipi.19520540402.
- ↑ Roger W. Floyd, Marie P. Stone, W.K. Joklik: Separation of single-stranded ribonucleic acids by acrylamide-agarose-urea gel electrophoresis. In: Analytical Biochemistry. 59, 1974, S. 599–609, doi:10.1016/0003-2697(74)90313-3.
- ↑ Marina Bährle-Rapp: Springer Lexikon Kosmetik und Körperpflege. Springer Verlag, 2013, ISBN 978-3-642-24687-6, S. 255.
- ↑ Jürgen Falbe, Manfred Regitz: Römpp Lexikon Chemie. Thieme Verlag, 1997, ISBN 3-13-734710-6, S. 1330.
- ↑ James E. Wright, Arthur Retnakaran: Chitin and Benzoylphenyl Ureas. Dr W. Junk Publishers, 1987, ISBN 94-010-8638-9, S. 101–110.
- ↑ J. Oliva u. a.: Urea treatment reduced Heterobasidion annosum s.l. root rot in Picea abies after 15 years. In: Forest Ecology and Management. 255.7, 2008, S. 2876–2882, doi:10.1016/j.foreco.2008.01.063.
- ↑ Wei Xu, Huimin Zhang, Gang Li, Zucheng Wu: Nickel-cobalt bimetallic anode catalysts for direct urea fuel cell. In: Scientific Reports. 4, 2014, S. 5863, doi:10.1038/srep05863.
- ↑ Neil Hazon, Alan Wells u. a.: Urea based osmoregulation and endocrine control in elasmobranch fish with special reference to euryhalinity. In: Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 136, 2003, S. 685–700, doi:10.1016/S1096-4959(03)00280-X.
- ↑ Ulrich Kuhlmann: Nephrologie: Pathophysiologie – Klinik – Nierenersatzverfahren. Georg Thieme Verlag, 2008, ISBN 978-3-13-700205-5, S. 563.
- ↑ R. Oltner, H. Wiktorsson: Urea concentrations in milk and blood as influenced by feeding varying amounts of protein and energy to dairy cows. In: Livestock Production Science. 10, 1983, S. 457–467, doi:10.1016/0301-6226(83)90073-8.
- ↑ a b Final report of the safety assessment of Urea. In: International journal of toxicology. Band 24, Suppl 3, 2005, S. 1–56. PMID 16422263.
- ↑ Martina Baumgartner, Martina Flöck, Petra Winter: Evaluation of flow injection analysis for determination of urea in sheep’s and cow’s milk. In: Acta Veterinaria Hungarica. 50, 2002, S. 263, doi:10.1556/AVet.50.2002.3.2.



![{\displaystyle {\ce {2NH_3 + CO2 -> [H2NCOO]NH4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/064180d2da392465a849de890745ec6f33f85852)
![{\displaystyle {\ce {[H2NCOO]NH4 <=> H2NCONH2 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3e33168def5964a52242ceb4fd51bafcf34fecc5)