Chromosom
| Übergeordnet |
|---|
| Zellkern Karyoplasma |
| Untergeordnet |
| Zentromer Telomer Nukleosom Gene Replikationsgabel Provirus Chromatin Proteinkomplexe |
| Gene Ontology |
| QuickGO |



Unten: Falschfarben-Darstellung aller Chromosomenterritorien, die in dieser Fokusebene sichtbar sind, nach Computer-Klassifikation.
Ein Chromosom (von altgriechisch χρῶμα chrōma ‚Farbe‘ sowie σῶμα sōma ‚Leib‘)[1][2] ist ein Träger von Erbanlagen (des Genoms). Chromosomen bestehen aus Desoxyribonukleinsäure (englische Abkürzung: DNA) und verschiedenen Proteinen, insbesondere Histonen. Die DNA enthält genetische Informationen für die Lebensprozesse und die Vererbung von Eigenschaften.
Die Chromosomen eukaryotischer Lebewesen sind in Zellkernen eingeschlossen. Sie sind in der Metaphase einzeln zu erkennen, denn in diesem Stadium des Zellzyklus liegen sie stark verdichtet vor, während die Kernhülle vorübergehend aufgelöst ist. Die Interphase hindurch sind sie dagegen aufgelockert und werden insgesamt als Chromatin bezeichnet. Ein Zellkern enthält jeweils eine arttypische Zahl an Chromosomen, beim Menschen sind es gewöhnlich 46 im diploiden Karyotyp (2n = 46,XX bzw. 46,XY).
Die Zellen der Eukaryoten – zu denen Pflanzen, Pilze, Tiere und so auch Menschen gehören – enthalten außer der chromosomalen DNA im Zellkern zusätzlich DNA in bestimmten Organellen wie Mitochondrien oder Plastiden (siehe mitochondriale DNA und Chloroplasten-DNA), die zirkulär vorliegt.
Zellen von Prokaryoten wie Bakterien haben keinen Zellkern und keine klassischen Chromosomen. Die DNA von Bakterien ist allgemein zirkulär organisiert und wird auch als Bakterienchromosom bezeichnet.[3]
Darstellung im Mikroskop
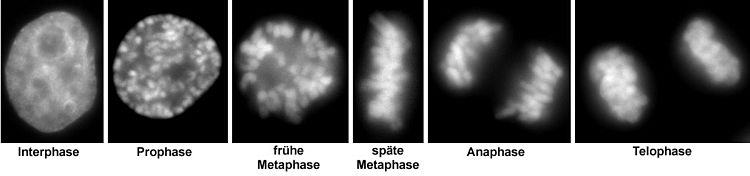
[Bearbeiten | Quelltext bearbeiten]Die Bezeichnung Chromosom, wörtlich „Farbkörper“, rührt daher, dass die Chromatinstruktur durch basische Farbstoffe leicht anzufärben ist. Die angefärbten Chromosomen sind lichtmikroskopisch ohne spezielle Nachweismethoden nur während der Teilung des Zellkerns zu erkennen. Dann haben sie beim Menschen und vielen anderen Arten ein stäbchenförmiges Aussehen. Diese verdichtete (kondensierte) Form bildet sich zu Beginn einer Kernteilung bei Mitose wie Meiose während der frühen Prophase heraus. In der anschließenden Metaphase werden die stark kondensierten Chromosomen äquatorial angeordnet. Jedes Chromosom besteht in dieser Phase aus zwei gleichen Chromatiden, die durch Replikation entstanden sind. Die Chromatiden liegen parallel nebeneinander und enthalten je eine durchgehende DNA-Doppelhelix. In der Anaphase werden die beiden Chromatiden eines Chromosoms voneinander getrennt und schließlich über die Telophase den sich bildenden Tochterkernen zugeteilt.
Am Ende der Kernteilungen gehen die Chromosomen wieder in einen dekondensierten Zustand über. Erst in dieser Form kann die DNA abgelesen und dann dupliziert werden. Doch lassen sich so die verschiedenen Chromosomen eines Kerns mit klassischen Färbemethoden nicht mehr unterscheiden, da sie ein scheinbar kontinuierliches Chromatin bilden. Mit besonderen Methoden jedoch, wie der Fluoreszenz-in-situ-Hybridisierung, sind die Chromosomen weiterhin als getrennte Einheiten nachweisbar. Jedes der dekondensierten Chromosomen beansprucht in der Interphase ein Chromosomenterritorium: einen abgegrenzten Bereich innerhalb des Zellkerns.
Forschungsgeschichte
[Bearbeiten | Quelltext bearbeiten]Der Name „Chromosomen“ für die Träger der Erbmasse wurde 1888 von dem Anatomen Heinrich Wilhelm Waldeyer[4] vorgeschlagen, nachdem Walther Flemming einige Jahre zuvor den Begriff Chromatin für die färbbare Substanz im Zellkern eingeführt hatte. Noch 1906 nutzte Oscar Hertwig parallel dazu den Begriff Kernsegmente, welcher verdeutlichen sollte, dass bei der Teilung des Kerns (Mitose) „das Chromatin in Segmente zerlegt wird“. Eine weitere alte Bezeichnung, die ebenfalls eine Weile parallel zu Chromosom benutzt wurde, ist Kernschleife, zum Beispiel bei Karl Heider (1906).
Die Geschichte der Entdeckung der Chromosomen und ihrer Funktion lässt sich nicht von der vorangegangenen Entdeckung des Zellkerns trennen.
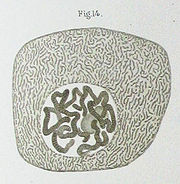
1842 beschrieb der Schweizer Botaniker Carl Wilhelm von Nägeli „transitorische Zytoblasten“ (anfärbbare stäbchenförmige Strukturen im Zellkern von Pflanzenzellen)[5] bei denen es sich vermutlich um Chromosomen handelte. Auch Abbildungen aus den Werken anderer Forscher lassen sich mit heutigem Wissen als Chromosomen bzw. mitotische Zellteilung deuten (Matthias Schleiden 1846, Rudolf Virchow 1857, Otto Bütschli 1873).

1873 beschrieb Anton Schneider an Plattwürmern, dass der Zellkern sich „in einen Haufen feinlockig gekrümmter, auf Zusatz von Essigsäure sichtbar werdender Fäden verwandelt. An Stelle dieser dünnen Fäden traten endlich dicke Stränge auf, zuerst unregelmäßig, dann zu einer Rosette angeordnet, welche in einer durch den Mittelpunkt der Kugel gehenden Ebene (Äquatorialebene) liegt.“ Die „indirekte Kernteilung“ (Mitose) war entdeckt – aber noch nicht verstanden. So ging Walther Flemming 1882 noch davon aus, dass sich die „Kernfäden“ erst während der frühen Phase der Kernteilung aus einem zuvor durchgehenden Faden voneinander trennen. Zwar beobachtete er eine Längsspaltung der Chromosomen zu einem späteren Zeitpunkt (heute als Metaphase bezeichnet), nahm aber an, dass sich ganze Chromosomen (also mit beiden Chromatiden) später (heute: Anaphase) in Richtung der künftigen Zellkerne bewegen. Auch schloss er nicht aus, dass sich Zellkerne zumindest in manchen Fällen auch neu bilden könnten, also nicht durch Teilung aus bestehenden Kernen. 1884 beschrieben dann mehrere Autoren (L. Guignard, Emil Heuser und Edouard van Beneden) die Aufteilung der Chromosomenhälften (heute: Chromatiden) auf die Tochterzellkerne.
Da die Chromosomen während der Interphase nicht sichtbar waren, war zunächst unklar, ob sie sich nach einer Kernteilung auflösen und vor jeder Kernteilung neu bilden oder ob sie im Kern als jeweils eigene Einheiten überdauern. Letztere Idee wurde als Lehre von der Erhaltung der Individualität der Chromosomen bezeichnet und von Carl Rabl vorgeschlagen (1885). Er war auch der erste, der erstens eine konstante Zahl von Chromosomen bei verschiedenen Mitosen eines Gewebes feststellte und zweitens daraus schloss, dass die Chromosomen auch in der Interphase und somit kontinuierlich vorhanden sein müssten. Er ließ aber zunächst noch die Möglichkeit offen, dass diese Zahl in verschiedenen Geweben unterschiedlich sein könnte. Rabl war ebenfalls der erste, der annahm, dass jedes Chromosom im Interphasekern ein eigenes Territorium bildet.
Die Idee der Chromosomenkontinuität fand keineswegs ungeteilte Zustimmung. Ein wichtiger Gegner war Oscar Hertwig (1890, 1917). Theodor Boveri, der um 1890 Chromosomenstudien[6] durchführte, dagegen befürwortete Rabls Ideen und unterstützte sie mit weiteren experimentellen Befunden (1904, 1909). Ebenfalls in den 1880er Jahren entwickelte August Weismann seine Keimplasmatheorie (siehe auch dort), bei der er davon ausging, dass das Erbmaterial (nur) in den Chromosomen lokalisiert sei. Wichtige Schlussfolgerungen waren, dass Vererbung ausschließlich über die Keimbahn stattfinde und dass eine Vererbung erworbener Eigenschaften abzulehnen sei. Was sich später als weitgehend richtig erwies, war damals heftig umstritten. Eine schonungslose Kritik findet sich beispielsweise in Meyers Konversations-Lexikon von 1888 unter dem Stichwort Erblichkeit.[7]
Im Jahr 1900 wurden die Mendelschen Regeln wiederentdeckt und bestätigt. In der Folge entwickelte sich die neue Wissenschaft der Genetik, in deren Rahmen der Zusammenhang von Chromosomen und Vererbung vielfach gezeigt wurde. Beispielsweise konnte Thomas Hunt Morgan 1910 an Drosophila melanogaster den Nachweis führen, dass die Chromosomen die Träger der Gene sind. 1944 zeigte Oswald Avery (siehe dort), dass das eigentliche Erbmolekül die DNA ist, und nicht etwa Proteine in den Chromosomen.
Die weitere Geschichte bis 1950 (Aufklärung der Struktur der DNA) ist im Artikel Chromosomentheorie der Vererbung beschrieben. Eine Zeittafel einiger wichtiger Entdeckungen ist im Artikel Chromatin zu finden.
Im Jahr 2000 haben zwei internationale Wissenschaftlerteams das menschliche Erbgut weitgehend entziffert, im Jahr 2003 waren 99 Prozent sequenziert. Mit dem Chromosom 1 wurde 2005/2006 das letzte der 24 verschiedenen menschlichen Chromosomen genau analysiert (99,99 %). Über 160 Wissenschaftler aus Großbritannien und den USA publizierten diese Gemeinschaftsarbeit.[8]
2014 gelang erstmals das Design und die Konstruktion eines synthetischen Chromosoms, und zwar in der Bäckerhefe Saccharomyces cerevisiae.[9][10]
Aufbau und Struktur der Chromosomen
[Bearbeiten | Quelltext bearbeiten]Bestandteile
[Bearbeiten | Quelltext bearbeiten]
1 Eines der beiden Chromatiden
2 Centromer, die Stelle, an dem die beiden Chromatiden zusammenhängen. Hier setzen in der Mitose die Mikrotubuli an.
3 Kurzer Arm (p-Arm)
4 Langer Arm (q-Arm)

Abgesehen von Spezialfällen (siehe Riesenchromosomen unten) enthält ein Chromosom im einfachen Fall einen durchgehenden DNA-Doppelstrang (auch: DNA-Doppelhelix). Der DNA-Doppelstrang wird manchmal auch als DNA-Molekül bezeichnet, obwohl es sich streng genommen um zwei Einzelstrang-Moleküle handelt (siehe Desoxyribonukleinsäure). An den DNA-Doppelstrang lagern sich Histone und andere Proteine an (siehe unten). Die Mischung aus DNA, Histonen und anderen Proteinen wird als Chromatin bezeichnet. Aus einem DNA-Doppelstrang wird durch diese Protein-Anlagerung ein Chromatid aufgebaut. In diesem Fall besteht das Chromosom also aus einem Chromatid. Der beschriebene Fall tritt immer direkt nach einer Kernteilung auf; bei den meisten Tieren und Pflanzen zusätzlich in allen Zellen, die sich nicht mehr teilen können (Ausnahme: Polytänchromosomen bei Insekten, siehe auch unten), und in Zellen, die zeitweilig nicht mehr wachsen, sich also in der G0-Phase befinden (siehe Zellzyklus).
Wenn eine Zelle wächst, um sich später zu teilen, dann muss in einem bestimmten Abschnitt des Zellzyklus (S-Phase) die DNA verdoppelt („repliziert“) werden. Dies ist erforderlich, damit später beide Tochterkerne das ganze Erbgut, also je eine Kopie aller Chromosomen, erhalten können. Nach der DNA-Verdopplung hat jedes Chromosom zwei identische DNA-Doppelstränge. Diese beiden Doppelstränge werden räumlich getrennt voneinander mit Proteinen verpackt: Zwei Schwester-Chromatiden entstehen. Während der Kernteilung (Mitose) werden die beiden Schwester-Chromatiden eines Chromosoms als zwar parallel verlaufende, aber durch eine schmale Lücke getrennte Einheiten mikroskopisch sichtbar (siehe Schemazeichnung rechts und erste Abbildung des Artikels). An einer Stelle, die Centromer oder Zentromer genannt wird, ist jedes Chromosom zu diesem Zeitpunkt schmaler als im sonstigen Verlauf: Hier hängen die Schwester-Chromatiden noch zusammen. Im weiteren Verlauf der Mitose (am Übergang von der Metaphase zur Anaphase, siehe unten) werden die beiden Schwester-Chromatiden getrennt – wobei durch die Trennung zwei Tochterchromosomen entstehen – und auf die neu entstehenden Zellkerne verteilt: Die Chromosomen in diesen neuen Kernen bestehen jetzt wieder aus einem Chromatid. Demnach enthält ein Chromatid immer genau einen DNA-Doppelstrang, während ein Chromosom je nach Phase des Zellzyklus ein oder zwei DNA-Doppelstränge enthält und entsprechend aus einem oder zwei Chromatiden besteht (Ausnahme: die erwähnten Polytänchromosomen, die über tausend Doppelstränge enthalten können).
Durch das Centromer werden die Chromatiden in zwei Arme unterteilt. Je nach Lage des Centromers spricht man von metazentrischen Chromosomen (Centromer in der Mitte), akrozentrischen Chromosomen (Centromer am Ende, der kürzere Arm sehr klein; beim Menschen die Chromosomen 13, 14, 15, 21, 22 und das Y-Chromosom) oder submetazentrischen Chromosomen (Centromer zwischen Mitte und Ende). Der kürzere Arm wird als p-Arm (französisch petit ‚klein‘), der längere als q-Arm bezeichnet (q folgt im lateinischen Alphabet auf p). Wie in der Schemazeichnung werden Chromosomen generell mit den kurzen Armen nach oben dargestellt.
Die Enden der Chromosomen heißen Telomere (Einzahl: Telomer). Sie enthalten eine kurze, sich identisch wiederholende DNA-Sequenz (beim Menschen TTAGGG). Dort werden die Chromosomen bei jeder Verdopplung ein wenig kürzer. Die Telomere spielen daher bei Alterungsprozessen eine wichtige Rolle. Neben Centromer und Telomeren sind Startpunkte für die DNA-Verdopplung (Replikation) der dritte essentielle Bestandteil eines Chromosoms (siehe ARS-Element).
Beim Menschen enthalten die kurzen Arme der akrozentrischen Chromosomen Gene für die ribosomale RNA. Diese kurzen Arme können in kondensierten Metaphasechromosomen durch einen Satelliten verlängert sein, so dass Satellitenchromosomen (SAT-Chromosomen) vorliegen (nicht zu verwechseln mit Satelliten-DNA). Die Gene für die ribosomale RNA liegen in vielen, tandemartig hintereinanderliegenden Kopien vor. Im Interphase-Zellkern bildet sich an diesen der Nucleolus. Daher werden sie auch als Nucleolus-organisierende Regionen (NOR) bezeichnet.
Chromosomen während der normalen Kernteilung (Mitose)
[Bearbeiten | Quelltext bearbeiten]Im Folgenden sind die Phasen während der Mitose kurz wiedergegeben:
- Prophase: In diesem ersten Stadium der Mitose kondensieren die Chromosomen zunehmend. Sie werden so von einer zugänglichen Quelle genetischer Information zu einer nicht mehr ablesbaren, kompakten Transportform. Die Kernmembran wird aufgelöst. Dies wird manchmal als der Beginn einer zusätzlichen Phase, der Prometaphase, gesehen.
- Metaphase: Die Chromosomen wandern in die Äquatorialebene der Zelle und bilden dort die Metaphaseplatte. Bis zu diesem Zeitpunkt besteht jedes Chromosom aus zwei Chromatiden. Centriolen befinden sich an den entgegengesetzten Polen der Zelle, die Plasmafasern haben den Spindelapparat gebildet.
- Anaphase: Der Spindelapparat sorgt für die Trennung der beiden Chromatiden jedes Chromosoms und ihren Transport senkrecht weg von der Metaphaseplatte, zu zwei entgegengesetzten Zellpolen. Dazu werden Mikrotubuli sowohl an den Kinetochoren der Centromere als auch an den Zellpolen befestigt, die wie Streckseile wirken.
- Telophase: Nach Abschluss der Anaphasebewegung wird um jedes vereinzelte Chromosom eine neue Kernhülle gebildet und mit der Dekondensation begonnen. Durch Fusion der Partikel entstehen die beiden Tochterzellkerne, die nun Ein-Chromatid-Chromosomen enthalten.
Nach der Kernteilung erfolgt in der Regel auch die Zellteilung, die Cytokinese oder Zytokinese, die aber nicht mehr zur Mitose gerechnet wird.
G-, R- und andere Chromosomenbanden
[Bearbeiten | Quelltext bearbeiten]In der Mitte des 20. Jahrhunderts wurden Techniken entwickelt, um die Chromosomen aus Zellen, die sich in der Metaphase befinden, zu „spreiten“: Im entstandenen Metaphasepräparat liegen die Chromosomen einer Zelle nebeneinander auf einem Objektträger, so dass sie im Mikroskop abgezählt und miteinander verglichen werden können (siehe erste Abbildung oben). In gut gelungenen Präparaten haben die einzelnen Chromosomen dabei die häufig dargestellte X-ähnliche Form. Mit den klassischen Färbemethoden wie zum Beispiel Giemsa-Färbung werden Chromosomen auf ganzer Länge gleichmäßig eingefärbt. Daher war es zunächst nicht oder nur schwer möglich, Chromosomen ähnlicher Größe sicher voneinander zu unterscheiden. Um 1970 wurde entdeckt, dass einige Bereiche der Chromosomen den Giemsa-Farbstoff nicht mehr annehmen, wenn die Chromosomen zuvor mit Trypsin behandelt wurden. Durch die hervorgerufene G-Bänderung entstanden entlang der Chromosomen abwechselnd gefärbte Abschnitte (die G-Banden, G für Giemsa) und ungefärbte (die R-Banden, R für revers). Durch das Bandenmuster ist beim Menschen und etlichen Tieren eine eindeutige Identifizierung aller Chromosomen möglich. Die stoffliche Grundlage für das unterschiedliche Färbeverhalten der Banden, also die Frage, warum einige Bereiche nach der Trypsinbehandlung den Farbstoff nicht mehr aufnehmen, ist bis heute ungeklärt. Es stellte sich jedoch heraus, dass G- und R-Banden sich in einigen Eigenschaften unterscheiden.

R-Banden enthalten überdurchschnittlich viele Gene, überdurchschnittlich viele G-C-Basenpaarungen und werden während der Replikation der Chromosomen früh verdoppelt. Beim Menschen sind sie reich an Alu-Sequenzen (siehe dort und Abbildung rechts).
G-Banden sind genarm, die Anzahl der G-C-Basenpaare liegt unter dem Durchschnitt (dafür haben sie mehr A-T-Paare; siehe Desoxyribonucleinsäure) und sie werden während der Duplizierung der Chromosomen eher spät repliziert. Beim Menschen sind sie reich an L1-Elementen (siehe Long interspersed nuclear element).
Als weitere Bandentypen werden manchmal C-Banden (die Centromerregionen) und T-Banden unterschieden. Letztere sind eine Untergruppe der R-Banden, besonders genreich und liegen häufig in der Nähe der Telomere, daher der Name.
Die Anzahl der R- und G-Banden ist abhängig vom Kondensationsgrad der Chromosomen. In der Metaphase haben alle menschlichen Chromosomen zusammen etwa 400 dieser Banden, während in den noch nicht so stark kondensierten Prophasechromosomen bis zu 850 Banden unterschieden werden können.
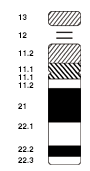
Nomenklatur: Um eine genaue Bezeichnung aller chromosomalen Regionen zu ermöglichen, wurden für den Menschen und einige andere Organismen standardisierte Bezeichnungssysteme eingeführt. Beim Menschen hat jede Bande eine Bezeichnung, die sich aus folgenden Elementen zusammensetzt: Nummer des Chromosoms, p oder q für den jeweiligen Arm (p wie franz. petite für den kurzen Arm; q wie franz. queue für den langen[11]) sowie Zahlen, die vom Centromer aus aufwärts zählen. Zur feineren Unterscheidung können die Zahlen mehrere Stellen haben. Die Bande 3q26.31 ist demnach eine Unterbande von 3q26. Die Bezeichnung „3q“ steht entsprechend für den gesamten langen Arm des Chromosoms 3. Centromerregionen werden auch mit c bezeichnet (3c). Telomerbereiche werden der Einfachheit halber gerne mit tel (etwa 3ptel oder 3qtel) und telomernahe Bereiche mit ter (3pter) bezeichnet. Schematische Darstellungen der Standardbanden heißen Idiogramme. Beispiele sind in der Abbildung rechts und auf der Website von Ensembl[12] zu sehen. In Idiogrammen sind G-Banden stets dunkel, R-Banden weiß eingezeichnet. Bereiche aus repetitiven Elementen werden manchmal schraffiert dargestellt. Eine sortierte Anordnung aller mitotischen Chromosomen aus einer Zelle wird als Karyogramm bezeichnet (Abbildung weiter unten). Der Karyotyp eines Lebewesens gibt an, wie viele und gegebenenfalls welche Chromosomen dieses Individuum hat. Der Karyotyp einer Frau wird als 46,XX angegeben, der eines Mannes als 46,XY (siehe unten, Geschlechtsbestimmung).
Größe und Gen-Dichte
[Bearbeiten | Quelltext bearbeiten]
Das menschliche Genom, also die Gesamtlänge der DNA, umfasst etwa 3,2 Gbp (= Gigabasenpaare oder Milliarden Basenpaare) mit bisher gefundenen 23.700 Genen.[12] Menschen haben zwei Kopien des Genoms (2n), eine von der Mutter und eine vom Vater, die in jedem Zellkern vorliegen. Aus dem Molekularmodell der DNA ergibt sich für 10 Basenpaare in der Doppelhelix eine Länge von 3,4 Nanometern (milliardstel Metern). Daraus lässt sich hochrechnen, dass die Gesamtlänge der DNA in jeder menschlichen Zelle über 2 Meter beträgt. Diese sind beim Menschen auf 2n = 46 Chromosomen verteilt, so dass ein Chromosom durchschnittlich etwa 140 Mbp (= Megabasenpaare oder Millionen Basenpaare) und damit einen DNA-Faden von knapp 5 cm Länge mit etwas über 1000 Genen enthält. Chromosomen während der Kernteilung haben jedoch nur eine Länge von einigen Mikrometern (millionstel Metern). Sie sind demnach um einen Faktor von etwa 10000 verkürzt oder „kondensiert“. Auch im Interphasekern sind Chromosomen kaum länger. Die hier vorhandenen Chromosomenterritorien entstehen im Wesentlichen durch Dekondensation der Tochterchromatiden in die Breite. Während ein Tochterchromatid in der Metaphase einen Durchmesser von etwa 0,6 Mikrometern hat, kann ein Chromosomenterritorium einen Umfang einnehmen, der etwa seiner Länge entspricht. Chromosomenterritorien können jedoch sehr unregelmäßige Formen haben. Aus den angegebenen Zahlenwerten wird deutlich, dass Chromosomen auch während der Interphase stark kompaktiert, also aufgefaltet, sein müssen (siehe nächster Abschnitt).
Chromosom 1 als größtes menschliches Chromosom hat 249 Mbp, das kürzeste Chromosom 21 hat weniger als ein Fünftel davon, nämlich 47 Mbp. Die Gene sind zwischen den Chromosomen ungleichmäßig verteilt. Das relativ genreichste Chromosom 19 enthält auf 59 Mbp etwa 1500 kodierende Gene, während das genarme Chromosom 18 auf 80 Mbp nur etwa 640 enthält (siehe auch Abbildung „Genreiche und genarme Regionen“ oben). Am genärmsten ist jedoch das Y-Chromosom, das auf 57 Mbp nur 72 kodierende Gene enthält. (Stand der Angaben zu Größen und Gendichten in diesem Absatz: Dezember 2015)[12]
Bei der Hausmaus (Mus musculus) sind die Unterschiede zwischen den Chromosomen kleiner. Das 3,5 Gbp große Genom mit 22.600 beschriebenen Genen ist verteilt auf 20 verschiedene Chromosomen (2n=40) mit 61 Mbp (Chromosom 19) bis 195 Mbp (Chromosom 1).[13]
Die Länge der einzelnen Chromosomen bei anderen Säugern schwankt stark, in Abhängigkeit von der Anzahl. Einige haben wenige, große Chromosomen (z. B. der indische Muntjak, Muntjak muntjacus: 2n=6 beim Weibchen und 2n=7 beim Männchen; dem X-Chromosom entsprechen hier also zwei Y-Chromosomen), andere haben viele kleine (z. B. Nashorn, Diceros bicornis: 2n=84). Die genauen Längen (in Basenpaaren) sind jedoch erst bei einer kleinen Anzahl von Tieren bekannt.
Bei Eidechsen und Vögeln treten Chromosomen von extrem unterschiedlicher Größe auf (siehe Abbildung). Die Makrochromosomen ähneln dabei von der Größe her Säugerchromosomen. Das Chromosom 1 des Huhns (Gallus gallus) enthält beispielsweise 188 Mbp. Daneben gibt es aber auch viele Mikrochromosomen, deren Größe 1 Mbp noch unterschreiten kann.[14] Der Übergang von Makro- zu Mikrochromosomen ist oft fließend, so dass die Abgrenzung beider Gruppen voneinander zum Teil unterschiedlich vorgenommen wird. Beim Huhn können die Makrochromosomen z. B. die Chromosomen 1–8 oder 1–10 umfassen. Für einen bildlichen Größenvergleich siehe Ensembl.[14] Von dort sind auch die Größen in Mbp übernommen. Die Begriffe Makro- und Mikrochromosomen wurden von Theophilus S. Painter 1921 eingeführt, der die Spermatogenese in Eidechsen untersuchte.[15]
Auch bei anderen Chordatieren wurden Mikrochromosomen nachgewiesen, etwa beim Lanzettfischchen (Branchiostoma, veraltet Amphioxus) und bei der Streifenköpfigen Bartagame (Pogona vitticeps), nicht aber bei den Theria (Beuteltiere und Plazentalier inkl. Mensch).[16]
Molekularer Aufbau und Hierarchie der Verpackungsebenen
[Bearbeiten | Quelltext bearbeiten] 1 DNA-Doppelhelix 2 10-nm-Fiber (DNA mit Nukleosomen) 3 Schematisierter Chromatinstrang während der Interphase vor der DNA-Verdopplung mit Centromer 4 Kondensiertes Chromatin während der Prophase (nun aus zwei Chromatiden bestehend, weil sich die DNA verdoppelt hat) 5 Metaphasechromosom Die Teilabbildungen 3 bis 5 sind rein schematisch zu verstehen, um die Anzahl der Chromatiden während verschiedener Phasen des Zellzyklus wiederzugeben. Die Anordnung des „Chromatinfadens“ gibt nicht die tatsächliche Struktur wieder. |
 |
Im vorherigen Abschnitt wird dargelegt, dass die DNA sowohl während der Kernteilung als auch in der Interphase sehr stark aufgewickelt oder „kondensiert“ sein muss. Es ist jedoch noch weitgehend unklar, wie diese Verpackung organisiert ist. Eine wichtige Rolle spielen basische Strukturproteine, die Histone. DNA, Histone und weitere Proteine machen jeweils etwa ein Drittel der chromosomalen Masse aus. Diese wird auch als Chromatin bezeichnet. Die Verwendung des Begriffs Chromatin ist besonders für Beschreibungen des Zellkerns in der Interphase üblich, da hier einzelne Chromosomen nicht ohne spezielle Anfärbung (Fluoreszenz-in-situ-Hybridisierung) voneinander unterschieden werden können.
Auf der untersten Verpackungsebene ist der DNA-Faden in Nucleosomen aufgewickelt, welche acht Histonenmoleküle enthalten (siehe Abb., Unterabbildung 2). Nucleosomen haben einen Durchmesser von etwa 10 Nanometern (nm), daher spricht man hier auch von der 10-nm-Fiber. Deren Struktur wird oft mit einer Perlenkette verglichen, bei der der Faden allerdings um die Perlen herumgewickelt ist. In einem Nucleosom sind 146 Basenpaare der DNA aufgewickelt, hinzu kommt Linker-DNA zwischen den Nucleosomen. Die 10-nm-Fiber lässt sich im Elektronenmikroskop nachweisen, ebenso wie die nächsthöhere Verpackungsebene, die 30-nm-Fiber. Die interne Struktur der 30-nm-Fiber, also wie diese durch Auffalten aus der 10-nm-Fiber zusammengesetzt ist, ist jedoch ebenso unklar wie alle höheren Verpackungsebenen. Für letztere werden verschiedene Modelle diskutiert. Im Loop-Modell (von englisch loop ‚Schlaufe‘) wird angenommen, dass die 30-nm-Fiber in großen Schlaufen verläuft, die an einer Art Rückgrat befestigt sind. Im Chromonema-Modell wird dagegen angenommen, dass sich die 30-nm-Fiber durch weiteres Auffalten verdickt und so Abschnitte von 120 nm und dicker entstehen.[17] Wie die strukturelle Veränderung vom Interphasezustand zum Prophasechromosom vor sich geht, ist ebenfalls unklar. Beim Übergang der Prophasechromosomen zu den noch stärker kondensierten Metaphasechromosomen scheint Einigkeit darin zu bestehen, dass es sich hier um ein spiralförmiges Aufwickeln handelt.
Die Kondensation der Chromosomen bzw. des Chromatins ist innerhalb des Zellkerns nicht gleichmäßig. Manche Bereiche des Kerns werden durch DNA-Farbstoffe besonders stark gefärbt. Hier ist die Kondensation also besonders stark. Diese Bereiche werden als Heterochromatin bezeichnet, weniger stark gefärbte dagegen als Euchromatin. In den stärker kondensierten Bereichen ist die Genaktivität behindert bis blockiert, siehe Epigenetik.
Riesenchromosomen
[Bearbeiten | Quelltext bearbeiten]Es sind zwei Arten von Riesenchromosomen bekannt, Polytänchromosomen und Lampenbürstenchromosomen.
Polytänchromosomen
[Bearbeiten | Quelltext bearbeiten]Eine Besonderheit bezüglich des inneren chromosomalen Aufbaus stellen die Polytänchromosmen dar. Sie sind aus verschiedenen Insekten bekannt und besonders gut in der Fruchtfliege Drosophila melanogaster und in Zuckmücken Chironomus untersucht. Sie entstehen durch mehrere Runden von Verdopplung der DNA ohne anschließende Kernteilung (Endoreduplikation). Im Gegensatz zur „normalen“ Polyploidie sind in Polytänchromosomen die vielfach replizierten DNA-Fäden von beiden homologen Chromosomen (also der vom Vater und der von der Mutter vererbten Kopie) parallel angeordnet, ähnlich einem Kabelstrang. Alle Kopien eines Gens liegen daher nebeneinander.
Lampenbürstenchromosomen
[Bearbeiten | Quelltext bearbeiten]Eine andere Form von sehr großen Chromosomen kommt in den Eizellen von Amphibien vor. Da sie vom mikroskopischen Bild her einer Flaschen- oder Lampenbürste ähneln, wurden sie Lampenbürstenchromosomen genannt.
 |
Polytänchromosomen in einer Speicheldrüsenzelle von Chironomus. Walther Flemming, 1882. |  |
„Chromatischer Faden, welcher einer Flaschenbürste vergleichbar ist“ (nach heutiger Terminologie ein Lampenbürstenchromosom) aus dem Kern einer Eizelle des Wassersalamanders (Triton). (Gesamte Tafel.) Oscar Hertwig, 1906. |
Geschlechtsbestimmung durch Chromosomen und ihre Folgen
[Bearbeiten | Quelltext bearbeiten]Während bei manchen Lebewesen die Geschlechtsbestimmung durch Umweltbedingungen wie die Temperatur während der Embryonalentwicklung erfolgt, wird das Geschlecht bei anderen durch die geerbten Chromosomen bestimmt: Sie haben ein chromosomales Geschlecht. Verschiedene Tiergruppen haben unterschiedliche Methoden der chromosomalen Geschlechtsbestimmung hervorgebracht, teilweise sind ähnliche Systeme unabhängig voneinander entwickelt worden.[18] Bei den meisten Säugern und einigen anderen Tiergruppen haben Weibchen zwei X-Chromosomen, während Männchen ein X- und ein Y-Chromosom haben. Wenn wie im Säugermännchen zwei verschiedene Geschlechtschromosomen vorliegen, spricht man von Hemizygotie. Bei Vögeln haben Männchen zwei Z-Chromosomen, Weibchen sind mit einem Z- und einem W-Chromosom das hemizygote Geschlecht. Bei vielen Insekten aus der Gruppe der Hautflügler sind Weibchen diploid, die Männchen aber nur haploid.
Im hemizygoten Geschlecht liegen etliche Gene nur auf einem Chromosom vor. Bei einem Gendefekt kann dieser daher nicht durch ein intaktes Gen auf einem homologen Chromosom aufgefangen werden. Daher gibt es beim Menschen eine Reihe von Erbkrankheiten, die praktisch nur bei Männern auftreten. Die bekanntesten Beispiele sind eine Form der Bluterkrankheit, die Duchenne’sche Muskeldystrophie und die Rot-Grün-Blindheit.
Bei chromosomaler Geschlechtsbestimmung liegt in einem der Geschlechter ein Chromosom zweimal vor, das beim anderen nur einmal da ist. Um zu verhindern, dass hier auch doppelt so viel Genprodukt wie im anderen Geschlecht erzeugt wird, haben verschiedene Tiergruppen verschiedene Strategien zur „Dosiskompensation“ entwickelt (siehe Geschlechtschromosom, X-Inaktivierung und Geschlechts-Chromatin).
Chromosomenzahl
[Bearbeiten | Quelltext bearbeiten]
| Art | Chromosomenzahl |
|---|---|
| Säugetiere | |
| Mensch | 46 |
| Schimpanse | 48[20] |
| Gorilla | 48[21] |
| Orang-Utan | 48[21] |
| Rhesusaffe | 42[20] |
| Koboldmaki | 80 |
| Fledermaus (Myotis) | 44 |
| Hausmaus | 40[20] |
| Goldhamster | 44 |
| Wanderratte (Rattus norvegicus) |
42[20] |
| Hund | 78[19][20] |
| Katze | 38[19][20] |
| Schwein (Sus scrofa) | 38[20] |
| Opossum (Monodelphis domestica) |
18[20] |
| Schnabeltier | 52[22] |
| Ameisenigel (beide Arten) weiblich/männlich |
64/63[22] |
| Fische | |
| Katzenhai | 24 |
| Goldfisch | 94 |
| Neunauge | 174 |
| Amphibien | |
| Axolotl | 28 |
| Geburtshelferkröte | 36 |
| Reptilien | |
| Alligator | 32 |
| Blindschleiche | 44 |
| Sumpfschildkröte | 50 |
| Zauneidechse | 38 |
| Vögel | |
| Haushuhn | 78 |
| Amsel | 80 |
| Wirbellose Tiere | |
| Pferdespulwurm (Ascaris megalocephala univalens) |
2[23] |
| Pferdespulwurm (Ascaris megalocephala bivalens) |
4[23] |
| Stechmücke (Culex) | 6 |
| Taufliege (Drosophila melanogaster) |
8 |
| Honigbiene (Apis) weiblich/männlich |
32/16[24] |
| Sonnentierchen | 44 |
| Gefleckte Weinbergschnecke | 54[25] |
| Tintenfisch (Sepia) | 12 |
| Egel (Glossosiphonia complanata) |
26[26] |
| Excavata | |
| Euglena | ca. 200 |
| Pilze | |
| Champignon | 8 |
| Chlorophyta | |
| Cladophora (eine Alge) | 32 |
| Pflanzen | |
| Sauerampfer weiblich/männlich | 14/15 |
| Einkorn / Emmer / Dinkel | 14 / 28 / 42 |
| Süßkirsche (je nach Sorte) |
16, 24, 32, 54, 144 |
| Huflattich | 60 |
| Alpenveilchen | 48 |
| Adlerfarn | 104 |
| Wurmfarn | 164 |
| Schachtelhalm | 216 |
| Natternzunge | 480 |
Karyotyp: Die Chromosomen eines Individuums
[Bearbeiten | Quelltext bearbeiten]Alle verschiedenen Chromosomen, die in einem Individuum vorkommen, bilden zusammen den Karyotyp. In vielen Fällen (auch bei Säugern) finden sich im Karyotyp, abgesehen von den Geschlechtschromosomen im hemizygoten Geschlecht, immer zwei homologe Chromosomen, die als solche gleiche Gene tragen. Man spricht in diesen Fällen von einem zweifachen oder diploiden Chromosomensatz, der mit 2n abgekürzt wird. Bei sich geschlechtlich vermehrenden Organismen wird von beiden Elternteilen je einer vererbt.
Die Individuen einer Art und von gleichem Geschlecht haben normalerweise dieselbe Ausstattung an Chromosomen und somit den gleichen Karyotyp. Eine Ausnahme bilden hier sogenannte B-Chromosomen, die in manchen Arten vorkommen und bei verschiedenen Individuen und auch in verschiedenen Körperzellen in unterschiedlicher Anzahl vorhanden sein können.
Auch bei den regulären Chromosomen einer Art können zwischen den Geschlechtern Unterschiede hinsichtlich Form und – seltener – auch Anzahl von Chromosomen bestehen. Die Geschlechter haben dann einen verschiedenen Karyotyp (siehe oben, Geschlechtsbestimmung). Menschen zum Beispiel haben in beiden Geschlechtern 46 Chromosomen, doch ist das Y-Chromosom kleiner als das X-Chromosom. Als Karyotyp wird entsprechend 46,XX für Frauen und 46,XY für Männer angegeben. Karyotypen werden mit Hilfe von Karyogrammen bestimmt (siehe unten).
Weitergabe der Chromosomen an die nächste Generation
[Bearbeiten | Quelltext bearbeiten]Um eine Zunahme der Chromosomenanzahl von Generation zu Generation bei der Befruchtung zu verhindern, muss eine Reduktion der Zahl an Chromosomen im Zellkern vor der Ausbildung reifer Keimzellen stattfinden. Dies ist als Reduktionsteilung ein Bestandteil der Meiose. Während der Meiose kommt es auch durch Crossing-over zu einer Rekombination der homologen Chromosomen. Dadurch entstehen genetisch neu zusammengesetzte Chromosomen, die sich von denen der Elternorganismen unterscheiden. Es unterliegt bei der Aufteilung dem Zufall, welche der rekombinierten Chromosomen gemeinsam einen einfachen Chromosomensatz im Zellkern der resultierenden haploiden Zellen bilden. Die vormals väterlicherseits und mütterlicherseits geerbten Chromosomenabschnitte kommen also im neuen haploiden Chromosomensatz von Keimzellen in unterschiedlichen Kombinationen zusammen.
Bei diploiden Tieren werden haploide Keimzellen erzeugt, Eizellen beziehungsweise Spermien. Die Keimzellen können verschmelzen und zur ersten Zelle eines neuen Lebewesens werden, der Zygote. Dabei wird aus den zwei einfachen Chromosomensätzen der beiden Vorkerne dann der zweifache Chromosomensatz im Zellkern. Bei der Hybridogenese tritt eine in wenigen Tierarten gefundene Abweichung von einer zufälligen Verteilung der Chromosomen auf.
Bei Pflanzen und Einzellern können sich haploide und diploide Generationen abwechseln (siehe Generationswechsel). Manchmal dauert der diploide Status nur sehr kurz und die haploide Generation herrscht vor.
Nicht-diploide Chromosomensätze
[Bearbeiten | Quelltext bearbeiten]Gelegentlich findet sich die Auffassung, dass alle höheren Tiere und Pflanzen einen zweifachen Chromosomensatz hätten, also diploid seien. Dies ist jedoch nicht der Fall. Zwar sind die Mehrzahl der Tiere und viele Pflanzen diploid, es gibt jedoch auch etliche mit anderen Ploidiegraden.
Haploide Individuen kommen, wie oben erwähnt, beim Generationswechsel der Pflanzen vor. Außerdem kommen haploide Männchen bei etlichen Insektenarten (Haplodiploidie) und wohl auch bei einigen Milben vor. Auch ist ein Fall von haploiden weiblichen Tieren bekannt: Die Milbenart Brevipalpus phoenicis, ein Schädling tropischer Nutzpflanzen, besteht nur aus haploiden Weibchen, die sich parthenogenetisch vermehren. Einer Untersuchung zufolge sind es eigentlich genetische Männchen, die durch eine Infektion mit Bakterien zu Weibchen verändert werden.[27] Verweiblichung durch Bakterieninfektion ist auch bei anderen Gliederfüßern bekannt, meist durch Wolbachia.
Bei manchen Arten kommen Chromosomensätze vor, die sich aus mehr als zwei einfachen zusammensetzen. Auch diese sind also nicht zweifach, diploid, sondern weisen höhere Ploidiegrade auf. Sie werden bei 3n als triploid, bei 4n als tetraploid, bei 6n als hexaploid etc. bezeichnet, oder allgemein als polyploid. Bei Pflanzen wird in der Regel die Anzahl an Chromosomen im haploiden Genom eines Organismus Grundzahl oder Basiszahl genannt und mit x bezeichnet.[28] Stellt die Chromosomenzahl ein ganzzahliges Vielfaches der Grundzahl dar, so wird von Euploidie gesprochen. Diploide Pflanzen haben dann 2x Chromosomen, tetraploide 4x usw. Das Genom einer tetraploiden Pflanze beispielsweise mit der Grundzahl x = 7 hat dann 4x = 28 Chromosomen.[29]
Tetraploidie ist nach Diploidie wohl der zweithäufigste Ploidiegrad. Er wurde bei vielen Blütenpflanzen, Insekten und auch bei Amphibien beobachtet. Tetraploidie kann zustande kommen, indem nach DNA-Replikation und Chromatidenverdopplung eine Zellteilung verhindert wird. Viele Nutzpflanzen, z. B. bei den Getreidesorten, entstanden durch Polyploidisierung aus diploiden Wildformen.
Bei Pflanzen kommen auch noch höhere Ploidiegrade vor. Sie können beispielsweise entstehen, wenn zwei Arten gekreuzt werden und die Kinder alle Chromosomen der Eltern behalten. Man spricht dann von Additionsbastarden. Hexaploid ist beispielsweise der moderne Saatweizen.
Triploide Individuen können entstehen, wenn sich diploide und tetraploide Individuen paaren. Dies ist möglich, wenn beide zu nahe verwandten Arten gehören. Allerdings werden triploide Individuen in der Regel steril sein, da der aus einer ungeraden Anzahl einfacher zusammengesetzte Chromosomensatz zu Schwierigkeiten bei der Paarung der Chromosomen während der Meiose führt. Ausnahmen, also fortpflanzungsfähige triploide Individuen, wurden bei den Amphibien entdeckt. Hier kommen manchmal Diploidie, Tetraploidie und auch Triploidie in nahe verwandten Arten oder in der gleichen Art nebeneinander vor. Beim Wasserfrosch wird einer der geerbten einfachen Chromosomensätze vor Eintritt in die Meiose gezielt eliminiert (siehe auch Teichfrosch). In Pakistan wurde eine lokal begrenzte, triploide Population der Wechselkröte gefunden, bei der dies ebenfalls festzustellen ist.[30]
Zumindest theoretisch kann ein fließender Übergang beispielsweise von tetraploid zu diploid bestehen. In einem tetraploiden Lebewesen sind alle Chromosomenpaare doppelt vorhanden. Veränderungen an einem der beiden Paare, zum Beispiel der Verlust einzelner Gene, können daher toleriert werden. Auch können sich die Genkopien auf den beiden Paaren während der weiteren Evolution auseinanderentwickeln und verschiedene Funktionen übernehmen. Chromosomenmutationen (siehe unten) an nur einem der beiden Paare sind ebenfalls möglich. Kommen viele solche Veränderungen im Lauf der Zeit zusammen, so haben sich schließlich die ursprünglich gleichen Chromosomenpaare so weit auseinanderentwickelt, dass nicht mehr von vierfachen Chromosomensätzen gesprochen werden kann: Nun liegt wieder Diploidie vor. Für die frühe Entstehungsgeschichte der Wirbeltiere sind zwei Runden solcher Genomduplikationen vorgeschlagen worden („2R-Hypothese“), womit sich die heutigen diploiden Wirbeltiere aus ursprünglich oktaploiden (8n) Lebewesen entwickelt hätten.[31] Dies würde erklären, warum beispielsweise die Hox-Gen-Cluster pro haploidem Genom der Wirbeltiere viermal vorkommen, bei anderen Tieren aber nur einmal.
Der Ploidiegrad einzelner Körperzellen eines Mehrzellers kann durchaus vom Ploidiegrad des Organismus abweichen. Das bekannteste Beispiel hierfür sind die Polytänchromosomen mancher Insekten (siehe oben). Aber auch für die Rattenleber wurden beispielsweise neben den vorherrschenden diploiden Zellen in seltenen Fällen auch haploide, triploide und tetraploide Zellen beschrieben.[32] Tetraploidie entsteht leicht durch Verdopplung (Reduplikation) der Chromosomen ohne nachfolgende Kernteilung, also durch Endoreduplikation oder Endomitose. Über Haploidie sowie Triploidie bei Körperzellen von diploiden Organismen ist so selten berichtet worden, dass hier womöglich experimentelle Fehler oder Artefakte nicht auszuschließen sind. Der potentielle Entstehungsmechanismus ist ungeklärt. Hohe Ploidiegrade gehen mit entsprechend größeren Zellkernen einher. Aufgrund der größeren Menge an genetischem Material können so auch sehr große Körperzellen versorgt werden.
Karyogramm
[Bearbeiten | Quelltext bearbeiten]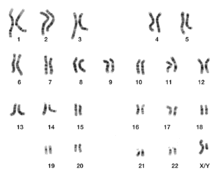

Als Karyogramm bezeichnet man eine sortierte Darstellung der Chromosomen eines Metaphasepräparats. Diese Präparate werden erstellt, indem Zellkulturen mit einem Mittel versetzt werden, das die Bildung von Mikrotubuli verhindert, z. B. Colchizin oder Nocodazol. Dadurch kann sich kein Spindelapparat ausbilden, und die Zelle kann nicht in Anaphase gehen. Als Folge sammeln sich etliche Zellen in der Metaphase (siehe oben) an, und die Ausbeute wird entsprechend erhöht. Die Zellen werden hypoton behandelt, wodurch sie anschwellen, fixiert und auf einen Objektträger aufgetropft, wodurch die Metaphasechromosomen nebeneinander zu liegen kommen (siehe erste Abbildung oben). Die Chromosomen werden angefärbt, fotografiert und im Karyogramm der Größe nach angeordnet, so dass der Karyotyp bestimmt werden kann (siehe Abbildung rechts).
Karyogramme werden sowohl bei der Untersuchung der Karyotypen von Organismen als auch in der klinischen Anwendung bei Verdacht auf Chromosomenveränderungen eingesetzt.
Chromosomenmutationen
[Bearbeiten | Quelltext bearbeiten]
Dauerhafte Veränderungen an den Chromosomen können auftreten, wenn an mindestens zwei Stellen Brüche in der DNA-Doppelhelix auftreten. In den meisten Fällen werden DNA-Doppelstrangbrüche wieder korrekt repariert, so dass es nicht zu bleibenden Veränderungen kommt. Werden jedoch bei einer DNA-Reparatur von zwei verschiedenen Brüchen die falschen Enden zusammengefügt, so kommt es zu Chromosomenmutationen. Liegen die Bruchpunkte auf dem gleichen Chromosom, können Deletionen (Verlust eines Abschnitts) oder Inversionen (umdrehen) auftreten. Ein weiterer Mutationstyp innerhalb eines Chromosoms ist die Duplikation (Verdopplung eines Abschnitts). Sind die Doppelstrangbrüche auf verschiedenen Chromosomen, so kann es zu Translokationen kommen. Diese Phänomene werden in ihren eigenen Artikeln ausführlicher beschrieben.
Chromosomenmutationen spielen sowohl bei der Chromosomenevolution als auch im klinischen Bereich eine Rolle. Bezüglich der klinischen Bedeutung sind Erbkrankheiten (siehe auch unten), Tumorentstehung (z. B. das Philadelphia-Chromosom) und Strahlenbiologie zu nennen.
Von den genannten strukturellen Veränderungen sind zahlenmäßige Veränderungen zu unterscheiden, also ein zusätzliches oder ein fehlendes Chromosom. Diese werden nicht als Chromosomenmutation bezeichnet. Da nur ein einzelnes Chromosom betroffen ist, spricht man von Trisomie (nicht Triploidie) oder Monosomie (siehe Chromosomenaberration).
Chromosomenevolution
[Bearbeiten | Quelltext bearbeiten]Als Chromosomenevolution wird die Veränderung von Chromosomen im Lauf der Evolution bezeichnet. Ähnlich wie an äußeren körperlichen Merkmalen oder an der Sequenz einzelner Gene lässt sich auch an den Chromosomen die Stammesgeschichte nachvollziehen. Beispielsweise sind die Chromosomen des Menschen (46 Stück) denen der großen Menschenaffen (Schimpansen, Gorillas und Orang-Utans, je 48 Chromosomen) sehr ähnlich. Es gibt innerhalb dieser Artengruppe nur zwei zwischen-chromosomale Umbauten. Spezifisch menschlich ist das Chromosom 2. Bei den anderen genannten Arten finden sich statt diesem zwei kleinere Chromosomen, die die entsprechenden Gensequenzen enthalten (siehe Abbildung). Gorilla-spezifisch ist dagegen eine Translokation zwischen jenen Chromosomen, die den menschlichen Chromosomen 5 und 17 entsprechen.[21] Daraus ergibt sich der ursprüngliche Karyotyp der Gruppe mit 48 Chromosomen, so wie er heute noch bei Schimpansen und Orang-Utans vorhanden ist.

Eine evolutionär stabile Veränderung der Chromosomen ist nur möglich, wenn eine Chromosomenmutation in der Keimbahn auftritt. Eine „balancierte“ Veränderung, bei der alle Chromosomenabschnitte in der richtigen Anzahl vorhanden sind, hat dabei für den Träger zunächst keinen Krankheitswert. Es kommt jedoch zu Schwierigkeiten bei der Meiose. Die Veränderung tritt ja zunächst nur an jeweils einem Chromosom auf (bzw. an zweien bei Fusionen oder Translokationen), nicht aber an den jeweiligen homologen Chromosomen. Da also anders als sonst identisch aufgebaute Partner fehlen, kommt es nicht zu einer normalen meiotischen Paarung. Das Risiko für Segregationsfehler und daraus resultierende Keimzellen mit überzähligen oder fehlenden chromosomalen Abschnitten (und folglich kranken Kindern) steigt stark an. In den allermeisten Fällen werden solche Veränderungen daher in den Folgegenerationen wieder verlorengehen. Eine stabile Situation wird nur dann erreicht, wenn beide Kopien der beteiligten Chromosomen die entsprechende Veränderung tragen. Dies könnte beispielsweise geschehen, wenn ein dominantes Männchen mit einer Veränderung zahlreiche Kinder hat, die sich wiederum untereinander paaren, so dass Enkel mit der Veränderung auf beiden Kopien der beteiligten Chromosomen entstehen. Diese Nachkommen haben nun keinen Selektionsnachteil, wenn sie sich untereinander paaren. Bei der Paarung mit Individuen mit den ursprünglichen Chromosomen tritt jedoch bei entstehenden Kindern bedingt durch Segregationsfehler wiederum eine verminderte Fruchtbarkeit auf. Es wird daher vermutet, dass „fixierte“ Chromosomenveränderungen ein Mechanismus zur Artbildung sind.
Näher verwandte Arten oder Artgruppen müssen nicht immer ähnlichere Chromosomen haben als weiter entfernte Arten. Beispielsweise ähneln Chromosomen der großen Menschenaffen einschließlich des Menschen sehr stark denen von Makaken (Macaca fuscata). Die Chromosomen der näher verwandten kleinen Menschenaffen (Gibbons) unterscheiden sich jedoch sowohl von denen der großen Menschenaffen als auch denen der Makaken sehr stark. Durch zahlreiche Umbauten sind nur fünf der Gibbon-Chromosomen auf ihrer ganzen Länge (nur) einem menschlichen Chromosom homolog.[21] Offensichtlich gehen also evolutionäre Veränderungen im Karyotyp in manchen Gruppen (z. B. den Gibbons) sehr viel schneller voran als in anderen (Makaken, große Menschenaffen). Es wird vermutet, dass dies nicht an einer höheren Mutationsrate liegt, sondern an einer häufigeren Fixierung von aufgetretenen Veränderungen. Eine Ursache hierfür könnten unterschiedliche Lebensstile bzw. Sozialverhalten sein. Gibbons leben in kleinen Gruppen, in denen sich Chromosomenveränderungen schneller durchsetzen könnten als in großen Herden. Bei Gibbons finden sich chromosomale Polymorphismen (Unterschiede) im Karyotyp von untersuchten Tieren der gleichen Art, die darauf hindeuten, dass die schnelle Chromosomenevolution in dieser Tiergruppe nach wie vor anhält. Die verhältnismäßig große Anzahl der Polymorphismen deutet allerdings auch darauf hin, dass der selektive Nachteil von Mischformen möglicherweise geringer ist als ursprünglich gedacht.[21]
Chromosomen beim Menschen
[Bearbeiten | Quelltext bearbeiten]
Menschen haben 46 Chromosomen, davon 2 Geschlechtschromosomen oder Gonosomen (XX bei Frauen, XY bei Männern, siehe oben: Geschlechtsbestimmung). Die Chromosomen der übrigen 22 Chromosomenpaare werden als Autosomen bezeichnet. Die Autosomen wurden ihrer Größe im mikroskopischen Präparat entsprechend von 1 bis 22 durchnummeriert. Menschen sind wie andere Säugetiere diploid, eine Zelle hat also einen doppelten Chromosomensatz: Es sind je zwei Exemplare der Chromosomen 1 bis 22 vorhanden, dazu die beiden Geschlechtschromosomen.
Eigenschaften der Geschlechtschromosomen
[Bearbeiten | Quelltext bearbeiten]Obwohl sich das X-Chromosom mit 155 Megabasen und das Y-Chromosom mit 59 Megabasen[33] in ihrer Größe stark unterscheiden, haben sie auch Gemeinsamkeiten. An beiden Enden enthalten sie Regionen, in denen sich die DNA-Sequenz zwischen X- und Y-Chromosom stark ähnelt, die pseudoautosomalen Regionen (PAR). In den PAR befinden sich mehrere Gene, die also in beiden Geschlechtern doppelt vorhanden sind, und die auch nicht der X-Inaktivierung unterliegen. In diesen Regionen ist während der Meiose eine Rekombination zwischen X- und Y-Chromosom möglich.
Auch in nicht rekombinierenden Regionen des Y-Chromosoms haben etwa die Hälfte der Gene Entsprechungen auf dem X-Chromosom. Dies sind vor allem Gene des Grundstoffwechsels. Zwei der Gene, die auch auf dem X-Chromosom vorkommen, sind nur im Hoden aktiv. Die übrigen Gene ohne Entsprechung auf dem X-Chromosom sind ebenfalls nur im Hoden aktiv, bestimmen das männliche Geschlecht und steuern die Spermien-Produktion. Ein Verlust eines Stückes des langen Armes nahe dem Zentromer führt zu Kleinwuchs.
Genom- und Chromosomenmutationen mit klinischer Bedeutung
[Bearbeiten | Quelltext bearbeiten]Durch Chromosomenaberrationen, also Chromosomenmutationen, Chromosomeninstabilität, Chromosomenbrüche oder eine andere Anzahl von Chromosomen (numerische Chromosomenaberration oder Genommutation), kann es zu klinischen Syndromen mit zum Teil schwerwiegender Symptomatik kommen.
Eine Zuordnung der Krankheitsbilder zu entweder Chromosomenmutationen oder numerischen Chromosomenaberration ist nicht immer möglich. So wird z. B. das Down-Syndrom in den meisten Fällen durch ein zusätzliches, komplettes Chromosom 21 verursacht (freie Trisomie). Etwa 3 % der Fälle beruhen jedoch auf Translokationen, bei denen ein Teil des Chromosoms 21 an ein anderes Chromosom fusioniert ist. Nur dieser Teil ist dann dreifach vorhanden. Die folgenden Syndrome sind meist in ihren jeweils eigenen Artikeln ausführlich behandelt und hier nur übersichtsartig dargestellt.
Autosomale Trisomien
[Bearbeiten | Quelltext bearbeiten]Freie Trisomien bei Lebendgeborenen sind bei den Autosomen nur für die Chromosomen 21, 18 und 13 bekannt. Alle drei gehören zu den genarmen Chromosomen (vergleiche zweite Abbildung im Abschnitt G-, R- und andere Chromosomenbanden oben). Daraus lässt sich schließen, dass freie Trisomien der anderen Autosomen mit dem Leben unvereinbar sind.
- Down-Syndrom oder Trisomie 21 (dreifaches/trisomes Vorliegen von Erbmaterial des Chromosoms 21 in allen oder einigen Körperzellen). Vorkommen: 1 Fall auf 600–800 Neugeborene. Wichtige Symptome sind u. a. Herzfehler und Intelligenzminderung. Während früher die meisten Betroffenen im Kindesalter an Infektionskrankheiten starben, liegt die durchschnittliche Lebenserwartung heute bei über 60 Jahren.
- Edwards-Syndrom oder Trisomie 18 (dreifaches/trisomes Vorliegen von Erbmaterial des Chromosoms 18 in allen oder einigen Körperzellen). Vorkommen: 1 Fall auf 2.500 Neugeborene. Organfehlbildungen sind vielfältig, u. a. Herzfehler und Nierenmissbildungen. Schwere Intelligenzminderung (keine Sprache), das Erwachsenenalter wird nur ausnahmsweise erreicht.
- Pätau-Syndrom oder Trisomie 13 (dreifaches/trisomes Vorliegen von Erbmaterial des Chromosoms 13 in allen oder einigen Körperzellen). Vorkommen: 1 Fall auf 6.000 Neugeborene. Häufige Symptome sind u. a. Herzfehler, Lippen-Kiefer-Gaumenspalten, Polydaktylie (Vielfingerigkeit) und schwere Intelligenzdefekte. Das Erwachsenenalter wird nur ausnahmsweise erreicht.
- Trisomie 8 (dreifaches/trisomes Vorliegen von Erbmaterial des Chromosoms 8 in einigen Körperzellen). Häufige Symptome sind u. a. tiefe Hand- und Fußlinien, Wirbelmissbildungen, Neuralrohrfehlbildungen (häufig Spina bifida aperta) und Großwuchs.
Abweichungen bei der Zahl der Geschlechtschromosomen
[Bearbeiten | Quelltext bearbeiten]- Ullrich-Turner-Syndrom (45,X). Fehlendes zweites Geschlechtschromosom. Vorkommen: 1 Fall auf 3.000 Neugeborene. Frauen mit diesem Syndrom haben unterentwickelte weibliche Geschlechtsmerkmale, eine kleine Statur, einen tiefen Haaransatz, eine ungewöhnliche Augen- und Knochenentwicklung, eine Trichterbrust und sind meist unfruchtbar. Die Intelligenz ist normal ausgeprägt, manchmal sind räumliches Vorstellungsvermögen oder mathematische Fähigkeiten unterdurchschnittlich.
- Triplo-X-Syndrom (47,XXX). Das Triplo-X-Syndrom ist die klinisch unauffälligste Chromosomenaberration. Vermutlich werden viele Fälle nie festgestellt. Intelligenz ist meist niedriger als bei Geschwistern. Die Fruchtbarkeit kann leicht herabgesetzt sein. Die Nachkommen zeigen eine kaum erhöhte Rate von Chromosomenaberrationen.
- 48,XXXX und 49,XXXXX. Mit zunehmender Zahl der X-Chromosomen sinken die Intelligenz und die Fruchtbarkeit.
- Klinefelter-Syndrom (fast immer 47,XXY; selten 48,XXXY oder 49,XXXXY). 1 Fall auf 1.000 männliche Neugeborene. Männer mit diesem Syndrom sind oft unfruchtbar, groß, haben ungewöhnlich lange Arme und Beine, eine Tendenz zur Ausbildung von Brüsten (Pseudo-Gynäkomastie) und eine reduzierte Körperbehaarung. Der Intelligenzquotient liegt durchschnittlich um 10 niedriger als bei Geschwistern.
- XYY-Syndrom (47,XYY). Männer mit diesem Syndrom sind meist phänotypisch unauffällig und werden zufällig diagnostiziert. Die Lebenserwartung ist nicht eingeschränkt, die Fruchtbarkeit fast normal, sie sind durchschnittlich 10 cm größer als ihre Brüder und die Intelligenz im Vergleich zu Geschwistern leicht vermindert. Vereinzelt können mit der Chromosomenaberration assoziierte Störungen wie Hodenhochstand vorkommen.
- Höhergradige Y-Polysomien: 48,XXYY Männer sind ähnlich den XYY Männern, jedoch unfruchtbar und mit Tendenz zu geringerer Intelligenz. Letztere verstärkt sich bei 48,XYYY und den sehr seltenen 49,XYYYY Männern. Auch treten Organfehlbildungen auf.
Markerchromosomen
[Bearbeiten | Quelltext bearbeiten]Markerchromosomen sind alle nicht ohne weiteres definierbaren Chromosomen, die zusätzlich zu den normalen Chromosomen auftreten. Sie bestehen aus Material der normalen Chromosomen, sind aber meist klein, so dass eine Identifizierung durch G-Bänderung (siehe oben) nicht möglich ist. Diese kann mit hochauflösender Fluoreszenz-in-situ-Hybridisierung erreicht werden.
Deletionen auf Autosomen
[Bearbeiten | Quelltext bearbeiten]Monosomien von Autosomen kommen nicht vor. Die damit einhergehenden Schäden sind offenbar mit dem Leben unvereinbar. Es gibt jedoch eine Vielzahl unterschiedlicher Deletionen von Teilstücken eines Autosoms, die teilweise nur aus wenigen klinischen Fällen bekannt sind. Die folgende Liste ist daher nicht vollständig und umfasst nur die bekanntesten Beispiele.
- Obwohl noch nicht lange bekannt, ist eine Deletion des Endes des kurzen Arms von Chromosom 1 vermutlich die häufigste Deletion (1 Fall auf 5.000–10.000 Neugeborene). Die Symptome sind wenig einheitlich, meistens liegt schwere geistige Behinderung vor.
- Das Cri-du-chat-Syndrom (Katzenschrei-Syndrom) wird durch Deletion des Endes des kurzen Arms von Chromosom 5 verursacht. Sie wurde als erste autosomale Deletion 1963 beschrieben. Die Häufigkeit liegt etwa bei einem Fall auf 50.000 Neugeborene. Im frühen Kindesalter fallen die Kinder durch ein hohes Schreien auf, das an das Schreien von Katzen erinnert und das durch Fehlbildungen des Kehlkopfs bedingt wird. Sie haben weit auseinander liegende Augen (Hypertelorismus), einen kleinen Kopf (Mikrozephalie) und Kiefer und sind in ihrer Intelligenz gemindert. Da innere Organe meist nicht betroffen sind, sind die Überlebenschancen vergleichsweise gut.
- Das Wolf-Hirschhorn-Syndrom wird durch Deletion des Endes des kurzen Arms von Chromosom 4 hervorgerufen. Die Häufigkeit liegt ebenfalls bei etwa einem Fall auf 50.000 Neugeborene. Betroffene sind kognitiv meist schwer beeinträchtigt und haben Wachstumsstörungen. Weniger als die Hälfte der Kinder überleben die ersten 18 Monate.
- Das De-Grouchy-Syndrom kommt in zwei Varianten vor, die durch Deletionen der verschiedenen Arme des Chromosoms 18 verursacht werden.
Weitere Beispiele sind das Williams-Beuren-Syndrom (7q11.23) und das Smith-Magenis-Syndrom (17p11.2 – Häufigkeit zwischen 1:15.000 bis 1:25.000 Geburten angegeben).
Eine Besonderheit stellen Deletionen der Region 15q11.2-q12 dar. Diese Region unterliegt einer epigenetischen Regulation, dem „Imprinting“: Je nachdem, ob diese Region vom Vater oder von der Mutter vererbt wurde, sind bestimmte Gene aktiv oder inaktiv. Normalerweise sind beide Fälle jeweils einmal vorhanden. Fehlt jedoch einer der beiden, z. B. durch Deletion, so unterscheiden sich die Krankheitsbilder, je nachdem ob eine von der Mutter vererbte (Angelman-Syndrom) oder eine vom Vater vererbte (Prader-Willi-Syndrom) Region fehlt.
Der ICD-10-Code O35.1 wird bei der Betreuung einer werdenden Mutter bei (Verdacht auf) Chromosomenbesonderheit beim ungeborenen Kind angegeben.
Prokaryotische und virale „Chromosomen“
[Bearbeiten | Quelltext bearbeiten]Die prokaryotischen Lebewesen, also Bakterien und Archaeen, besitzen keinen Zellkern und haben auch keine Chromosomen im klassischen Sinn. Träger der Erbinformation sind hier ein oder mehrere zumeist zirkuläre DNA-Moleküle, die gelegentlich als Bakterienchromosom bezeichnet werden. In den Mitochondrien und Chloroplasten der Eukaryoten ist die DNA ebenfalls üblicherweise ringförmig und ähnelt einem Bakterienchromosom (vgl. Endosymbiontentheorie). Ihre DNA wird gelegentlich formal als zusätzliches, nicht-nukleäres Chromosom geführt und Chondriom beziehungsweise Plastom genannt. Die Verpackung der langen DNA-Moleküle auf kleinsten Raum erfolgt bei Archaeen ähnlich (homolog) zum Zellkern der Eukaryoten, bei Bakterien dagegen ähnlich zu den Organellen derselben (siehe Endosymbiontentheorie).
Auch bei Viren, deren Genom aus einem oder mehreren Nukleinsäuremolekülen (DNA oder RNA) besteht, werden diese Segmente gelegentlich als Chromosom bezeichnet. Beispielsweise besteht das RNA-Genom von Influenza-A-Viren aus acht solchen Segmenten (Chromosomen).
Literatur
[Bearbeiten | Quelltext bearbeiten]- John Sedat, Angus McDonald, Herbert Kasler, Eric Verdin, Hu Cang, Muthuvel Arigovindan, Cornelis Murre, Michael Elbaum: A proposed unified mitotic chromosome architecture. In: Proc Natl Acad Sci USA 119, 20, 2022: e2119107119. PDF.
- Bastiaan Dekker, Job Dekker: Regulation of the mitotic chromosome folding machines. In: Biochem J 479, 20, 2022: 2153–2173. PDF.
- Ensieh Khazaei, Ala Emrany, Mostafa Tavassolipour, Foroozandeh Mahjoubi, Ahmad Ebrahimi, Seyed Abolfazl Motahari: Automated analysis of karyotype images. In: J Bioinform Comput Biol 20, 3, 2022: 2250011. doi:10.1142/S0219720022500111.
- Alessio Iannucci, Alexey I Makunin, Artem P Lisachov, Claudio Ciofi, Roscoe Stanyon, Marta Svartman, Vladimir A Trifonov: Bridging the gap between vertebrate cytogenetics and genomics with Single-chromosome Sequencing (ChromSeq). In: Genes (Basel) 12, 2021: 124. PDF.
- Isha Pathak, Bruno Bordoni: Genetics, Chromosomes. StatPearls Publishing, Treasure Island, Florida 2021. (ncbi.nlm.nih.gov, online-Buch)
- Marco Di Stefano, David Castillo, François Serra, Irene Farabella, Mike N. Goodstadt, Marc A. Marti-Renom: Analysis, modeling, and visualization of chromosome conformation capture experiments. In: B. Bodega, C. Lanzuolo (Hrsg.): Capturing Chromosome Conformation. In: Methods in Molecular Biology. Band 2157, 2021. Humana, New York NY. doi:10.1007/978-1-0716-0664-3_4.
- Rachel P. McCord, Noam Kaplan, Luca Giorgetti: Chromosome conformation capture and beyond: Toward an integrative view of chromosome structure and function. In: Mol Cell. Band 77, Nr. 4, 2020, S. 688–708; PMC 7134573 (freier Volltext).
- Paul Batty, Daniel W. Gerlich: Mitotic chromosome mechanics: How cells segregate their genome. In: Trends Cell Biol. Band 29, Nr. 9, 2019, S. 717–726. (cell.com, PDF)
- Stanislau Yatskevich, James Rhodes, Kim Nasmyth: Organization of chromosomal DNA by SMC complexes. In: Annu Rev Genet. Band 53, 2019, S. 445–482. doi:10.1146/annurev-genet-112618-043633 – SMC: Structural maintenance of chromosomes.
- Bärbel Häcker: Chromosomen. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 261 f.
- Gholamali Tariverdian, Werner Buselmaier: Chromosomen, Gene, Mutationen. Humangenetische Sprechstunde. Springer, Berlin 1995, ISBN 3-540-58667-9.
- Walther Traut: Chromosomen. Klassische und molekulare Cytogenetik. Springer, Berlin 1991, ISBN 3-540-53319-2.
- Jan Murken, Tiemo Grimm, Elke Holinski-Feder: Taschenlehrbuch Humangenetik. 7. Auflage. Thieme, Stuttgart 2006, ISBN 3-13-139297-5.
- Thomas Cremer: Von der Zellenlehre zur Chromosomentheorie. Springer, Berlin / Heidelberg / New York / Tokyo 1985, ISBN 3-540-13987-7 (uni-muenchen.de).
- Ivona Kubalová, Amanda Souza Câmara, Petr Cápal, Tomáš Beseda, Jean-Marie Rouillard, Gina Marie Krause, Kateřina Holušová, Helena Toegelová, Axel Himmelbach, Nils Stein, Andreas Houben, Jaroslav Doležel, Martin Mascher, Hana Šimková, Veit Schubert: Helical coiling of metaphase chromatids. In: Nucleic Acids Research. 2. März 2023, ISSN 0305-1048, S. gkad028, doi:10.1093/nar/gkad028.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Lexikon der Biologie: Chromosomen
- Chromosomen; Chromosomentheorie (Teil II)
- Chromosomenstrukturen und strukturelle Veränderungen der Chromosomen
- Feinbau der Chromosomen
- Miniaturbildübersicht Chromosomen
- Morphologie menschlicher Chromosomen
- Chromosomenzahlen zur Flora von Deutschland
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Wilhelm Pape, Max Sengebusch (Bearb.): Handwörterbuch der griechischen Sprache. 3. Auflage, 6. Abdruck. Vieweg & Sohn, Braunschweig 1914 (zeno.org [abgerufen am 4. Mai 2022]).
- ↑ Wilhelm Pape, Max Sengebusch (Bearb.): Handwörterbuch der griechischen Sprache. 3. Auflage, 6. Abdruck. Vieweg & Sohn, Braunschweig 1914 (zeno.org [abgerufen am 4. Mai 2022]).
- ↑ S Krawiec, M Riley: Organization of the bacterial chromosome. In: Microbiological Reviews. Band 54, Nr. 4, Dezember 1990, ISSN 0146-0749, S. 502–539, doi:10.1128/mr.54.4.502-539.1990, PMID 2087223.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 46.
- ↑ Bärbel Häcker: Chromosomen. 2005, S. 261.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 47.
- ↑ Erblichkeit (Weismanns Theorie). In: Meyers Konversations-Lexikon. 4. Auflage. Band 18, Verlag des Bibliographischen Instituts, Leipzig/Wien 1885–1892, S. 267.
- ↑ S. G. Gregory u. a.: The DNA sequence and biological annotation of human chromosome. In: Nature. Band 441, Nr. 1, 2006, S. 315–321, doi:10.1038/nature04727 (englisch).
- ↑ N. Annaluru u. a.: Total synthesis of a functional designer eukaryotic chromosome. In: Science. Band 344, Nr. 6179, 4. April 2014, S. 55–58, doi:10.1126/science.1249252 (englisch).
- ↑ D. Schindler, T. Waldminghaus: Synthetic chromosomes. In: FEMS Microbiol Rev. 2015, doi:10.1093/femsre/fuv030, PMID 26111960 (englisch).
- ↑ Jochen Graw: Genetik. 6., überarbeitete und aktualisierte Auflage. Springer, Berlin / Heidelberg 2015, ISBN 978-3-662-44817-5.
- ↑ a b c Homo sapiens. auf ensembl.org (englisch) Datenbankstand von September 2006.
- ↑ Mus musculus (Hausmaus) auf ensembl.org (englisch). Datenbankstand von März 2017.
- ↑ a b Gallus gallus (Huhn). auf ensembl.org (englisch) Datenbankstand von September 2006.
- ↑ Theophilus S. Painter: Studies in reptilian spermatogenesis. I. The spermatogenesis of lizards. In: Jour Exper Zoology. Band 34, 1921, S. 281–327.
- ↑ Paul D. Waters u. a.: Microchromosomes are building blocks of bird, reptile, and mammal chromosomes. In: PNAS. Band 118, Nr. 4, November 2021, Artikel e2112494118; doi:10.1073/pnas.21124941181, Epub 27. August 2021. Dazu:
‘Microchromosomes’ are Fundamental Building Blocks of Amniote Chromosomes, Study Finds. sci-news.com, 2. November 2021. - ↑ A. S. Belmont, K. Bruce: Visualization of G1 chromosomes. A folded, twisted, supercoiled chromonema model of interphase chromatid structure. In: Journal of Cell Biology. Band 127, Nr. 2, 1994, S. 287–302, doi:10.1083/jcb.127.2.287 (englisch).
- ↑ Panagiota Manolakou, Giagkos Lavranos, Roxani Angelopoulou: Molecular patterns of sex determination in the animal kingdom: a comparative study of the biology of reproduction. In: Reproductive Biology and Endocrinology. Band 4, 2006, S. 59. doi:10.1186/1477-7827-4-59
- ↑ a b c Rainer Flindt: Biologie in Zahlen. Eine Datensammlung in Tabellen mit über 9000 Einzelwerten. Gustav Fischer, Stuttgart 1985, ISBN 3-437-30466-6, S. 86 f., 138 f.
- ↑ a b c d e f g h Schimpanse auf ensembl.org (englisch) Datenbankstand von September 2006.
- ↑ a b c d e A. Jauch, J. Wienberg, R. Stanyon, N. Arnold, S. Tofanelli, T. Ishida, T. Cremer: Reconstruction of genomic rearrangements in great apes and gibbons by chromosome painting. In: Proceedings of the National Academy of Sciences of the United States of America. Band 89, Nr. 18, 1992, S. 8611–8615, doi:10.1073/pnas.89.18.8611 (englisch).
- ↑ a b Jaclyn M. Watson, Julianne Meynedagger, Jennifer A. Marshall Graves: Ordered tandem arrangement of chromosomes in the sperm heads of monotreme mammals. In: Proceedings of the National Academy of Sciences of the United States of America. Band 93, Nr. 19, 1996, S. 10200–10205, doi:10.1073/pnas.93.19.10200 (englisch).
- ↑ a b Theodor Boveri: Die Potenzen der Ascaris-Blastomeren bei abgeänderter Furchung. Verlag von Gustav Fischer, Jena 1910.
- ↑ G. J. Hunt, R. E. Page Jr: Linkage Map of the Honey Bee, Apis Mellifera, Based on Rapd Markers. In: Genetics. Band 139, Nr. 3, 1995, S. 1371–1382, Table 1, PMC 1206463 (freier Volltext) – (englisch).
- ↑ R. Vitturi, A. Libertini, L. Sineo u. a.: Cytogenetics of the land snails Cantareus aspersus and C. mazzullii (Mollusca: Gastropoda: Pulmonata). In: Micron. Band 36, Nr. 4, 2005, S. 351–357, doi:10.1016/j.micron.2004.12.010, PMID 15857774 (englisch).
- ↑ V. Wendrowsky: Über die Chromosomenkomplexe der Hirudineen. In: Zeitschrift für Zellforschung und mikroskopische Anatomie. (jetzt: Cell and Tissue Research). Band 8, Nr. 2, 1928, S. 153–175, doi:10.1007/BF02658704.
- ↑ Andrew R. Weeks, Frantisek Marec, Johannes A. J. Breeuwer: A mite species that consists entirely of haploid females. In: Science. Band 292, Nr. 5526, 2001, S. 2479–2482, doi:10.1126/science.1060411 (englisch).
- ↑ Grundzahl im Lexikon der Biologie auf spektrum.de
- ↑ Peter Sitte, Elmar Weiler, Joachim W. Kadereit, Andreas Bresinsky, Christian Körner: Lehrbuch der Botanik für Hochschulen. Begründet von Eduard Strasburger. 35. Auflage. Spektrum Akademischer Verlag, Heidelberg 2002, ISBN 3-8274-1010-X, S. 531.
- ↑ Matthias Stöck, Dunja K. Lamatsch, Claus Steinlein, Jörg T. Epplen, Wolf-Rüdiger Grosse, Robert Hock, Thomas Klapperstück, Kathrin P. Lampert, Ulrich Scheer, Michael Schmid, Manfred Schartl: A bisexually reproducing all-triploid vertebrate. In: Nature Genetics. Band 30, 2002, S. 325–328, doi:10.1038/ng839 (englisch).
- ↑ Paramvir Dehal, Jeffrey L. Boore: Two Rounds of Whole Genome Duplication in the Ancestral Vertebrate. In: PLOS Biology. Band 3, Nr. 10, 2005, S. e314, doi:10.1371/journal.pbio.0030314 (englisch).
- ↑ Eberhard Gläss: Die Identifizierung der Chromosomen im Karyotyp der Rattenleber. In: Chromosoma. Band 7, 1955, S. 655–669, doi:10.1007/BF00329746.
- ↑ Ensembl Datenbank, abgerufen am 24. Januar 2014.
