Cunean
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
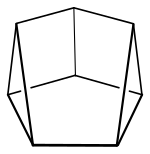
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Cunean | ||||||||||||
| Andere Namen |
Pentacyclo[3.3.0.02,4.03,7.06,8]octan (IUPAC) | ||||||||||||
| Summenformel | C8H8 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 104,15 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Cunean ist ein gesättigter polycyclischer Kohlenwasserstoff und ein Valenzisomer von Cyclooctatetraen. Der Name leitet sich vom lateinischen Wort cuneus (Keil) ab.
Nach Cuban (Erstssynthese 1964) ist Cunean der zweite von drei möglichen gesättigten C8H8-Kohlenwasserstoffen, der synthetisiert wurde. Die Erstsynthese der Verbindung wurde 1970 veröffentlicht,[1] ein substituiertes Derivat, das Octamethylcunean, wurde bereits 1968 beschrieben.[3] Erst 1988 erfolgte die Synthese des dritten gesättigten C8H8-Kohlenwasserstoffs Octabisvalen.[4]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Cunean kann durch eine von Metallionen katalysierte Umlagerung aus Cuban hergestellt werden:[1]
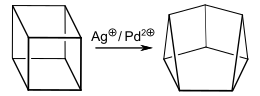
Diese Reaktion entspricht der zuvor veröffentlichten Umlagerung von Homocuban (C9H10)[5] zu Homocunean[6] und Basketan (C10H12) zu Snoutan.[7][8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bei 180 bis 200 °C wird Cunean über Semibullvalen als Zwischenstufe zu Cyclooctatetraen isomerisiert:[9]

Molekulare Geometrie
[Bearbeiten | Quelltext bearbeiten]Die Kohlenstoffe des Cuneans bilden einen Hexaeder mit der Punktgruppe C2v. Auf Grund der Symmetrie existieren 3 Gruppen äquivalenter Kohlenstoffatome (A, B, C), welche durch NMR-Spektroskopie nachgewiesen werden konnten.[10][11]

Derivate
[Bearbeiten | Quelltext bearbeiten]Einige Cuneanderivate haben flüssigkristalline Eigenschaften.[12] Weiterhin existieren auch Koordinationsverbindungen, die die Geometrie des Cuneans aufweisen, jedoch statt der CH-Gruppen Metallatome wie Nickel auf den Ecken des Hexagons tragen.[13]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Philip E. Eaton, Luigi. Cassar, Jack. Halpern: Silver(I)- and palladium(II)-catalyzed isomerizations of cubane. Synthesis and characterization of cuneane. In: Journal of the American Chemical Society. Band 92, Nr. 21, Oktober 1970, S. 6366–6368, doi:10.1021/ja00724a061.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ R. Criegee, R. Askani: Octamethyl-semibullvalen. In: Angewandte Chemie. Band 80, Nr. 13, Juli 1968, S. 531, doi:10.1002/ange.19680801304.
- ↑ Christoph Ruecker, Bjoern Trupp: Pentacyclo[5.1.0.02,4.03,5.06,8]octane (octabisvalene). In: Journal of the American Chemical Society. Band 110, Nr. 14, 1988, S. 4828–4829, doi:10.1021/ja00222a051.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Homocuban: CAS-Nr.: 452-61-9, PubChem: 136294, ChemSpider: 120068, Wikidata: Q82945203.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Homocunean: CAS-Nr.: 13084-56-5, PubChem: 139382, ChemSpider: 122909, Wikidata: Q82901551.
- ↑ Leo A. Paquette, John C. Stowell: Silver ion catalyzed rearrangements of strained σ bonds. Application to the homocubyl and 1,1′-bishomocubyl systems. In: Journal of the American Chemical Society. Band 92, Nr. 8, April 1970, S. 2584–2586, doi:10.1021/ja00711a082.
- ↑ W.G. Dauben, M.G. Buzzolini, C.H. Schallhorn, D.L. Whalen, K.J. Palmer: Thermal and silver ion catalyzed isomerization of the 1,1′-bishomocubane system: preparation of a new C10H10isomer. In: Tetrahedron Letters. Band 11, Nr. 10, Januar 1970, S. 787–790, doi:10.1016/S0040-4039(01)97830-X.
- ↑ Karin Hassenrück, Hans-Dieter Martin, Robin Walsh: Thermal Behaviour of C8H8 Hydrocarbons Gas-Phase Thermolysis of Cuneane, a New Example of a High-Strain Energy Release Process. In: Chemische Berichte. Band 121, Nr. 2, Februar 1988, S. 369, doi:10.1002/cber.19881210225.
- ↑ Harald Günther, Wolfgang Herrig: Anwendungen der 13C-Resonanz-Spektroskopie, X.13C,13C-Kopplungskonstanten in Methylencycloalkanen. In: Chemische Berichte. Band 106, Nr. 12, Dezember 1973, S. 3938–3950, doi:10.1002/cber.19731061217.
- ↑ M. I. Trofimov, E. A. Smolenskii: Electronegativity of atoms of ring-containing molecules—NMR spectroscopy data correlations: a description within the framework of topological index approach. In: Russian Chemical Bulletin. Band 49, Nr. 3, März 2000, S. 402–407, doi:10.1007/BF02494766.
- ↑ Gyula Bényei, István Jalsovszky, Dietrich Demus, Krishna Prasad, Shankar Rao: First liquid crystalline cuneane‐caged derivatives: a structure–property relationship study. In: Liquid Crystals. Band 33, Nr. 6, Juni 2006, S. 689–696, doi:10.1080/02678290600722940.
- ↑ Andrew Stephenson, Michael D. Ward: An octanuclear coordination cage with a ‘cuneane’ core—a topological isomer of a cubic cage. In: Dalton Transactions. Band 40, Nr. 31, 2011, S. 7824, doi:10.1039/c0dt01767a.