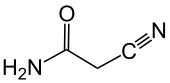
Cyanacetamid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cyanacetamid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H4N2O | ||||||||||||||||||
| Kurzbeschreibung |
schwach gelblicher bis weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 84,077 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,061–1,062g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Cyanacetamid ist ein Feststoff und ein Derivat der Essigsäure. Es weist als Amid der Cyanessigsäure eine Nitril-, eine CH-acide Methylengruppe und eine Amidfunktion im Molekül auf.
Gewinnung und Darstellung
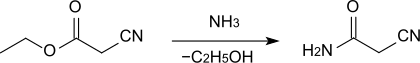
[Bearbeiten | Quelltext bearbeiten]Cyanacetamid wird durch Umsetzung von Cyanessigsäureethylester mit konzentriertem wässrigem Ammoniak in 86–88%iger Ausbeute erhalten.[1]
Eine neuere Synthese ist die Umsetzung von Halogenacetamiden mit Alkalicyaniden in Gegenwart von Wasser.[4]
Reaktionen und Verwendung
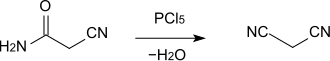
[Bearbeiten | Quelltext bearbeiten]Cyanacetamid dient als Ausgangsstoff für die Herstellung verschiedener anderer Verbindungen, beispielsweise von Malonsäuredinitril, wobei die Amidgruppe durch Reaktion mit Phosphorpentachlorid (PCl5) oder Phosphorylchlorid (POCl3) zur Nitrilgruppe dehydratisiert wird.[5] Die Reaktion kann auch in 1,2-Dichlorethan als Lösemittel durchgeführt werden.[6]
Cyanacetamid unterliegt einer Keto-Enol-Tautomerie und reagiert leicht mit Halogenen.[7] Die Umsetzung mit Brom führt zum – inzwischen obsoleten – Biozid 2,2-Dibromcyanacetamid DBNPA.

Die Cyclokondensation von 1,3-Diketonen mit Cyanacetamid liefert in einer Guareschi-Thorpe-Reaktion 3-Cyano-2-pyridone. Nachfolgende Hydrolyse der Cyanogruppe in wässriger Säure, Decarboxylierung, Chlorierung und katalytische Hydrierung führt zu 2,4-Dialkylpridinen.[8]

Ein Syntheseweg zum Gichtmittel Allopurinol geht von Cyanacetamid aus, das mit Formamidin[S 1] und nachfolgendem Ringschluss mit Hydrazin ein substituiertes Pyrazol ergibt, das mit Formamid zum Pyrazolo-pyrimidin Allopurinol cyclisiert wird.[9] In der Synthese des Antituberkulotikums Ethionamid dient Cyanacetamid als Edukt.[10]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d B. B. Corson, R. W. Scott, and C. E. Vose: Cyanoacetamide In: Organic Syntheses. 9, 1929, S. 36, doi:10.15227/orgsyn.009.0036; Coll. Vol. 1, 1941, S. 179 (PDF).
- ↑ a b c Datenblatt Cyanacetamid bei Merck, abgerufen am 13. Februar 2010.
- ↑ a b Datenblatt Cyanoacetamide bei Sigma-Aldrich, abgerufen am 24. Februar 2018 (PDF).
- ↑ Patent DE2538254C2: Verfahren zur Herstellung von Cyanacetamiden. Angemeldet am 28. August 1975, veröffentlicht am 7. Juni 1984, Anmelder: BASF AG, Erfinder: Hans-Jürgen Quadbeck-Seeger.
- ↑ B. B. Corson, R. W. Scott, and C. E. Vose: Malononitrile In: Organic Syntheses. 10, 1930, S. 66, doi:10.15227/orgsyn.010.0066; Coll. Vol. 2, 1943, S. 379 (PDF).
- ↑ Alexander R. Surrey: Malononitrile In: Organic Syntheses. 25, 1945, S. 63, doi:10.15227/orgsyn.025.0063; Coll. Vol. 3, 1955, S. 535 (PDF).
- ↑ Alex Eberlin, D. Lyn H. Williams: Halogenation of enol tautomers of 2-cyanoacetamide and malonamic acid. In: Journal of the Chemical Society, Perkin Transactions 2. Nr. 7, 27. Juni 2002, S. 1316–1319, doi:10.1039/b202542f.
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. 5., überarb. Auflage. Thieme, Stuttgart, New York 2005, ISBN 3-13-541505-8.
- ↑ A. Kleemann, J. Engel: Pharmazeutische Wirkstoffe, 2. Aufl., Georg Thieme, Stuttgart - New York, 1982.
- ↑ Gowri Sankar Reddipalli, Singavarapu Adilakshmi, Ghojala Venkat Reddy, Guddeti Chandrashekar Reddy: Identification, Synthesis and Characterization of Potential Process Related Impurity of Ethionamide. In: SSRN Electronic Journal. 2022, doi:10.2139/ssrn.4082777.
