Cyclohexenoxid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cyclohexenoxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H10O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 98,145 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,97 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
ca. 130 °C[1] | ||||||||||||||||||
| Dampfdruck |
12 mbar (bei 20 °C)[1] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
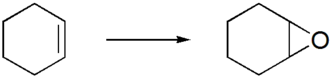
Cyclohexenoxid ist ein cycloaliphatisches Epoxid. Es kann in kationischer Polymerisation zu Poly(cyclohexenoxid) reagieren. Da Cyclohexenoxid monovalent ist, ist Poly(cyclohexenoxid) ein Thermoplast.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Cyclohexenoxid wird in einer Epoxidierung aus Cyclohexen hergestellt. Die Epoxidierung kann entweder in einem homogenen Reaktionsmedium durch Persäuren stattfinden[2] oder heterogen katalysiert (z. B. durch Silber mit molekularem Sauerstoff):[3][4][5]
In der industriellen Herstellung ist die heterogen katalysierte Herstellung bevorzugt, aufgrund besserer Atomökonomie, einer einfacheren Abtrennung des Produktes und leichtem Recycling des (verbrauchten) Katalysators. Ein kurzer Überblick über die Oxidation von Cyclohexen durch Wasserstoffperoxid ist in der Literatur gegeben.[6] In jüngster Zeit wurde gefunden, dass die katalytische Oxidation durch immobilisierte Metalloporphyrin-Komplexe eine effiziente Möglichkeit darstellt.[7][8]
Stereochemie
[Bearbeiten | Quelltext bearbeiten]Das Molekül weist zwei Stereozentren auf. Es gibt von Cyclohexenoxid zwei Enantiomere sowie die meso-Form.
Analyse
[Bearbeiten | Quelltext bearbeiten]Cyclohexenoxid wurde ausführlich mit analytischen Methoden untersucht. Ein guter Überblick ist in der Literatur gegeben.[9] Eine Studie zur Polymerisation von Cyclohexenoxid in Lösung und die IR-, 1H-NMR- und MALDI-TOF-Spektren des Produktes zusammen mit den SEC-Chromatogrammen finden sich in der Literatur.[10]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Eintrag zu 1,2-Epoxycyclohexan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ M. Quenard, V. Bonmarin, G. Gelbard: Epoxidation of olefins by hydrogen peroxide catalyzed by phosphonotungstic complexes. In: Tetrahedron Letters. Band 28, Nr. 20, Januar 1987, S. 2237–2238, doi:10.1016/S0040-4039(00)96089-1.
- ↑ Ha Q. Pham, Maurice J. Marks: Epoxy Resins. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 15. Oktober 2005, doi:10.1002/14356007.a09_547.pub2.
- ↑ Siegfried Rebsdat, Dieter Mayer: Ethylene Oxide. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2001, ISBN 978-3-527-30673-2, doi:10.1002/14356007.a10_117.
- ↑ Franca Morazzoni, Carmen Canevali, Fiorenza D'Aprile, Claudia L. Bianchi, Ezio Tempesti, Luigi Giuffrè, Giuseppe Airoldi: Spectroscopic investigation of the molybdenum active sites on Mo VI heterogeneous catalysts for alkene epoxidation. In: Journal of the Chemical Society, Faraday Transactions. Band 91, Nr. 21, 1995, S. 3969–3974, doi:10.1039/FT9959103969.
- ↑ V. K. Ambili, S. Sugunan: Studies on Catalysis by Ordered Mesoporous SBA-15 Materials Modified with Transition Metals. Hrsg.: Faculty of Sciences. (cusat.ac.in [abgerufen am 27. Juli 2014]).
- ↑ Andréia A. Costa, Grace F. Ghesti, Julio L. de Macedo, Valdeilson S. Braga, Marcello M. Santos, José A. Dias, Sílvia C.L. Dias: Immobilization of Fe, Mn and Co tetraphenylporphyrin complexes in MCM-41 and their catalytic activity in cyclohexene oxidation reaction by hydrogen peroxide. In: Journal of Molecular Catalysis A: Chemical. Band 282, Nr. 1-2, März 2008, S. 149–157, doi:10.1016/j.molcata.2007.12.024.
- ↑ Xian-Tai Zhou, Hong-Bing Ji, Jian-Chang Xu, Li-Xia Pei, Le-Fu Wang, Xing-Dong Yao: Enzymatic-like mediated olefins epoxidation by molecular oxygen under mild conditions. In: Tetrahedron Letters. Band 48, Nr. 15, April 2007, S. 2691–2695, doi:10.1016/j.tetlet.2007.02.066.
- ↑ Richard M. Ibberson, Osamu Yamamuro, Itaru Tsukushi: The crystal structures and phase behaviour of cyclohexene oxide. In: Chemical Physics Letters. Band 423, Nr. 4–6, Juni 2006, S. 454–458, doi:10.1016/j.cplett.2006.04.004.
- ↑ Ahmed Yahiaoui, Mohammed Belbachir, Jeanne Claude Soutif, Laurent Fontaine: Synthesis and structural analyses of poly (1, 2-cyclohexene oxide) over solid acid catalyst. In: Materials Letters. Band 59, Nr. 7, März 2005, S. 759–767, doi:10.1016/j.matlet.2004.11.017.


