Truncus-coeliacus-Kompressionssyndrom
| Klassifikation nach ICD-10 | |
|---|---|
| I77.4 | Arteria-coeliaca-Kompressions-Syndrom |
| ICD-10 online (WHO-Version 2019) | |
Das Truncus-coeliacus-Kompressionssyndrom, auch als Harjola-Marable-Syndrom, Dunbar-Syndrom oder Ligamentum-arcuatum-Syndrom bezeichnet, äußert sich durch Bauchschmerzen und wird durch Einklemmung der Arteria coeliaca (Truncus coeliacus) und möglicherweise des Ganglion coeliacum durch das Zwerchfell verursacht.[1] Die Bauchschmerzen können im Zusammenhang mit Nahrungsaufnahme stehen und von einem Gewichtsverlust begleitet sein. Bei der Auskultation des Bauches hört man öfter typische Stenosegeräusche.
Die Diagnose des Truncus-coeliacus-Kompressionssyndroms ist eine Ausschlussdiagnose, denn viele Menschen haben diese Form der Einklemmung, ohne jedoch Beschwerden zu entwickeln. Deshalb kann die Diagnose erst nach Ausschluss anderer Ursachen gestellt werden. Zum Screening dient die Duplexsonographie, die Bestätigung der Diagnose erfolgt mittels Computertomographie (CT) oder Magnetresonanztomographie (MRT).
Die Behandlung erfolgt chirurgisch. Das Ligament wird durchtrennt und so der Hiatus aorticus erweitert. Unter Umständen wird zusätzlich das Ganglion coeliacum entfernt. Die Mehrzahl der Patienten profitiert von der Operation. Die Erfolgsrate ist geringer bei jüngeren Patienten, Patienten mit psychiatrischen Erkrankungen, Patienten mit erhöhtem Alkoholkonsum, Patienten ohne Gewichtsverlust und bei Patienten, die keine Schmerzen im Zusammenhang mit den Mahlzeiten haben.
Anatomie und Pathogenese
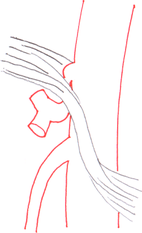
[Bearbeiten | Quelltext bearbeiten]Das Ligamentum arcuatum medianum entspringt an der Basis des Zwerchfelles, dort wo der rechte und linke Zwerchfellschenkel (Crus dextrum et sinistrum) etwa in Höhe des 12. Brustwirbels zusammenkommen. Dieser Gewebebogen bildet die Vorderseite des Hiatus aorticus, durch den die Aorta mit dem Plexus aorticus abdominalis und der Ductus thoracicus ziehen.[2] Normalerweise sitzt das Ligamentum oberhalb des Abgangs des Truncus coeliacus, bei etwa 25 % der Menschen kreuzt das Ligament jedoch auf Höhe des Abgangs und engt dadurch die Arterie und benachbarte Strukturen, wie das Ganglion coeliacum ein. Bei einigen ist die Einengung so stark, dass die Krankheitssymptome entstehen.[1][3]
Verschiedene Theorien versuchen die Schmerzen infolge der Kompression zu erklären.[4] Eine vermutet als Ursache der Schmerzen die Minderdurchblutung (Ischämie) der versorgten Bauchorgane, eine andere geht von der Kompression des Ganglion coeliacum aus.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Eine Kompression des Truncus wurde erstmals durch Benjamin Lipshutz 1917 beobachtet. Das Truncus-coeliacus-Kompressionssyndrom wurde 1963 durch Pekka-Tapani Harjola beschrieben[5] und zwei Jahre später auch durch J. David Dunbar und Samuel Marable.[6]
Epidemiologie
[Bearbeiten | Quelltext bearbeiten]Nur etwa 1 % der Menschen, bei denen das Ligament auf Höhe des Truncus kreuzt, leiden an einem Truncus-coeliacus-Kompressionssyndrom.[1] Die Beschwerden betreffen überwiegend Patienten im Alter zwischen 20 und 40 Jahren, zumeist Frauen, bevorzugt von schmalerem Körperbau.[1]
Beschwerdebild
[Bearbeiten | Quelltext bearbeiten]Die betroffenen Personen beklagen Übelkeit und brennende, krampfartige Schmerzen, die oft im Epigastrium angesiedelt sind und nicht selten im Zusammenhang mit Mahlzeiten auftreten.[2] Die Schmerzen können zu einem Gewichtsverlust bis hin zur Abmagerung führen.[1] Gelegentlich lässt sich ein Stenosegeräusch im Epigastrium auskultieren.[1] Komplikationen entstehen aus der Kompression der Arterie, wie z. B. eine Magenlähmung[7] oder eine aneurysmatische Erweiterung der Arteria pancreaticoduodenalis superior, die wegen ihrer Verbindung über die Arteria pancreaticoduodenalis inferior zur A. mesenterica superior als Kollaterale dient.[8]
Diagnostik
[Bearbeiten | Quelltext bearbeiten]| CT-angiographische Befunde beim Truncus-coeliacus-Kompressionssyndrom[1] |
|---|
|
Die Ausschlussdiagnostik umfasst unter anderem Ösophago-Gastro-Duodenoskopie und Koloskopie. Dabei müssen auch Gallenbeschwerden und eine Refluxösophagitis ausgeschlossen werden.[4] Die Diagnose fußt letztlich auf der Kombination des Beschwerdebildes mit der radiologischen Diagnostik. Die klassische Trias Bauchschmerzen-Gewichtsverlust-Stenosegeräusch findet sich jedoch nur bei wenigen Patienten. Die radiologische Diagnostik ist eingeteilt in:
- Screening: Duplexsonographie zur Messung des Blutflusses im Truncus coeliacus. Eine Blutflussgeschwindigkeit von > 200 cm/s gilt als verdächtig.[9][4]
- Diagnostik: früher erfolgte zur Sicherung der Diagnose eine Angiographie, welche heute durch eine CT-Angiographie oder MRT-Angiographie ersetzt wurde, wobei die CT-Untersuchung wegen der besseren Darstellung der benachbarten Bauchorgane bevorzugt wird.[4]

Die Befunde einer kurzstreckigen Einengung des Truncus coeliacus an seinem Abgang mit nachfolgender Erweiterung (poststenotische Dilatation), einer Einkerbung im oberen Aspekt des Truncus und eines hakenförmigen Verlaufes des Truncus unterstützen die Diagnose eines Truncus-coeliacus-Kompressionssyndroms.[1] Diese Bildkriterien sind in Exspiration betont und finden sich zum Teil sogar bei asymptomatischen Patienten, die nicht an dem Syndrom leiden.[1]
Auch müssen andere mögliche Differenzialdiagnosen bei einer abgangsnahen Einengung mit poststenotischer Dilatation, wie zum Beispiel arteriosklerotische Veränderungen, berücksichtigt werden.[1] Hier kann der hakenförmige Verlauf des Truncus coeliacus für die Unterscheidung hilfreich sein, wenn auch dieses Kriterium ebenfalls nicht pathognomonisch für das Truncus-coeliacus-Kompressionssyndrom ist. Die Häufigkeit für diese Anatomie bei normalen asymptomatischen Personen wird mit 10 bis 24 % angegeben.[1]
Therapie
[Bearbeiten | Quelltext bearbeiten]Die Dekompression des Truncus ist die Therapie der Wahl.[4][10] Meist erfolgt dies durch eine Laparotomie mit dem Ziel, das Ligament von der Arterie abzulösen[4] Zugleich wird das Ganglion coeliacum entfernt und der Blutfluss der befreiten Arterie mittels Duplexsonographie kontrolliert. Bei weiterbestehendem vermindertem Blutfluss können eine Revaskularisation durch einen Bypass oder andere gefäßchirurgische Interventionen erforderlich sein.[4][10]
Die Dekompression kann auch über einen laparoskopischen Zugang erfolgen, bei erforderlicher Revaskularisation des Truncus muss jedoch auf den offenen Zugang gewechselt werden.[11]
Endoskopische Verfahren wie die Perkutane transluminale Angioplastie (PTA) sind bei Patienten angewendet worden, bei denen der offene oder laparoskopische Zugang nicht möglich war, wobei die PTA alleine, ohne Dekompression der Arterie durch das Ligament, nicht erfolgreich war.[4][12]
Prognose
[Bearbeiten | Quelltext bearbeiten]Es gibt nur wenige Studien über Langzeitergebnisse der Behandlung von Patienten mit Truncus-coeliacus-Kompressionssyndrom. In der Arbeit von Duncan[4] wird über eine Studie von 51 Patienten berichtet, die über einen offenen Zugang operiert wurden. 44 dieser Patienten konnten über einen Zeitraum von neun Jahren nachbeobachtet werden.[13] 75 % der Patienten, bei denen sowohl eine Dekompression als auch eine Revaskularisation erfolgte, blieben symptomfrei. Als Prädiktoren für einen guten Erfolg wurden genannt:
- Alter zwischen 40 und 60 Jahren
- keine psychiatrischen Auffälligkeiten und Alkoholabstinenz
- erlittener Gewichtsverlust >9 kg
Auch eine neuere Studie von 2009 gibt die Erfolgsquote bei operativer Therapie mit ca. 70–75 % an.[10]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k K. M. Horton, M. A. Talamini, E. K. Fishman: Median arcuate ligament syndrome: evaluation with CT angiography. In: Radiographics. Band 25, Nr. 5, 2005, S. 1177–1182, doi:10.1148/rg.255055001, PMID 16160104.
- ↑ a b B. Luther: Truncus-coeliacus-Kompressionssyndrom. In: Wolfgang Hepp, Helmut Kogel (Hrsg.): Gefäßchirurgie. Elsevier, Urban & Fischer, München/ Jena 2006, ISBN 3-437-21841-7 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. H. Lindner, E. Kemprud: A clinicoanatomical study of the arcuate ligament of the diaphragm. In: Arch Surg. Band 103, Nr. 5, November 1971, S. 600–605, PMID 5117015.
- ↑ a b c d e f g h i A. A. Duncan: Median arcuate ligament syndrome. In: Curr Treat Options Cardiovasc Med. Band 10, Nr. 2, April 2008, S. 112–116, doi:10.1007/s11936-008-0012-2, PMID 18325313.
- ↑ P. T. Harjola: A rare obstruction of the coeliac artery. Report of a case. In: Ann Chir Gynaecol Fenn. Band 52, 1963, S. 547–550, PMID 14083857.
- ↑ J. D. Dunbar, W. Molnar, F. F. Beman, S. A. Marable: Compression of the celiac trunk and abdominal angina. In: Am J Roentgenol Radium Ther Nucl Med. Band 95, Nr. 3, November 1965, S. 731–744, PMID 5844938 (ajronline.org).
- ↑ D. H. Balaban, J. Chen, Z. Lin, C. G. Tribble, R. W. McCallum: Median arcuate ligament syndrome: a possible cause of idiopathic gastroparesis. In: Am. J. Gastroenterol. Band 92, Nr. 3, März 1997, S. 519–523, PMID 9068484.
- ↑ N. E. Manghat, G. Mitchell, C. S. Hay, I. P. Wells: The median arcuate ligament syndrome revisited by CT angiography and the use of ECG gating--a single centre case series and literature review. In: Br J Radiol. Band 81, Nr. 969, September 2008, S. 735–742, doi:10.1259/bjr/43571095, PMID 18541631.
- ↑ I. A. Sproat, M. A. Pozniak, T. W. Kennell: US case of the day. Median arcuate ligament syndrome (celiac artery compression syndrome). In: Radiographics. Band 13, Nr. 6, November 1993, S. 1400–1402, PMID 8290734.
- ↑ a b c D. Grotemeyer, M. Duran, F. Iskandar, D. Blondin, K. Nguyen, W. Sandmann: Median arcuate ligament syndrome: vascular surgical therapy and follow-up of 18 patients. In: Langenbecks Arch Surg. Band 394, Nr. 6. Springer-Verlag, 2009, S. 1085–1092, doi:10.1007/s00423-009-0509-5, PMID 19506899.
- ↑ A. M. Carbonell, K. W. Kercher, B. T. Heniford, B. D. Matthews: Multimedia article. Laparoscopic management of median arcuate ligament syndrome. In: Surg Endosc. Band 19, Nr. 5, Mai 2005, S. 729, doi:10.1007/s00464-004-6010-x, PMID 15965588.
- ↑ A. H. Matsumoto, C. J. Tegtmeyer, E. K. Fitzcharles u. a.: Percutaneous transluminal angioplasty of visceral arterial stenoses: results and long-term clinical follow-up. In: J Vasc Interv Radiol. Band 6, Nr. 2, 1995, S. 165–174, doi:10.1016/S1051-0443(95)71087-9, PMID 7787348.
- ↑ L. M. Reilly, A. D. Ammar, R. J. Stoney, W. K. Ehrenfeld: Late results following operative repair for celiac artery compression syndrome. In: J. Vasc. Surg. Band 2, Nr. 1, Januar 1985, S. 79–91, PMID 3965762 (Artikel Volltext).