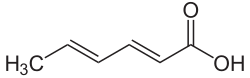
Sorbinsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Sorbinsäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C6H8O2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer, geruchsloser[3] Feststoff[4] mit schwach saurem, kratzendem Geschmack[5] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 112,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,2 g·cm−3 (bei 20 °C)[4] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
228 °C (Zersetzung)[4] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
4,76 (20 °C)[5] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Die Sorbinsäure ist eine zweifach ungesättigte, kurzkettige sowie konjugierte Fettsäure bzw. Carbonsäure in der Gruppe der Alkadiene. Sie wird sowohl als freie Säure unter der in der EU gültigen Bezeichnung E 200 als auch in Form ihrer Salze – der Sorbate – als Konservierungsmittel bzw. Lebensmittelzusatzstoff verwendet.
Eigenschaften der Säure
[Bearbeiten | Quelltext bearbeiten]Sorbinsäure ist in kaltem Wasser nur schlecht, in heißem Wasser dagegen gut löslich. Gut löslich ist die Sorbinsäure auch in Alkoholen, konzentrierter Essigsäure (Eisessig), Aceton und Toluol.[5] Sie absorbiert Licht bei einem Maximum von 264 nm, der pKs-Wert ist 4,76. Die Säure besitzt einen schwach sauren, „kratzenden“ Geschmack[5], der jedoch bei den für die Konservierung von Lebensmitteln eingesetzten Konzentrationen nicht wahrnehmbar ist.[7] Der Flammpunkt liegt bei 127 °C, die Zündtemperatur bei 415 °C.[4]
Synthese
[Bearbeiten | Quelltext bearbeiten]Im Labor erfolgt die Darstellung von Sorbinsäure durch die Doebner-Variante der Knoevenagel-Kondensation. Dazu wird Malonsäure in Pyridin gelöst, dann mit Crotonaldehyd und Piperidin (als Katalysator) umgesetzt. Eine andere Möglichkeit ist die Umsetzung von Keten und 2-Butenal in einem inerten Lösungsmittel und einem Katalysator (zum Beispiel einem Zink(II)-Salz). Dabei erhält man einen polymeren Ester der 3-Hydroxy-4-hexensäure, der durch Erhitzen oder Alkali-Behandlung in Sorbinsäure überführt werden kann.
Natürliches Vorkommen
[Bearbeiten | Quelltext bearbeiten]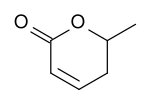
In der Natur ist eine Vorstufe der Sorbinsäure, die Parasorbinsäure, in Vogelbeeren enthalten. Die Vogelbeere Sorbus aucuparia war auch der Namensgeber der Sorbinsäure. Das Lacton heißt korrekt 5,6-Dihydro-6-methyl-2H-pyran-2-on und ist eine ölige Flüssigkeit mit süßlich-aromatischem Geruch. Aus dieser, früher als Sorbinöl bezeichneten Verbindung wurde 1859 erstmals freie Sorbinsäure dargestellt.[8][9] Schließlich kommt Sorbinsäure chemisch gebunden im Fett einiger Blattlausarten (Aphiden) vor.
Verwendung als Konservierungsstoff
[Bearbeiten | Quelltext bearbeiten]Sorbinsäure wird hauptsächlich als Konservierungsstoff für Lebens- und Futtermittel, Arzneimittel, Kosmetika und Reinigungsmittel benutzt. Eingesetzt wird Sorbinsäure selbst (E 200) oder eines ihrer besser wasserlöslichen Salze. Von industrieller Bedeutung sind Kaliumsorbat (E 202) und Calciumsorbat (E 203). Natriumsorbat (E 201) ist oxidationsempfindlich und wird industriell nicht hergestellt. Sorbinsäure ist im Gegensatz zu Benzoesäure geruchlich und geschmacklich von vielen Personen nicht wahrnehmbar.
Mit Sorbinsäure werden z. B. Backwaren, Margarine, Käse und Wurstwaren konserviert. Die gesundheitliche Unbedenklichkeit der Sorbinsäure wurde in verschiedenen Fütterungsstudien belegt. Das allergene Potential wird als gering eingestuft, da sie im menschlichen Körper wie eine aus der Nahrung stammende Fettsäure verwertet wird. Sie kann jedoch in seltenen Fällen allergieauslösend wirken und als Säure Schleimhäute oder Haut von sehr empfindlichen Personen reizen. Die erlaubte Tagesdosis von Sorbinsäure liegt bei 25 mg/kg Körpergewicht. Sorbinsäure ist in nahezu allen europäischen Ländern als Lebensmittelzusatzstoff zugelassen und besitzt in den USA den so genannten GRAS-Status.
Ein weiteres wichtiges Anwendungsgebiet ist die Stabilisierung von Wein gegen Nachgärungen durch noch vorhandene Hefen. Bei der Herstellung von Wein ist daher die Zugabe von maximalen 0,2 g/l (Deutschland und Österreich) bzw. 1 g/l (USA) zum Most oder Wein erlaubt. Da die Säure jedoch nicht gegen Milchsäurebakterien wirkt, kann es zu unerwünschten und irreversiblen Geschmacksveränderungen (Geranienton) des Weins kommen, weshalb der Wein meist zusätzlich mit Schwefeldioxid stabilisiert wird.
Die deutsche und die Schweizer Tabakverordnung erlauben den Einsatz von Sorbinsäure als Konservierungsmittel von Tabakprodukten.
Wirkung der Sorbinsäure gegen Mikroorganismen
[Bearbeiten | Quelltext bearbeiten]Sorbinsäure ist eine antimikrobielle Substanz; ihre Wirkung beruht auf verschiedenen Faktoren. Zum einen richtet sie sich gegen verschiedene Enzyme in den Zellen von Mikroorganismen. Hauptsächlich sind davon die Enzyme des Kohlenhydratstoffwechsels wie zum Beispiel das Enzym Emulase betroffen. Darüber hinaus greift Sorbinsäure in den Citratzyklus ein. Dort hemmt sie unter anderem das Enzym Isocitrat-Dehydrogenase, und damit den Schritt von der Isocitronensäure zur Oxalbernsteinsäure, sowie das Enzym α-Ketoglutarat-Dehydrogenase, also die Umsetzung der α-Ketoglutarsäure zur Bernsteinsäure.
Des Weiteren geht Sorbinsäure mit ihren Doppelbindungen kovalente Bindungen mit SH-Gruppen von Enzymen ein, diese werden dadurch inaktiviert. Man geht davon aus, dass die Hemmwirkung der Sorbinsäure gegen die Mikroorganismen auf die Hemmung mehrerer Enzyme zurückgeht. Man nimmt zudem noch an, dass die Sorbinsäure Einwirkungen auf die Zellwand hat. Sie inhibiert nämlich schon bei sehr geringen Konzentrationen die Aufnahme der Aminosäuren wie zum Beispiel Serin oder Alanin.
Damit sie in der Mikroorganismenzelle überhaupt wirksam werden kann, muss sie die Zellwand durchdringen. Vorzugsweise tritt der undissoziierte Säureanteil in die Zelle ein. Dieser ist auch der wichtigste, wenn es um die Wirksamkeit des Stoffes geht. Bei einem pH-Wert von 3,15 können 40 % der vorhandenen Sorbinsäure in das Zellinnere gelangen. Hier zeigt sich die Abhängigkeit der Konservierung vom pH-Wert.
Bei Vorliegen von Sorbinsäure in geringen Konzentrationen und gleichzeitig hohen Keimzahlen können die Mikroorganismen Sorbinsäuren in ihren Stoffwechsel miteinbeziehen. Das bedeutet, dass sich Sorbinsäure nur zur Erhaltung hygienisch einwandfreier Lebensmittel eignet und nicht zur Wiederherstellung von keimfreien Verhältnissen, wie es in der Praxis der Lebensmittelkonservierung sowieso unzulässig ist.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Chemische Lebensmittelkonservierung, Lück, Jager, Springer-Verlag Heidelberg, 3. Auflage 1995, ISBN 3-540-57607-X, Seiten: 158–174.
- Sorbate Food Preservatives, John N. Sofos, CRC Press, 1988, ISBN 0-8493-6786-7.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu E 200: Sorbic acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- ↑ Eintrag zu SORBIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ Natascha van den Höfel, Fabienne Reh, Tanja Jugel: Sorbinsäure. In: DocCheck Flexikon. 4. Juni 2024, abgerufen am 17. August 2024.
- ↑ a b c d e f g h i Eintrag zu Sorbinsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c d e f F. v. Bruchhausen, G. Dannhardt, S. Ebel, A. W. Frahm, E. Hackenthal, U. Holzgrabe: Hagers Handbuch der Pharmazeutischen Praxis. Bd. 9: Stoffe P–Z. 5. Auflage, Birkhäuser/Springer, 1991, ISBN 3-540-52688-9, S. 634.
- ↑ Datenblatt Sorbinsäure bei Merck, abgerufen am 15. März 2021.
- ↑ zusatzstoffe-online.de: Sorbinsäure.
- ↑ A.W. v. Hofmann: Neue flüchte Säure der Vogelbeeren in Ann. Chem. Pharm. 34 (1859) 129–140.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 149 pdf.
