GMP-Synthase
Zur Navigation springen
Zur Suche springen
| GMP-Synthase | ||
|---|---|---|

| ||
| GMP-Synthase-Dimer von E. coli nach PDB 1GPM | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 692 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Name | GMPS | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 6.3.5.2, Ligase | |
| Substrat | ATP + XMP + Glutamin + H2O | |
| Produkte | AMP + PPi + GMP + Glutamat | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 8833 | 229363 |
| Ensembl | ENSG00000163655 | ENSMUSG00000027823 |
| UniProt | P49915 | Q3THK7 |
| Refseq (mRNA) | NM_003875 | NM_001033300 |
| Refseq (Protein) | NP_003866 | NP_001028472 |
| Genlocus | Chr 3: 155.87 – 155.94 Mb | Chr 3: 63.98 – 64.02 Mb |
| PubMed-Suche | 8833 | 229363
|
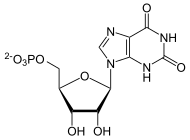
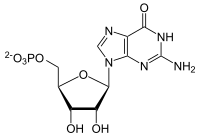
Die GMP-Synthase ist das Enzym in allen Lebewesen, das den letzten Schritt in der De-novo-Synthese von GMP katalysiert: die Umwandlung von Xanthosinmonophosphat (XMP). GMP ist Vorläufer sowohl für das Nukleotid GTP, das ähnlich ATP als Energieträger fungiert, als auch die Purinbase Guanosin, die unentbehrlich im Genom ist.[1]
Die Reaktion findet in zwei Schritten statt: nach der Abspaltung des Polyphosphatrests von ATP folgt die Hydrolyse von Glutamin mit Übertragung der Aminogruppe. Beide Einzelreaktionen werden von je einer eigenen Domäne katalysiert, die beide auf dem Enzym lokalisiert sind. Lediglich manche Archaeen weisen für jede Domäne ein einzelnes Enzym auf.[2]
Katalysierte Reaktion
[Bearbeiten | Quelltext bearbeiten]Aus XMP, ATP und Glutamin entsteht GMP, AMP und Glutaminsäure.
Literatur
[Bearbeiten | Quelltext bearbeiten]- M. Hirst, E. Haliday u. a.: Human GMP synthetase. Protein purification, cloning, and functional expression of cDNA. In: The Journal of biological chemistry. Band 269, Nr. 38, September 1994, S. 23830–23837. PMID 8089153.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]Wikibooks: Biochemie und Pathobiochemie: Purin-Stoffwechsel – Lern- und Lehrmaterialien