Hexachlorphosphazen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexachlorphosphazen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Cl6N3P3 | |||||||||||||||
| Kurzbeschreibung |
hellgraue kristalline Substanz[1] bzw. weißes Kristallpulver[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 347,66 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
löslich in Diethylether, Benzol und Toluol,[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Hexachlorphosphazen oder Phosphornitrilchlorid-Trimer (NPCl2-Trimer) ist eine anorganische Verbindung, die als sechsgliedriger Ring mit alternierenden Phosphor- und Stickstoffatomen mit der Summenformel (NPCl2)3 vorliegt.
Formal entspricht Hexachlorcyclotriphosphazen dem Trimer des hypothetischen Phosphornitrilchlorids NPCl2. Mit Wasser reagiert (NPCl2)3 als anorganisches Säurehalogenid unter Freisetzung von Salzsäure und wirkt daher stark ätzend.
Hexachlorcyclotriphosphazen ist ebenso wie das homologe Octachlorocyclotetraphosphazen (NPCl2)4 Ausgangsverbindung für eine umfangreiche Stoffklasse von anorganischen Polymeren, der Polyphosphazene.[6]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Erste Erwähnung findet die Synthese von Phosphornitrilchloriden (als "Chlorphosphorstickstoff" bezeichnet) aus Phosphorpentachlorid und gasförmigem Ammoniak in einem Briefwechsel von J. v. Liebig und F. Wöhler im Jahr 1832.[7] Die Versuche dazu wurden 1834 publiziert.[8][9]

Die Synthese mit Ammoniumchlorid als Stickstoffquelle wurde 1870 beschrieben.[10] Darin wird bereits auf die Problematik bei Ausbeute und Reinigung des Produkts hingewiesen. Zitat: "Zur Darstellung ist das Erhitzen von Phosphorsuperchlorid (PCl5) und Salmiak (NH4Cl) anzurathen. Die Ausbeute ist sehr gering. Vollkommen rein und schön krystallisirt wird die Substanz nur durch Sublimiren erhalten".
Die Reaktion in Substanz, d. h., in der Schmelze von Phosphorpentachlorid (Smp.: 166,8 °C) lässt sich nicht steuern und liefert auch nach mehrtägigem Erhitzen auf Temperaturen größer 200 °C in geschlossenen Apparaturen nur geringe Ausbeuten (kleiner 15 %) an Hexachlorphosphazen.[5] Unter diesen Reaktionsbedingungen sublimiert PCl5 (Sublimationstemperatur 160,5 °C) und Ammoniumchlorid zersetzt sich merklich. Dabei fallen als Nebenprodukte auch Octachlorphosphazen (NPCl2)4 und ein Öl der Zusammensetzung (NPCl2)x an.[11]
Die niedrigen Ausbeuten an Cyclophosphazenen (38–43 %) auch bei weitgehendem (90–95 %) Umsatz des vorgelegten PCl5 machen Reaktionen in Substanz technisch uninteressant.[12]
Daher wird die Reaktion meist in halogenierten aliphatischen oder aromatischen Lösungsmitteln (für PCl5) wie dem giftigen und destillativ aufwendig zu entfernenden 1,1,2,2-Tetrachlorethan[13] oder bevorzugt in Chlorbenzol mit darin suspendiertem feinteiligem Ammoniumchlorid durchgeführt.[14]
Die Ausbeute von Phosphornitrilchloriden hängt im heterogenen Reaktionsgemisch nicht nur von den Reaktionsbedingungen (Reaktionsmedium, Konzentrationen und Zugabe der Reaktanden, Durchmischung, Temperatur, Reaktionsdauer usw.), sondern insbesondere auch von der Teilchengröße des eingesetzten Ammoniumchlorids ab, auf dessen Oberfläche die Reaktion stattfindet.
Die Reaktion des gelösten PCl5 mit dem suspendierten NH4Cl verläuft in einem zweistufigen Prozess,[15] wobei das in der ersten Stufe rasch und praktisch quantitativ gebildete unlösliche Salz Cl3P=N-PCl3+ PCl6− weiter zu Cl3P=N-PCl2=N-PCl3+ PCl6− reagiert und im zweiten Schritt mit Ammoniumchlorid zu linearen Phosphornitrilchloriden (NPCl2)n reagiert, die dann zu den Cyclophosphazenen cyclisieren können.[16]
Als Produkt fällt ein Gemisch aus kristallinen cyclischen (Trimer, Tetramer, Pentamer) und öligen linearen oligomeren Phosphornitrilchloriden an.
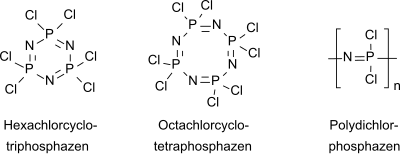
Die angegebenen Produktausbeuten beziehen sich oft auf die kristalline cyclische Fraktion, aus der Hexachlorphosphazen durch Extraktion und Destillation[17] bzw. Schmelzefiltration oder Sublimation[18] in Reinsubstanz isoliert wird.
In der Patentliteratur sind zahlreiche Varianten beschrieben, die darauf abzielen, den Anteil der cyclischen Fraktion im Produktgemisch und insbesondere den Anteil des trimeren Phosphornitrilchlorids (NPCl2)3 (Hexachlorphosphazen) zu erhöhen. So wird z. B. PCl5 in HCl-gesättigtem Chlorbenzol mit Ammoniak bei 130 °C für 4 bis 5 Stunden umgesetzt und man erhält das Gesamtprodukt in einer Ausbeute (bezogen auf PCl5) von 92 %, das 65 bis 75 % cyclische Phosphornitrilchloride enthält, davon 60 bis 75 % des Trimeren.[19]
Die Bindung des bei der Umsetzung von PCl5 mit NH4Cl gebildeten Chlorwasserstoffs durch anorganische, wie z. B. Zinkoxid und organische Basen, wie Pyridin oder Triethylamin als Säurefänger ggf. unter weiterer Zugabe von Metallhalogeniden beschleunigt die Reaktion und erhöht die Produktausbeuten.[20] Dabei entstehen auch salzartige Oligomere der Zusammensetzung [Cl3P=N(PNCl2)n-PCl3]+ PCl6−, die PCl5 der Reaktion zum PNCl2-Trimer entziehen und Zielproduktausbeuten über 100 % suggerieren.
Ein neueres Patent[21] beschreibt die Synthese von NPCl2-Trimer unter Umsetzung eines Phosphorpentachlorid-Pyridin-Komplexes und Reaktion mit feinteiligem Ammoniumchlorid in Chlorbenzol, wonach eine Gesamtausbeute von 98,6 % mit einem Anteil von 84,2 % cyclisches NPCl2-Trimer erzielt wurde.
Wegen der Vielzahl der bei der Reaktion von PCl5 und NH4Cl entstehenden und wegen ihrer unangenehmen Eigenschaften schwer zu handhabenden Produkte mit der Summenformel (NPCl2)n sind daher Angaben zur Ausbeute (und oft auch Reinheit) des erhaltenen cyclischen NPCl2-Trimers in der Literatur kritisch zu bewerten.
Die Abtrennung des im kommerziell erhältlichen Phosphornitrilchlorid-Trimeren enthaltenen (NPCl2)4-Tetrameren erfolgt z. B. durch Umkristallisieren aus n-Hexan und anschließende Vakuumsublimation bei 60 °C.[22]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Hexachlorcyclotriphosphazen bildet bei der Kristallisation aus Benzol zentimetergroße Prismen[5] und aus Diethylether "prachtvolle, durchsichtige, farblose Blätter".[13]
In vielen organischen Lösungsmitteln[23], wie z. B. aliphatischen (n-Hexan) und aromatischen Kohlenwasserstoffen (Benzol, Toluol, Benzolderivate wie Chlorbenzol, Nitrobenzol, Ether Diethylether, Tetrahydrofuran) und in Acetonitril ist Hexachlorphosphazen gut löslich. Die Verbindung besitzt einen relativ hohen Dampfdruck, einen "ziemlich angenehmen organischen Geruch"[14] und reizt Augen und Atemwegsorgane.
In Wasser hydrolysiert PNCl2-Trimer unter HCl-Abspaltung zu Oxo-phosphazenen und weiter unter Ringspaltung zu Phosphorsäure, Ammoniak und Salzsäure.[24]
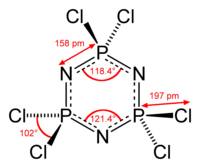
Das Hexachlorcyclotriphosphazen besitzt eine hexagonale planare Ringstruktur mit äquidistanten N-P-Bindungen, die mit 158 pm deutlich kürzer sind als N-P-Einfachbindungen (177 pm). Die Bindungswinkel sind konsistent mit einer sp2-Hybridisierung der Stickstoffatome und (annähernd) einer sp3-Hybridisierung der Phosphoratome. Im Gegensatz zu Benzol sind in den π-Bindungen von Cyclophosphazenen d- und p-Orbitale beteiligt und Cyclophosphazene sind auch deutlich schwerer zu hydrieren als der Aromat Benzol.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Die sechs Chloratome im Hexachlorphosphazen können sukzessive durch nucleophile Substitution von Amino-,[25] Alkyl-, Aryl-, Alkoxy-, Aryloxy-, Alkylamino- und Arylaminogruppen ersetzt werden, wobei Substitutionsort und -grad stark von den gewählten Reaktionsbedingungen, von der Ladungsverteilung im mesomeren Cyclophosphazen-Ringsystem und von sterischen und mechanistischen Effekten abhängen.[13][26][27]
Alkoxy- und Aryloxy-Derivate des Hexachlorphosphazens wurden intensiv auf ihre Eignung als hochtemperaturbeständige und schwer entflammbare Hydraulikflüssigkeiten und Schmieröle hin untersucht.[28] Dabei erfüllten in einer Eintopfreaktion gewonnene gemischte Ester mit Trifluorethanol, Phenol, m-Kresol und p-Kresol der ungefähren Zusammensetzung:
- N3P3(OCH2CF3)3,5(OC6H5)1,25(OC6H4-m-CH3)0,87(OC6H4-p-CH3)0,38
mit einem Aryloxy-/Fluoralkoxy-Verhältnis 2,5 : 3,5 am besten die Anforderungen an Viskosität, Pourpoint, thermische und hydraulische Stabilität sowie Verträglichkeit mit Kunststoffen und lackierten Oberflächen.
Das fluoranaloge Hexafluorcyclotriphosphazen (NPF2)3 aus NPCl2-Trimer und NaF bei Raumtemperatur in Acetonitril als Lösungsmittel gebildet[29] während das bromanaloge Hexabromcyclophosphazen (NPBr2)3 wie (NPCl2)3 aus dem Phosphorpentahalogenid, in diesem Fall aus PBr5 und NH4Br, zugänglich ist.
Die wichtigste Verwendung von Hexachlorphosphazen ist als Ausgangsverbindung für lineares Polydichlorphosphazen (in vernetzter Form oft als "anorganischer Gummi" bezeichnet) und für funktionalisierte Polyphosphazene,
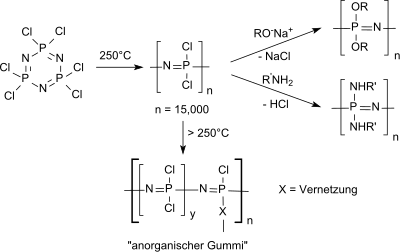
die aufgrund ihrer außergewöhnlichen Eigenschaften vielfältige Anwendungen finden, wie z. B. bei der Energiespeicherung (Lithiumionenbatterien, in Brennstoffzellen), in der Photonik (Photoluminiszenz), als nicht-linear optische (NLO)-Materialien, als Flüssigkristalle, in der Photochromie usw., als Hochleistungs-Elastomere und als biomedizinische Polymere.[30]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt Phosphornitrilchlorid Trimer bei Sigma-Aldrich, abgerufen am 25. Januar 2015 (PDF).
- ↑ a b c Datenblatt Phosphonitrilic chloride trimer bei Alfa Aesar, abgerufen am 25. Januar 2015 (Seite nicht mehr abrufbar).
- ↑ Datenblatt Phosphonitrilic chloride, trimer bei Fisher Scientific, abgerufen am 25. Mai 2017 (PDF).
- ↑ a b Eintrag zu Phosphonitrilic Chloride Trimer bei TCI Europe, abgerufen am 25. Januar 2015.
- ↑ a b c H.N. Stokes: On the chloronitriles of phosphorus. In: Amer. Chem. J. Band 17, 1895, S. 275–290 (online).
- ↑ J.E. Mark, H.R. Allcock, R. West: Polyphosphazene, in Inorganic Polymers, Second Edition. Oxford University Press, 2005, ISBN 0-19-513119-3, S. 62–153.
- ↑ A.W. Hofmann (Hrsg.): Aus Justus Liebigs und Friedrich Wöhlers Briefwechsel in den Jahren 1829–1873. Vieweg, 1832, S. 63.
- ↑ H. Rose: Ueber eine Verbindung des Phosphors mit dem Stickstoff. In: Ann. Pharm. Band 11, 1834, S. 129–139, doi:10.1002/jlac.18340110202.
- ↑ J. Liebig: Nachtrag der Redaction. In: Ann. Pharm. Band 11, 1834, S. 139–150, doi:10.1002/jlac.18340110202.
- ↑ H. Wichelhaus: Ueber Chlorphosphorstickstoff. In: Ber. Dtsch. Chem. Ges. Band 3, 1870, S. 163–166, doi:10.1002/cber.18700030155.
- ↑ H.N. Stokes: Ueber Chlorphosphorstickstoff und zwei seiner homologen Verbindungen. In: Ber. Dtsch. Chem. Ges. Band 28, 1895, S. 437–439, doi:10.1002/cber.189502801106.
- ↑ R. Steinman, F.B. Schirmer, Jr., L.F. Audrieth: The preparation and physical properties of trimeric phosphonitrilic chloride. In: J. Amer. Chem. Soc. Band 64, Nr. 10, 1942, S. 2377–2378, doi:10.1021/ja01262a044.
- ↑ a b c R. Schenck, G. Römer: Über die Phosphornitrilchloride und ihre Umsetzungen (I.). In: Ber. dtsch. Chem. Ges. A/B. Band 57, Nr. 8, 1924, S. 1343–1355, doi:10.1002/cber.19240570823.
- ↑ a b H.R. Allcock: Phosphorus-Nitrogen Compounds: Cyclic, Linear and High Polymeric Systems, Chapter 4: Synthesis of the phosphorus-nitrogen skeleton. Academic Press, 1972, ISBN 978-0-12-050560-9, S. 97–133.
- ↑ M. Becke-Goehring, E. Fluck: Der Weg von Phosphorpentachlorid zu den Phosphornitrilchloriden. In: Angew. Chem. Band 74, Nr. 11, 1962, S. 382–386, doi:10.1002/ange.19620741104.
- ↑ J. Emsley, P.B. Udy: Elucidation of the reaction of phosphorus pentachloride and ammonium chloride by phosphorus-31 nuclear magnetic resonance spectroscopy. In: J. Chem. Soc. A. 1970, S. 3025–3029, doi:10.1039/J19700003025.
- ↑ Patent US4605539: Phosphonitrile chloride trimer purification. Angemeldet am 16. November 1984, veröffentlicht am 12. August 1986, Anmelder: Ethyl Corp., Erfinder: J.R. Adams Jr., J.R. Mitrano, M.K. Juneau.
- ↑ Patent EP0185173A2: Method for purifying cyclic hexachlorophazene trimer for catalytic impurities. Angemeldet am 28. Oktober 1985, veröffentlicht am 25. Juni 1986, Anmelder: The Firestone Tire & Rubber Co., Erfinder: D.F. Graves, D.L. Snyder.
- ↑ Patent DE2328536: Verfahren zur Herstellung von Phosphornitrilchlorid. Angemeldet am 5. Juni 1973, veröffentlicht am 20. Dezember 1973, Anmelder: Ethyl Corp., Erfinder: C.R. Bergeron, J.T.-F. Kao.
- ↑ Patent US4567028: Process for the preparation of phosphonitrile chloride oligomer. Angemeldet am 11. Februar 1985, veröffentlicht am 28. Januar 1986, Anmelder: Shin Nisso Kako Co., Ltd., Erfinder: H. Tanino, T. Okamoto, S. Ueyama.
- ↑ Patent US4656017: Pyridine phosphonitrilic halide process. Angemeldet am 19. Juli 1985, veröffentlicht am 7. April 1987, Anmelder: Ethyl Corp., Erfinder: H.R. Allcock, S.J. Stinnett, J.B. Tedder, Jr., J.R. Adams, Jr..
- ↑ R. Koci Voznicova, J. Taraba, J. Prihoda, M. Alberti: The synthesis and characterization of new aminoadamantane derivatives of hexachloro-cyclo-triphosphazene. In: Polyhedron. Band 27, 2008, S. 2077–2082, doi:10.1016/j.poly.2008.04.001.
- ↑ N.-N. Tian, L.-S. Wang, M.-Y. Li, Y. Li, R.-Y. Jiang: Solubilities of Phenylphosphinic Acid, Methylphenylphosphinic Acid, Hexachlorocyclotriphosphazene, and Hexaphenoxycyclotriphosphazene in Selected Solvents. In: J. Chem. Data. Band 56, Nr. 3, 2011, S. 661–670, doi:10.1021/je1009812.
- ↑ F.F. Stewart, E.S. Peterson: Handbook of Ring-Opening Polymerization, Chapter 4: Sulfur-Nitrogen-Phosphorus-Containing Polymers. Hrsg.: P. Dubois, O. Coulembier, J.-M. Raquez. Wiley-VCH, 2009, ISBN 978-3-527-31953-4, S. 97–122.
- ↑ G.R. Feistel, M.K. Feldt, R.L. Dieck, T. Moeller: Inorganic Syntheses, Volume XIV. Mc Graw-Hill, 1973, Chapter One: Phosphorus Compounds, S. 23–27, doi:10.1002/9780470132456.
- ↑ S. Ganapathiappan, S.S. Krishnamurty: Studies of phosphazenes. Part 30. Reactions of hexachlorocyclotriphosphazene with aromatic primary amines: interplay of geminal and non-geminal modes of chlorine replacement. In: J. Chem. Soc., Dalton Trans. 1987, S. 579–584, doi:10.1039/DT9870000579.
- ↑ C.W. Allen: Regio- and stereochemical control in substitution reactions of cyclophosphazenes. In: Chem. Rev. Band 91, Nr. 2, 1991, S. 119–135, doi:10.1021/cr00002a002.
- ↑ R.E. Singler, F.J. Gomba: Synthetics, Mineral Oils, and Bio-Based Lubricants: Chemistry and Technology, 2nd. Edit., Chapter 14: Phosphazenes. Hrsg.: L.R. Rudnick. CRC Press, 2013, ISBN 978-1-4398-5537-9, S. 235–244.
- ↑ Patent US20140178752A1: Cyclotriphosphazene compound, method of preparing the same, electrolyte for lithium secondary battery including the cyclotriphosphazene compound, and lithium secondary battery including the electrolyte. Angemeldet am 24. Dezember 2013, veröffentlicht am 26. Juni 2014, Anmelder: Samsung Sdi Co., Ltd., Erfinder: Y.S. Park, H.-S. Yang, Y.-H. Kim, J.-H. Lim, H.-Y. Hwang.
- ↑ The Pennsylvania State University, Applications, online
