Hexachlorpropen
Zur Navigation springen
Zur Suche springen
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
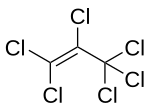
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hexachlorpropen | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3Cl6 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 248,75 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,76 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
209–210 °C (1013 hPa)[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,548 (20 °C, 589 nm)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Hexachlorpropen ist eine chemische Verbindung aus der Gruppe der Chlorkohlenwasserstoffe.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Hexachlorpropen kann durch Dehydrochlorierung von 1,1,1,2,2,3,3-Heptachlorpropan mit Alkalimetallhydroxiden wie Kaliumhydroxid in alkoholischer Lösung gewonnen werden.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Hexachlorpropen ist eine farblose Flüssigkeit, die schwer löslich in Wasser ist.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Hexachlorpropen wird zur Herstellung anderer chemischer Verbindungen wie z. B. Uran(IV)-chlorid oder wasserfreiem Niob(V)-chlorid sowie Wolfram(VI)-chlorid verwendet.[4]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k Datenblatt Hexachlorpropen bei Merck, abgerufen am 21. April 2013.
- ↑ S. D. Gangolli, Royal Society of Chemistry (Great Britain): The Dictionary of Substances and Their Effects: D. Vol.3. Royal Society of Chemistry, 1999, ISBN 0-85404-818-9, S. 607 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Patent US5763705: Method of producing 1,1,1,3,3-pentafluoropropane, a method of producing 1,1,1,3,3-pentafluoro-2-halogeno-3-chloropropane, and a method of producing 1,1,1,2,3,3-hexachloropropene. Angemeldet am 3. Oktober 1997, veröffentlicht am 9. Juni 1998, Anmelder: Daikin Industries Ltd..
- ↑ W. W. Porterfield and S. Y. Tyree, Jr.: Anhydrous metal chlorides. In: S. Young Tyree, Jr. (Hrsg.): Inorganic Syntheses. Band 9. McGraw-Hill Book Company, Inc., 1967, S. 133–136 (englisch).
