Phenylketonurie
| Klassifikation nach ICD-10 | |
|---|---|
| E70.0 | Klassische Phenylketonurie |
| E70.1 | Sonstige Hyperphenylalaninämien |
| ICD-10 online (WHO-Version 2019) | |
Phenylketonurie (PKU), syn. Følling-Krankheit, Föllingsche Krankheit, Phenylbrenztraubensäure-Oligophrenie und Oligophrenia phenylpyruvica, ist eine der häufigsten angeborenen Stoffwechselstörungen. Sie wird autosomal-rezessiv mit einer Inzidenz in Deutschland von etwa 1:8000[1] Neugeborenen vererbt.[2] Betroffene Patienten können die Aminosäure Phenylalanin nicht abbauen, wodurch diese sich im Körper anreichert und Phenylpyruvat, Phenylacetat oder Phenyllactat entsteht, was unbehandelt zu einer schweren geistigen Entwicklungsstörung mit einer Epilepsie führt. Bestimmte Stoffwechselprodukte, die Phenylketone, die mit dem Urin ausgeschieden werden, waren für die Erkrankung namensgebend. Die Erkrankung kann durch eine einfache Reihenuntersuchung schon bei Neugeborenen erkannt werden. Eine rechtzeitig begonnene eiweißarme Diät kann die vorgenannten Symptome verhindern und sollte idealerweise lebenslang durchgeführt werden.
Ursache
[Bearbeiten | Quelltext bearbeiten]Die Phenylketonurie ist eine Störung des Aminosäurestoffwechsels. Sie wird durch erhöhte Konzentrationen der Aminosäure Phenylalanin verursacht, da diese aufgrund des fehlenden Enzyms Phenylalaninhydroxylase (PAH) nicht zu Tyrosin hydroxyliert werden kann. Phenylalanin ist eine essenzielle Aminosäure und muss mit der Nahrung aufgenommen werden; ein stetes Übermaß an vorhandenem Phenylalanin führt zu den unten beschriebenen schweren Schädigungen, insbesondere im heranwachsenden Organismus. Warum diese Substanz einen schädigenden Einfluss auf die Hirnentwicklung hat, ist nicht bekannt. Diskutiert wird, ob die erhöhte Menge Phenylalanin andere Aminosäuren im Wettbewerb um die Transportkapazitäten zur Überwindung der Blut-Hirn-Schranke zurückdrängt. Dies könnte zur Folge haben, dass die körpereigene Herstellung von Proteinen (Proteinbiosynthese) im Gehirn beeinträchtigt ist. Auch die Synthese verschiedener Botenstoffe des Nervensystems (Neurotransmitter) könnte dadurch beeinträchtigt sein.[2] Für die Verdrängung von Tyrosin wurden Hinweise gefunden.[3]
Biochemie
[Bearbeiten | Quelltext bearbeiten]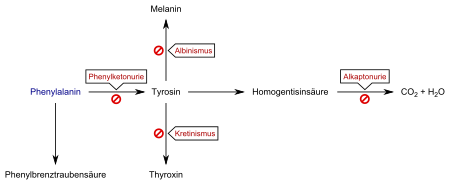
Klassische Phenylketonurie
[Bearbeiten | Quelltext bearbeiten]Bei ca. 98 % aller Fälle führt eine fehlende oder verminderte Aktivität des Enzyms Phenylalaninhydroxylase (PAH, EC 1.14.16.1) zu einer Anhäufung des Phenylalanins im Körper. Die alternativen Abbauprodukte Phenylessigsäure (Phenylacetat), Phenylbrenztraubensäure (Phenylpyruvat, das namengebende Phenylketon) und Phenylmilchsäure (Phenyllaktat) werden vermehrt ausgeschieden, was der Erkrankung schließlich den Namen Phenylketonurie gab. Durch den fehlenden Stoffwechselpfad zum Tyrosin tritt ein relativer Mangel an dieser eigentlich nichtessenziellen Aminosäure auf, die nun wiederum über die Nahrung aufgenommen werden muss. Tyrosin wird benötigt für die Biosynthese des Neurotransmitters Dopamin, der Schilddrüsenhormone, aber auch für die Bildung des Pigmentfarbstoffs Melanin, durch das die Färbung von Haut und Haaren zustande kommt.
Atypische Phenylketonurie
[Bearbeiten | Quelltext bearbeiten]
In ungefähr 2 % aller Fälle liegen jedoch Störungen des Stoffwechsels eines Koenzyms der Phenylalaninhydroxylase, des Tetrahydrobiopterins (BH4), vor, und man spricht von sogenannten atypischen Phenylketonurien. Da Tetrahydrobiopterin auch in der körpereigenen Herstellung (Biosynthese) der Neurotransmitter Serotonin und Dopamin eine zentrale Rolle spielt, weist die atypische PKU meist einen schwerwiegenderen Verlauf auf. Die Störungen des Biopterinstoffwechsels haben unterschiedliche Ursachen. Einerseits sind Defekte in der Biosynthese des Tetrahydrobiopterins bekannt. Andererseits kann das Enzym Dihydropteridinreduktase (DHPR, EC 1.5.1.34) Defekte aufweisen (Dihydropteridinreduktasemangel). Dieses Enzym ist für die Reduktion des Dihydrobiopterins zum Tetrahydrobiopterin zuständig. Die daraus resultierende verminderte oder unterbleibende Regeneration führt zu einem Mangel am Cofaktor.
Genetik
[Bearbeiten | Quelltext bearbeiten]Die klassische PKU beruht auf einer Veränderung eines Gens (Punktmutation) auf dem langen Arm des Chromosoms 12 (12q23.2, GeneID 5053), welches die Phenylalaninhydroxylase codiert. Es sind inzwischen über 400 verschiedene Mutationen dieses Gens bekannt, die autosomal-rezessiv vererbt werden. Von der Art der Mutation hängt das Ausmaß der Aktivitätseinschränkung dieses Enzyms ab. Dies hat wiederum zur Folge, dass die Menge Eiweiß, welche aufgenommen werden kann, ohne dass der Phenylalaninspiegel über den angestrebten Bereich der Phenylalanin-Toleranz ansteigt, von Patient zu Patient unterschiedlich ist.[2]
Symptome
[Bearbeiten | Quelltext bearbeiten]Da heutzutage eine Phenylketonurie in der Regel schon im Neugeborenenalter gefunden und frühzeitig behandelt wird, sieht man bei den betroffenen Kindern nur selten Symptome. Nur bei unbehandelten Kindern kommt es zu den im Folgenden beschriebenen Auffälligkeiten.
Der Überschuss an Phenylalanin führt zu einer Beeinträchtigung der Hirnentwicklung schon vom ersten Lebensmonat an mit meist schweren Störungen der geistigen Entwicklung, wobei sich die ersten neurologischen Auffälligkeiten im vierten Lebensmonat zeigen. Durch das zurückbleibende Wachstum des Gehirns kommt es auch zu einem verminderten Wachstum des Schädels, einer Mikrozephalie. Die übrige körperliche Entwicklung muss dabei nicht gestört sein.

Die beschriebenen Störungen führen in der Regel zu einer geistigen Behinderung. Der Intelligenzquotient unbehandelter Kinder liegt selten über 20. Etwa ein Viertel der Patienten entwickelt eine symptomatische Epilepsie. Veränderungen in der elektrischen Aktivität des Gehirns sind im Elektroenzephalogramm (EEG) in 75–90 % der Fälle nachweisbar. Außerdem können Verhaltensstörungen mit Hyperaktivität, Aggressivität, Zerstörungswut, Erregungszuständen, Zornesausbrüchen und Selbstverstümmelungstendenzen auftreten.
Des Weiteren kommen ekzemähnliche Hautveränderungen überdurchschnittlich häufig vor. Der Mangel an Melanin führt zu einer auffallend hellen Hautfarbe. Die Kinder sind deshalb auch häufig hellblond und haben aus demselben Grund blaue oder auch rote Augen. Es kann eine allgemeine Übererregbarkeit, eine Spastik der Muskulatur auftreten, die im Zusammenhang mit der Schädigung des Gehirns zu einem ataktischen Gangbild führen kann. Die Lebenserwartung ist offenbar nicht eingeschränkt.[2] Typisch für die Erkrankung ist bei phenylalaninhaltiger Nahrung der charakteristische Geruch des Urins nach Mäusekot, der insbesondere durch die Phenylessigsäure verursacht wird. Vor Einführung des Neugeborenenscreenings erfolgte eine Diagnosestellung häufig über dieses an sich harmlose Symptom.
Diagnose
[Bearbeiten | Quelltext bearbeiten]
Die Diagnose wurde früher durch die genannten Symptome und den Nachweis der alternativen Stoffwechselprodukte im Urin gestellt. Heute stellt die Suche auf das Vorliegen einer PKU das Paradebeispiel eines sinnvollen Screenings, also einer Reihenuntersuchung zur Früherkennung einer Erkrankung, dar. Bei dem dabei zum Einsatz kommenden Guthrie-Test handelt es sich um eine einfache, nicht belastende, preisgünstige und schnelle Untersuchung, die bei einer schweren Erkrankung zu einer eindeutigen und rechtzeitigen Diagnose mit einer daraus folgenden klaren Behandlungsstrategie führt. Entscheidend ist, dass alle Neugeborenen schon in den ersten Lebenstagen untersucht werden. Dieses Neugeborenenscreening wird in Österreich seit 1966 angewandt und führt jährlich zu 8 bis 10 Neudiagnosen und der entsprechenden Behandlung. In Deutschland wurde der Guthrie-Test inzwischen durch die Tandem-Massenspektrometrie ersetzt, die ein erweitertes Neugeborenenscreening auch auf andere Störungen des Aminosäurestoffwechsels sowie verschiedene weitere angeborene und behandelbare Erkrankungen ermöglicht.[4][5] Bei auffälligem Ergebnis im Screening muss zur Bestätigung noch eine säulenchromatografische Bestimmung der Phenylalaninkonzentration erfolgen.[6]
Vor Beginn einer Diät muss zunächst ein Tetrahydrobiopterin-Belastungstest, eine Bestimmung von Biopterin und Neopterin im Urin sowie eine Bestimmung der Aktivität des Enzyms Dihyydropteridinreduktase (DHPR) in den roten Blutkörperchen (Erythrozyten) durchgeführt werden, um eine atypische PKU auszuschließen, da diese eine andere Therapie erfordert.
Mittels Pränataldiagnostik kann bei Müttern mit Phenylketonurie schon während der Schwangerschaft durch eine Fruchtwasseruntersuchung (Amniozentese) festgestellt werden, ob das ungeborene Kind den Stoffwechseldefekt in sich trägt. Da die Erkrankung rezessiv übertragen wird, könnte auch der an und für sich gesunde Vater Träger dieser Genmutation sein. In diesem Fall bestünde für das Kind bei Erkrankung der Mutter ein Risiko von 50 %, phänotypisch zu erkranken. Von der Mutter bekommt das Kind in jedem Fall das Merkmal, vom heterozygoten Vater mit einer Wahrscheinlichkeit von 50 %.
Therapie
[Bearbeiten | Quelltext bearbeiten]Eine normale geistige Entwicklung kann gewährleistet werden, wenn die Krankheit frühzeitig erkannt und behandelt wird. Die Aufnahme von Phenylalanin über die Nahrung muss streng kontrolliert und begrenzt werden, damit der Phenylalaninspiegel im Blut möglichst dauerhaft in einen verträglichen Bereich absinkt. Bei der Hyperphenylalaninämie sind die Werte des Phenylalanins erhöht, bedürfen jedoch keiner Therapie oder Diät. Die Voraussetzung ist eine regelmäßige Kontrolle dieser Werte. Nahrungsbedingte Interventionsversuche werden beschrieben.[7]
Klassische Phenylketonurie
[Bearbeiten | Quelltext bearbeiten]Zur möglichst raschen Reduktion erhöhter Phenylalaninkonzentration nach Diagnosestellung bekommen Neugeborene zunächst eine industriell gefertigte, phenylalaninfreie Flaschennahrung. Ist die Konzentration auf Normalwerte gesunken, werden kleine Mengen Muttermilch oder handelsübliche Flaschenmilch (Formulanahrung) entsprechend der individuellen Verträglichkeit gefüttert und die übrige Menge Nahrung mit phenylalaninfreier Milch ergänzt.[2] Mit Einführung der Beikost und zunehmender Entwöhnung von der Milchnahrung wird die Diät entsprechend schwieriger durchführbar.
Da Phenylalanin Bestandteil aller Nahrungseiweiße ist, müssen letztlich sämtliche eiweißhaltigen Lebensmittel gemieden werden. Weil auch Aspartam Phenylalanin enthält, müssen kalorienreduzierte Produkte, die mit Aspartam gesüßt wurden, auch immer mit dem Hinweis „enthält eine Phenylalaninquelle“ gekennzeichnet werden. Da selbst Weizen und andere Getreideerzeugnisse viel pflanzliches Eiweiß enthalten, gibt es für die Patienten Back- und Teigwaren aus speziellem eiweißarmem Mehl. Um den Mangel an essenziellen Aminosäuren auszugleichen, müssen die Patienten zusätzlich eine spezielle Aminosäuremischung zu sich nehmen. Ein weiteres Risiko phenylalaninarmer Ernährung liegt in der Entwicklung eines Mangels an dem für den Knochenaufbau wichtigen Mineralstoff Calcium, an Vitamin B12 und diversen Spurenelementen. Abgesehen von diesen diätetischen Einschränkungen ist die Lebenserwartung unbeeinträchtigt.
Die Diät wird am besten über den Abschluss der geistigen Entwicklung hinaus lebenslang eingehalten, da es sonst zu Konzentrationsschwierigkeiten, Reaktionsverlangsamungen, Veränderungen im EEG und zu einer durch Magnetresonanztomografie nachweisbaren Schwellung des Gehirns kommen kann. Ein Teil der Patienten entwickelt etwa zehn Jahre nach Beendigung der phenylalaninarmen Diät eine Spastik der Muskulatur mit Gangstörungen und Zittern (Tremor).[2]
Enzymtherapie
[Bearbeiten | Quelltext bearbeiten]Im Mai 2018 hat die US-amerikanische Zulassungsbehörde Food and Drug Administration (FDA) eine Zulassung für Pegvaliase erteilt. Hierbei handelt es sich um eine neuartige, so genannte Enzymtherapie. Wegen des Risikos einer Anaphylaxie, die am häufigsten bei der Aufwärtstitration der Dosis innerhalb des ersten Behandlungsjahres auftrat, wird der Kennzeichnung eine „Boxed Warning“ hinzugefügt und die Verordnung nur über ein eingeschränktes Programm im Rahmen einer Risikobewertungs- und Eindämmungsstrategie („Risk Evaluation and Mitigation Strategy“, REMS) ermöglicht.[8] In der Europäischen Union ist Pegvaliase seit Mai 2019 zugelassen.[9]
Etwa die Hälfte der europäischen Patienten mit klassischer PKU sprechen auf eine Zufuhr von Tetrahydrobiopterin (Sapropterin, BH4) an, d. h. der Phenylalaninspiegel wird gesenkt. Es handelt sich nicht wie bei atypischer PKU um einen Defekt im Biopterinstoffwechsel, sondern um eine Eigenschaft der veränderten Phenylalaninhydroxylase. Es soll möglich sein, die Tatsache, ob jemand auf BH4 anspricht, an der Art der PHA-Mutation ablesen zu können.[10][11]
Ein entsprechender Wirkstoff namens Sapropterindihydrochlorid (6R-BH4), ein pharmakologisches Chaperon, wurde von der FDA und der EU inzwischen zugelassen.
Atypische Phenylketonurie
[Bearbeiten | Quelltext bearbeiten]Die Therapie beim Tetrahydrobiopterin-Mangel richtet sich nach der Ursache. Ist die Biosynthese des BH4s gestört, kann der Phenylalaninspiegel durch eine Substitution von BH4 gesenkt werden und es ist keine phenylalaninarme Diät nötig. Allerdings kann BH4 die Blut-Hirn-Schranke nicht in ausreichendem Maß überwinden. Daher steht es im Zentralnervensystem wiederum nicht in ausreichender Menge zur Verfügung, was die Biosynthese der Neurotransmitter Dopamin und Serotonin behindert. Zusätzlich zum Biopterin bekommen die Patienten daher auch noch Vorstufen dieser Neurotransmitter, L-Dopa und 5-Hydroxytryptophan, verabreicht. Zur Anpassung der individuell erforderlichen Dosis ist eine regelmäßige Überprüfung der Konzentration von Pterinen, Phenylalanin-Abbauprodukten und biogenen Aminen im Nervenwasser (Liquor cerebrospinalis) nötig.[2] Außerdem ist zur Vermeidung eines Mangels an Tetrahydrofolsäure (Folinsäure), einem Abkömmling (Derivat) der zum Vitamin-B-Komplex gehörenden Folsäure, innerhalb des Nervensystems auch eine Substitution dieses Vitamins nötig. Eine Behandlung mit Folsäure selbst kann eher zu einer Verschlechterung der neurologischen Symptome führen und ist daher zu vermeiden.[2] Im Falle eines Dihydropteridinreduktasemangels reicht es nicht aus, BH4 mit der Nahrung zuzuführen, sondern es muss ebenfalls eine phenylalaninarme Diät eingehalten werden.
Prognose
[Bearbeiten | Quelltext bearbeiten]Bei frühzeitig einsetzender Behandlung ist die Prognose der klassischen Phenylketonurie ausgesprochen gut. Längen- und Gewichtsentwicklung bleiben bis zum zweiten Lebensjahr etwas gegenüber gesunden Vergleichskindern zurück, später tritt jedoch ein Aufholwachstum ein und die Kinder neigen eher zur Entwicklung von Übergewicht. Die Entwicklung der Intelligenz verläuft unter früher und strenger Diät nahezu normal. Sie ist im Wesentlichen davon abhängig, wie gut die Behandlung während der ersten sechs Lebensjahre eingehalten wurde. Pubertätsentwicklung und Knochenalter weichen nicht von den Werten gesunder Kinder ab.[2] Bei der atypischen PKU sind die Aussichten auf eine ungestörte Entwicklung nicht ganz so einheitlich zu beurteilen. Einerseits wurden dramatische Verbesserungen nach Einleitung der Behandlung selbst bei schon schwer erkrankten Patienten beobachtet. Andererseits ist auch bei frühem Therapiebeginn das Auftreten von Symptomen seitens des Nervensystems möglich. Dies ist bei Patienten mit einem Synthesedefekt häufiger der Fall als bei solchen mit einem Dihydropteridinreduktase-Mangel.[2]
Mütterliche Phenylketonurie
[Bearbeiten | Quelltext bearbeiten]Frauen mit PKU und Kinderwunsch müssen auf eine besonders strenge Diät achten, um die Entwicklung des ungeborenen Kindes nicht zu gefährden. Auch ein stoffwechselgesundes Kind kann durch eine erhöhte Phenylalaninkonzentration erheblich geschädigt werden, da die Aminosäure den Mutterkuchen (Plazenta) problemlos durchwandert. Es entsteht eine Embryofetopathie mit niedrigem Geburtsgewicht, vermindertem Kopfumfang (Mikrozephalus), Herzfehler und anderen angeborenen Fehlbildungen. In der weiteren Entwicklung sind weiterhin mangelnde Längen- und Gewichtszunahme (Gedeihstörung) und eine geistige und motorische Entwicklungsverzögerung auffällig.[2] Phenylketonurie der Mutter ist hingegen keine Kontraindikation zum Stillen gesunder Kinder.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Im Jahr 1934 wurde vom norwegischen Arzt Ivar Asbjørn Følling erstmals bei geistig behinderten Patienten die vermehrte Ausscheidung der Phenylbrenztraubensäure mit dem Urin mittels Eisen(III)-chlorid nachgewiesen („Følling-Probe“). Er nannte das neue Krankheitsbild zunächst Imbezillitas phenylpyruvica („Phenylbrenztraubenschwachsinn“).[12] 1947 erfolgte dann die Entdeckung des eigentlichen Defektes in der Umwandlung von Phenylalanin zu Tyrosin durch George A. Jervis.[13] Der nächste Meilenstein in der Geschichte der PKU (genannt auch Föllingsche Krankheit und Oligophrenia phenylpyruvia[14]) war die Einführung einer phenylalaninarmen Diät zur Behandlung der Erkrankung durch den deutschen Kinderarzt Horst Bickel 1953. Zehn Jahre später ermöglichte schließlich der amerikanische Mikrobiologe Robert Guthrie mit dem von ihm entwickelten bakteriellen Hemmtest den einfachen Nachweis einer erhöhten Phenylalanin-Konzentration im Blut. Die Bestimmung konnte aus Bluttropfen erfolgen, die auf Filterpapier getrocknet wurden, wodurch sich die Methode auch für ein Massenscreening eignete. Im Rahmen erweiterter Neugeborenenscreeningprogramme erfolgt die Untersuchung in einigen Regionen inzwischen mit Hilfe der Tandem-Massenspektrometrie.[2][15]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Siegried A. Centerwall u. a.: The discovery of phenylketonuria: the story of a young couple, two retarded children, and a scientist. In: Pediatrics. Band 105, Nr. 1, Teil 1, 2000, S. 89–103. PMID 10617710. Volltext
- Friedrich K. Trefz u. a., Sapropterin Study Group: Efficacy of sapropterin dihydrochloride in increasing phenylalanine tolerance in children with phenylketonuria: a phase III, randomized, double-blind, placebo-controlled study. In: The Journal of pediatrics. Band 154, Nummer 5, Mai 2009, S. 700–707, doi:10.1016/j.jpeds.2008.11.040, PMID 19261295.
- George A. Jervis: Studies on Phenlypyruvic Oligophrenia. The Position of the Metabolic Error. In: J. Biol. Chem. Band 169, 1947, S. 651–656. (http://www.jbc.org/content/169/3/651.full.pdf PDF)
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Deutsche Interessengemeinschaft Phenylketonurie
- Forum für Betroffene
- Ronald D. Gerste: Ausweg bei schwerer Stoffwechselstörung. Die Phenylketonurie lässt sich neuerdings nicht mehr nur mit strenger Diät behandeln. In: Neue Zürcher Zeitung. 16. Februar 2011, abgerufen am 17. Februar 2011.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Screeningreport der Deutschen Gesellschaft für Neugeborenenscreening ( vom 24. Januar 2013 im Internet Archive)
- ↑ a b c d e f g h i j k l A. C. Muntau u. a.: Phenylketonurie und Hyperphenylalaninämie. In: Monatsschrift Kinderheilkunde. 2000, 148, S. 179–193.
- ↑ C. Landvogt, E. Mengel u. a.: Reduced cerebral fluoro-L-dopamine uptake in adult patients suffering from phenylketonuria. In: Journal of Cerebral Blood Flow and Metabolism. Band 28, Nummer 4, April 2008, S. 824–831. doi:10.1038/sj.jcbfm.9600571. PMID 17971791.
- ↑ Xiong X, Sheng X, Liu D, Zeng T, Peng Y, Wang Y: A GC/MS-based metabolomic approach for reliable diagnosis of phenylketonuria., Anal Bioanal Chem. 2015 Nov;407(29):8825-33, PMID 26410738.
- ↑ Sarkissian CN, Scriver CR, Mamer OA: Measurement of phenyllactate, phenylacetate, and phenylpyruvate by negative ion chemical ionization-gas chromatography/mass spectrometry in brain of mouse genetic models of phenylketonuria and non-phenylketonuria hyperphenylalaninemia., Anal Biochem. 2000 May 1;280(2):242-9, PMID 10790306.
- ↑ Meiouet F, Kabbaj SE, Debray FG, Boemer F: Diagnostic et suivi de la phénylcétonurie par LC-MS-MS au Maroc [Diagnosis and monitoring of phenylketonuria by LC-MS-MS in Morocco]., Ann Biol Clin (Paris). 2021 Feb 1;79(1):49-55. French, PMID 33570037.
- ↑ Kim MJ, Yang HJ, Kim JH, Ahn CW, Lee JH, Kim KS, Kwon DY: Obesity-related metabolomic analysis of human subjects in black soybean peptide intervention study by ultraperformance liquid chromatography and quadrupole-time-of-flight mass spectrometry., J Obes. 2013;2013:874981, PMID 23862058.
- ↑ FDA approves a new treatment for PKU, a rare and serious genetic disease, PM FDA vom 24. Mai 2018, abgerufen am 14. Juni 2018
- ↑ [1], EMA-Übersichtsseite zu Palynziq, abgerufen am 10. März 2021
- ↑ M. R. Zurflüh, J. Zschocke, M. Lindner u. a.: Molecular genetics of tetrahydrobiopterin-responsive phenylalanine hydroxylase deficiency. In: Hum. Mutat. Band 29, Nr. 1, Januar 2008, S. 167–175, doi:10.1002/humu.20637.
- ↑ L. Wang, S. Surendran, K. Michals-Matalon u. a.: Mutations in the regulatory domain of phenylalanine hydroxylase and response to tetrahydrobiopterin. In: Genet. Test. Band 11, Nr. 2, 2007, S. 174–178, doi:10.1089/gte.2006.0520.
- ↑ Følling A. Über Ausscheidung von Phenylbrenztraubensäure in den Harn als Stoffwechselanomalie in Verbindung mit Imbezilität. Hoppe-Seylerʼs Z Physiol Chem 1934; 227: 169–176
- ↑ George A. Jervis: Studies on Phenylpyruvic Oligophrenia. The Position of the Metabolic Error. In: J. Biol. Chem. Band 169, 1947, S. 651–656. http://www.jbc.org/content/169/3/651.full.pdf
- ↑ Ludwig Weissbecker: Oligophrenia phenylpyruvica (Föllingsche Krankheit). In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 1113 f.
- ↑ A. C. Muntau, S. Beblo, B. Koletzko: Historische Aspekte. In: Kinderheilkunde. 148, 2000, S. 179.