Acetophenon
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
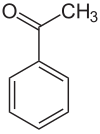
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Acetophenon | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C8H8O | |||||||||||||||||||||
| Kurzbeschreibung |
farblose bis schwach gelbliche, ölige Flüssigkeit mit süßem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 120,15 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
über 20 °C flüssig, darunter fest[3] | |||||||||||||||||||||
| Dichte |
1,03 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
202 °C[3] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Brechungsindex |
1,5372 (20 °C)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Acetophenon [] (Name zusammengesetzt aus: Acetyl-, o, phen von der Phenylgruppe und on zur Kennzeichnung als Keton) ist eine aromatische organisch-chemische Verbindung und gehört zu den Ketonen. Acetophenon wurde unter anderem als Hypnotikum eingesetzt[8] und war als solches unter dem Trivialnamen Hypnon bekannt.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Acetophenon ist ein Bestandteil vieler ätherischer Öle wie etwa Labdanum, Castoreum, Stirlingia latifolia. Außerdem kommt dieses Keton in vielen natürlichen Aromen und in Steinkohleteer vor.[2][9]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Acetophenon lässt sich durch Friedel-Crafts-Acylierung von Benzol mit Essigsäurechlorid oder Essigsäureanhydrid herstellen. Es war eine der ersten Verbindungen, die der französische Chemiker Charles Friedel und US-amerikanische Chemiker James Mason Crafts nach ihrer 1877 entdeckten Methode herstellten.[10][11]
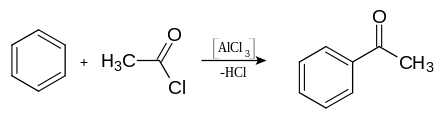
Im Gegensatz zur Friedel-Crafts-Alkylierung fungiert dabei die Lewis-Säure Aluminiumchlorid (AlCl3) nicht als Katalysator, sondern wird als Reagenz in äquivalenten Mengen verbraucht, wobei nach der notwendigen Hydrolyse des Zwischenprodukts Aluminiumhydroxid entsteht. Eine industrielle Synthese erfolgt durch eine katalytische Oxidation von Ethylbenzol mittels Luft.[9]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Methyl-Gruppe im Acetophenon besitzt CH-Acidität und kann durch starke Basen (hier als B– dargestellt) deprotoniert werden, wobei ein resonanzstabilisiertes Enolat-Ion gebildet wird:
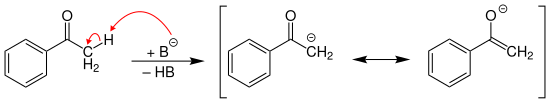
Der pKS-Wert in Dimethylsulfoxid (DMSO) ist in der nebenstehenden Infobox angegeben.
Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Acetophenon ist eine farblose bis gelbliche Flüssigkeit mit einem süßen, an Orangenblüten erinnernden Geruch.[2] Unter Normaldruck siedet die Verbindung bei 202 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,64896, B = 2006,397 und C = −43.472 im Temperaturbereich von 310 bis 475 K.[12] Acetophenon bildet mit Wasser ein azeotrop siedendes Gemisch bei 98 °C und 82 % Wasseranteil.[13]
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−142,5 kJ·mol−1[14] −86,7 kJ·mol−1[14] | |
| Standardentropie | S0gas | 372,88 J·mol−1·K−1[15] | als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −4148,9 kJ·mol−1[14] | |
| Wärmekapazität | cp | 227,6 J·mol−1·K−1 (25 °C)[16] | als Flüssigkeit |
| Kritische Temperatur | Tc | 709,6 K[17] | |
| Kritischer Druck | pc | 40,1 bar[17] | |
| Kritische Dichte | ρc | 2,59 mol·l−1[18] | |
| Schmelzenthalpie | ΔfH | 16,65 kJ·mol−1[19] | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH | 43,63 kJ·mol−1[20] | beim Normaldrucksiedepunkt |
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]Acetophenon bildet bei höheren Temperaturen entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 77 °C.[3][21] Die untere Explosionsgrenze liegt bei 1,1 Vol.‑% (55 g/m3), der untere Explosionspunkt bei 70 °C.[3][21] Die Zündtemperatur beträgt 535 °C.[3][21] Der Stoff fällt somit in die Temperaturklasse T1. Die elektrische Leitfähigkeit ist mit 3,1·10−7 S·m−1 eher gering.[22][3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Acetophenon ist aufgrund seiner reaktionsfähigen Struktur Ausgangsstoff zahlreicher Synthesen als Ausgangs- oder Zwischenprodukt für andere Duftstoffe und Pharmazeutika sowie Kunstharze. Weiterhin ist er als hochsiedendes Lösungsmittel für Farben und Harze einsetzbar.
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Acetophenon als reiner Stoff ist beim Verschlucken gesundheitsschädlich. Er reizt die Augen und kann bei Einwirkung auf die ungeschützte Haut eine Dermatitis hervorrufen. Als Spritzschutz sollten geeignete Handschuhe getragen werden. In höheren Konzentrationen wirkt er hypnotisch, daher auch die Synonymbezeichnung Hypnon. Die Dämpfe erzeugen in einer Konzentration von 80 ppm bei einer Einwirkung von über einer Stunde starke Vergiftungserscheinungen. Acetophenon ist schwer entzündlich und wenig flüchtig. Die Dämpfe sind viel schwerer als Luft. Mit starken Oxidationsmitteln und starken Basen kann es zu stark exothermen Reaktionen kommen. Über 300 °C kommt es zur Zersetzung von Acetophenon. Dabei können Benzol, Biphenyl, 1,4-Diphenylbenzol, Kohlenstoffmonoxid, Methan, Wasserstoff, Ethen und/oder Toluol entstehen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu ACETOPHENONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 4. Mai 2020.
- ↑ a b c d e Eintrag zu Acetophenon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. März 2014.
- ↑ a b c d e f g h i j k l m n Eintrag zu Acetophenon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Matthews, W. S.; Bares, J. E.; Bartmess, J. E.; Bordwell, F. G.; Cornforth, F. J.; Drucker, G. E.; Margolin, Z.; McCallum, R. J.; McCollum, G. J.; Vanier, N. R., "Equilibrium acidities of carbon acids. VI. Establishment of an absolute scale of acidities in dimethyl sulfoxide solution", J. Am. Chem. Soc., (1975) 97, 7006–7014. doi:10.1021/ja00857a010
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-6.
- ↑ Eintrag zu Acetophenone im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-3.
- ↑ LEXIKON DER CHEMIE : Acetophenon. In: spektrum.de. Abgerufen am 13. Dezember 2021.
- ↑ a b Brockhaus ABC Chemie, 3. Auflage, F.A. Brockhausverlag Leipzig 1971, S. 146.
- ↑ C. Friedel, J.-M. Crafts: Sur une nouvelle méthode générale de synthèse des combinaisons aromatiques in Annales de chimie et de physique, Ser.6,T. 1 (1884) 449ff.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 5 pdf.
- ↑ Stull, D.R.: Vapor Pressure of Pure Substances Organic Compounds in Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022.
- ↑ I.M. Smallwood: Handbook of organic solvent properties, Arnold London 1996, ISBN 0-340-64578-4, S. 183–185.
- ↑ a b c M. Colomina, C. Latorre, R. Perez-Ossorio: Heats of combustion of five alkyl phenyl ketones. In: Pure Appl. Chem. Band 2, Nr. 1–2, 1961, S. 133–135, doi:10.1351/pac196102010133.
- ↑ Stull, D. R., Jr.: The Chemical Thermodynamics of Organic Compounds, Wiley, New York, 1969.
- ↑ N. M. Phillip: Adiabatic and isothermal compressibilities of liquids. In: Proc. Indian Acad. Sci. A9, Nr. 2, 1939, S. 109–120.
- ↑ a b Teja, A.S.; Rosenthal, D.J.: The critical pressures and temperatures of ten substances using a low residence time flow apparatus in Experimental Results for Phase Equilibria and Pure Component Properties in DIPPR DATA Series No. 1, 1991.
- ↑ Teja, A.S.; Anselme, M.J.: The critical properties of thermally stable and unstable fluids. I. 1985 results in AIChE Symp. Ser., 1990, 86, 279, 115–121.
- ↑ Luginin: Bull. Soc. Chim. Fr. 9 (1911) 223.
- ↑ Steele, W.V.; Chirico, R.D.; Knipmeyer, S.E.; Nguyen, A.: in J. Chem. Eng. Data 41 (1996) 1255–1268, doi:10.1021/je9601117.
- ↑ a b c E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ Technische Regel für Gefahrstoffe TRGS 727, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand August 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6.
