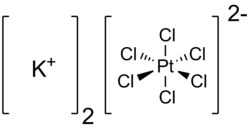
Kaliumhexachloroplatinat(IV)
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumhexachloroplatinat(IV) | |||||||||||||||
| Andere Namen |
Dikaliumhexachloroplatinat | |||||||||||||||
| Summenformel | K2[PtCl6] | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 486,01 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
3,50 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,825 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Kaliumhexachloroplatinat(IV) ist eine chemische Verbindung aus der Gruppe der Hexachloridoplatinate.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Als Kaliumsalz der Chloroplatinsäure wurde die Verbindung erstmals im Jahr 1881 vom deutschen Chemiker Karl Seubert durch eine Fällung von Platin(IV)-chlorid mit Kaliumchlorid erhalten.[5][6]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Kaliumhexachloroplatinat(IV) kann durch Reaktion einer schwach salzsauren Hexachloroplatin(IV)-säure-Lösung oder Platin(IV)-chlorid[7] mit Kaliumchlorid gewonnen werden.[8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Kaliumhexachloroplatinat(IV) ist ein gelber geruchloser Feststoff, der wenig löslich in kaltem Wasser ist.[1] Er liegt in Form von leuchtend gelben Oktaedern vor. Eine Verfärbung nach ockergelb und rötlichgelb deutet auf die Anwesenheit von Iridium, Ruthenium und Palladium hin. Schon geringe Verunreinigungen von Rhodium rufen einen grüngelben bis grünen Farbstich hervor. Die Verbindung besitzt eine kubische Kristallstruktur mit der Raumgruppe Fm3m (Raumgruppen-Nr. 225).[8]
Es zersetzt sich bei Erhitzung, reagiert mit Kaliumhydroxid zu Platinhydroxidkomplexen und wird durch Kupfer(I)-chlorid zu Kaliumtetrachloroplatinat(II) reduziert.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Kaliumhexachloroplatinat(IV) wird zur Herstellung von anderen chemischen Verbindungen (wie dem Arzneistoff Ormaplatin[9]) und in der Analogfotografie[7] verwendet.
Die Verbindung lässt sich (mit gewissen Einschränkungen[10]) zum Nachweis von Kalium verwenden.[11]
Außerdem wird die Verbindung als Standard für die Platin-Cobalt-Farbzahl herangezogen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Datenblatt potassium hexachloroplatinate(IV), Pt 39.6% bei Alfa Aesar, abgerufen am 23. August 2013 (Seite nicht mehr abrufbar).
- ↑ a b c Eintrag zu Kaliumhexachloroplatinat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt Kaliumhexachloroplatinat(IV) bei Merck, abgerufen am 23. August 2013.
- ↑ Eintrag zu Dipotassium hexachloroplatinate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ K. Seubert: Über das Atomgewicht des Platins in Ann. Chem. Pharm. 207 (1881) 11.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten anorganischer Substanzen, Version 2020, S. 69 pdf.
- ↑ a b c R.D. Madan: Advanced Inorganic Chemistry. S. Chand, 2005, ISBN 81-219-1787-5, S. 426 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band 3. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1712.
- ↑ Franz von Bruchhausen, Hermann Hager, Siegfried Ebel, Eberhard Hackenthal, Ulrike Holzgrabe: Hagers Handbuch der Pharmazeutischen Praxis: Stoffe L–Z. Springer DE, 1999, ISBN 3-642-58388-1, S. 356 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ von Jean-Louis Burgot: Ionic Equilibria in Analytical Chemistry - Jean-Louis Burgot. Springer, 2012, ISBN 1-4419-8381-3, S. 562 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Helmut Hofmann, Gerhart Jander: Qualitative Analyse. Walter de Gruyter, 1972, ISBN 3-11-003653-3, S. 93 (eingeschränkte Vorschau in der Google-Buchsuche).



![{\displaystyle \mathrm {H_{2}[PtCl_{6}]+2\ KCl\longrightarrow K_{2}[PtCl_{6}]\downarrow +2\ HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/82e7a780931c6c25e3e446368874cb6fc07ac761)
![{\displaystyle \mathrm {PtCl_{4}+2\ KCl\longrightarrow K_{2}[PtCl_{6}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9c7b0cb1fd6667860591968e9366054f9697e0f)
![{\displaystyle \mathrm {K_{2}[PtCl_{6}]\longrightarrow Pt+2\ KCl+2\ Cl_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4e44277c507b92cf1c5a9fb0b98282d7775fc56a)
![{\displaystyle \mathrm {K_{2}[PtCl_{6}]+6\ KOH\longrightarrow K_{2}[Pt(OH)_{6}]+6\ KCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/91fdd0a32d7e8d94b82ffc44d10f4e1b0976bd35)
![{\displaystyle \mathrm {K_{2}[PtCl_{6}]+2\ CuCl\longrightarrow K_{2}[PtCl_{4}]+2\ CuCl_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cbd8f50fe2887c9309a08058ab9a5be3000f7198)