Koenigs-Knorr-Methode
Die Koenigs-Knorr-Methode – benannt nach Wilhelm Koenigs (1851–1906) und seinem Mitarbeiter Eduard Knorr (1867–1926) – ist eine der bekanntesten Reaktionen in der Kohlenhydratchemie und dient zur synthetischen Herstellung von Glykosiden aus Monosaccharid-Derivaten.
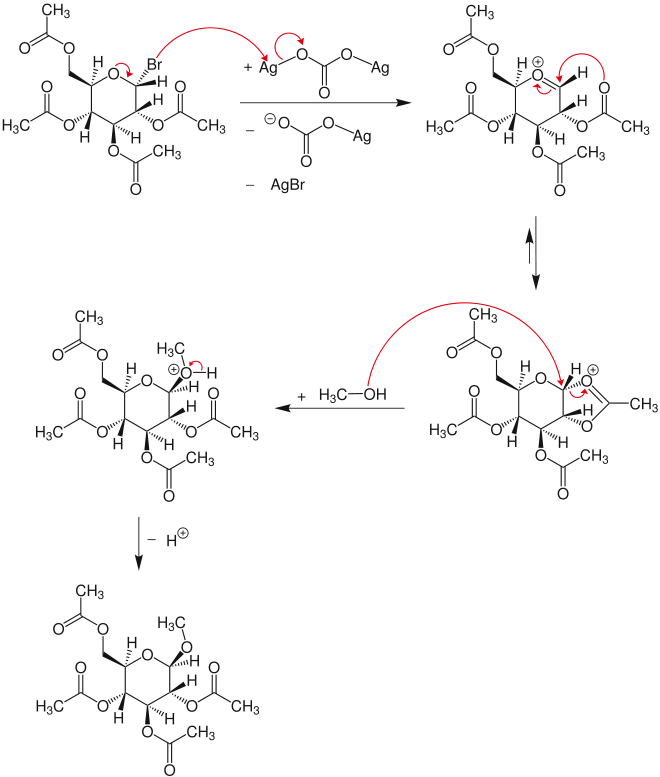
Die Chemiker Koenigs und Knorr behandelten im Jahre 1901 2,3,4,6-Tetra-O-acetyl-α-D-glucopyranosylbromid (Acetobromglucose) in Methanol mit Silber(I)-carbonat und erhielten Methyl-2,3,4,6-tetra-O-acetyl-β-D-glucopyranosid.

Reaktionsmechanismus
[Bearbeiten | Quelltext bearbeiten]Im ersten Schritt reagiert das Glycosylbromid mit Silbercarbonat unter Abspaltung von Silberbromid und dem Silbercarbonatanion zum Oxocarbeniumion. Aus diesem bildet sich ein Dioxolaniumion, welches vom Methanol über einen SN2-Mechanismus am Carbonylkohlenstoffatom angegriffen wird. Durch diesen Angriff kommt es zur Inversion. Nach der Abspaltung eines Protons entsteht letztlich das Glykosid.[1]
Diese Reaktion kann auch auf Kohlenhydrate mit anderen Schutzgruppen übertragen werden. In der Oligosaccharidsynthese werden anstelle des Methanols Kohlenhydrate verwendet, die mit Schutzgruppen so verändert wurden, dass sie nur noch eine „freie“ Hydroxygruppe enthalten.
Die Methode wurde später durch Emil Fischer und Burckhardt Helferich auf andere chlorsubstituierte Purine übertragen und damit erstmals auf synthetischem Weg Nucleoside erzeugt. Sie wurde später durch zahlreiche Chemiker weiter verbessert und modifiziert.
Koenigs-Knorr-Kondensation
[Bearbeiten | Quelltext bearbeiten]Eine Modifikation der Koenigs-Knorr-Methode ist die Koenigs-Knorr-Kondensation. Hierbei wird der Alkohol nicht als Lösungsmittel verwendet, sondern nur stöchiometrisch wie ein Reagenz eingesetzt und als Lösungsmittel dient ein aprotisches Lösungsmittel wie zum Beispiel Benzol. Im Ergebnis wird statt einem Glykosid dann ein über die anomere Position und die benachbarte Position verbrückter Orthoester gebildet. Dies kann dadurch erklärt werden, dass bei vorliegen einer geringeren Alkohol Konzentration dieser nicht im anomeren Zentrum nukleophil angreift, sondern stattdessen an der Stelle des Carbeniumions in der Dioxolan-Zwischenstufe. Der durch den Nachbargruppeneffekt gebildete Fünfring bleibt also nach Abspaltung eines Protons als neutrales Produkt erhalten.[2][3]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ László Kürti und Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 246–247, ISBN 978-0-12-429785-2.
- ↑ A. S. Perlin: FORMATION OF DIASTEREOISOMERIC ORTHOACETATES OF d-MANNOSE: NMR SPECTRAL EVIDENCE. In: Canadian Journal of Chemistry. Band 41, Nr. 2, 1963, S. 399–406, doi:10.1139/v63-058.
- ↑ Y.-M. Zhang, J.-M. Mallet, P. Sinaÿ: Glycosylation using a one-electron-transfer, homogeneous reagent. Application to an efficient synthesis of the trimannosyl core of N-glycosylproteins. In: Carbohydrate Research. Band 236, 1992, S. 73–88, doi:10.1016/0008-6215(92)85007-M.
Literatur
[Bearbeiten | Quelltext bearbeiten]- W. Koenigs, E. Knorr: Chemische Berichte. Nr. 34, 1901, S. 957. online