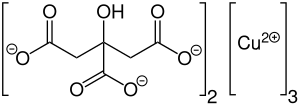
Kupfer(II)-citrat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kupfer(II)-citrat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H10Cu3O14 | ||||||||||||||||||
| Kurzbeschreibung |
hellblauer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 568,84 g·mol−1 (wasserfrei) | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Kupfer(II)-citrat ist das Kupfersalz der Citronensäure.
Beschreibung
[Bearbeiten | Quelltext bearbeiten]Kupfercitrat ist ein kristalliner geruchloser Feststoff, mit einer für Kupferverbindungen charakteristischen blauen Farbe. Es ist in Wasser schwer löslich.[2]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Kupfercitrat lässt sich beispielsweise durch Reaktion von Kupfer(II)-hydroxid (Cu(OH)2) mit Citronensäure herstellen:
Alternativ kann man Kupfercitrat auch durch die elektrochemische Umsetzung von mit Wasser verdünnter Citronensäure und Kupfer gewinnen.
Verwendung
[Bearbeiten | Quelltext bearbeiten]
Kupfercitrat wird in der Önologie zur Behandlung des Weinfehlers „Böckser“ – ein Geruchs- und Aromafehler – verwendet. Kupfercitrat wird dabei als granuliertes „Kupzit“ (mit 5 % Gehalt an Kupfercitrat) dem Wein zugegeben. Dies führt allerdings dazu, dass dann freie, geschmacklich völlig unzulängliche, Kupferionen im Wein verbleiben. Diese müssen daher nach der Böckser-Behandlung mit Kaliumhexacyanidoferrat(II) abgefangen werden, welches die freien Kupferionen weitgehend in eine unlösliche und somit vom Wein abfiltrierbare Form überführt.[5]
Daneben wird Kupfercitrat noch als Algizid in Schwimmbädern, als Antiseptikum, in Metallbearbeitungsölen[1] sowie schon seit 1849 als Pigment[6] verwendet. In geringem Umfang wird das Citrat zur Holzkonservierung eingesetzt.[7] Auch in Nahrungsergänzungsmitteln ist es für das Spurenelement Kupfer als Komponente enthalten.
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Bei Hamstern zeigte Cu(II)-citrat nach einer Gabe an trächtige Tiere eine fruchtschädigende Wirkung, vorwiegend Missbildungen des cardiovaskulären Systems.[8][9] Die akute letale Dosis bei Ratten beträgt bei oraler Aufnahme 1.580 mg·kg−1.[4]
Literatur
[Bearbeiten | Quelltext bearbeiten]- A. J. Davison, R. T. Hamilton: Stimulation of cytochrome c oxidation by a copper citrate complex. In: Arch. Biochem. Biophys. Band 126, 1968, S. 228–231; PMID 5671065.
- Abdelaziz Madinzia, Mohammed El Amanea, Hamid Atmani: Synthesis, characterisation and electrochemical properties of the copper citrate complexes. In: Annales de Chimie Science des Materiaux. Band 25, 2000, S. 179–185; doi:10.1016/S0151-9107(00)88893-5.
- F. J. Di Carlo: Syndromes of cardiovascular malformations induced by copper citrate in hamsters. In: Teratology. Band 21, 1980, S. 89–101. PMID 7385058.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Kupferchemikalien. ( vom 31. Mai 2015 im Internet Archive) (PDF; 1,1 MB) S. 11.
- ↑ a b Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1462-7, S. 139 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Eintrag zu Cupric citrate in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Siegmar Görtges: Böckserbeseitigung mit Kupfercitrat. In: Der Deutsche Weinbau. Nr. 20, 2. Oktober 2009, S. 24–25 (PDF).
- ↑ N. Eastaugh, V. Walsh, T. Chaplin, R. Siddall: Pigment Compendium: A Dictionary of Historical Pigments. Butterworth-Heinemann, 2004, ISBN 978-0-7506-5749-5.
- ↑ T. G. Townsend, H. M. Solo-Gabriele: Environmental Impacts of Treated Wood. CRC Press, 2006, ISBN 978-0-8493-6495-2.
- ↑ M. J. Derelanko, M. A. Hollinger: Handbook of Toxicology. CRC Press, 2002, ISBN 978-0-8493-0370-8.
- ↑ NRC (USA): Mineral Tolerance of Domestic Animals. National Academy of Sciences, Washington, 1980.
