Kutscherov-Reaktion
Die Kutscherov-Reaktion ist eine Namensreaktion der organischen Chemie und nach dem russischen Chemiker Michail Kutscherow benannt. Die Reaktion erlaubt die Synthese von Aldehyden oder Ketonen aus Alkinen.
Übersichtsreaktion
[Bearbeiten | Quelltext bearbeiten]Bei der Reaktion wird an die C≡C-Dreifachbindung eines Alkins – im Beispiel Ethin – Wasser addiert, katalysiert von Quecksilbersulfat und verdünnter Schwefelsäure. Es entsteht Acetaldehyd:

Analog entsteht ausgehend von z. B. 2-Butin durch Wasseranlagerung 2-Butanon, ein Keton.
Allgemeines
[Bearbeiten | Quelltext bearbeiten]Erstmals wurde dieses Reaktion 1875 von Fittig und Schrohe dokumentiert.[1] Im Jahr 1881 wurde sie dann von Kutscheroff weiterentwickelt.[2] Sie wurde früher üblicherweise dafür verwendet, um aus längerkettigen Alkinen wie Butenin[3] und Propin[4] Ketone herzustellen. Außerdem wurde aus Ethin über dieselbe Prozedur kommerziell Acetaldehyde hergestellt.[5] Bei der Herstellung konnten bei relativ niedrigen Temperaturen ~125 °C Ausbeuten von 79,8 % erzielt werden.[6]
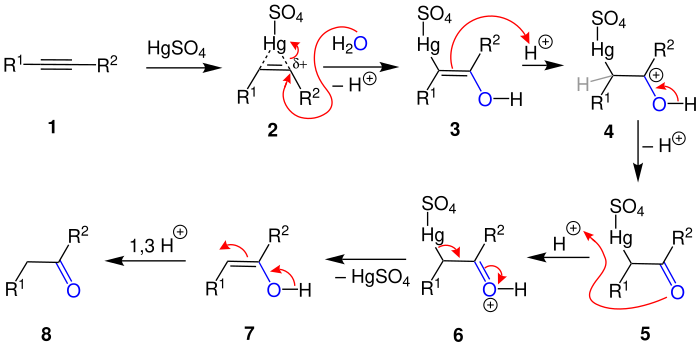
Vorgeschlagener Reaktionsmechanismus
[Bearbeiten | Quelltext bearbeiten]Bei der Reaktion bildet das Alkin eine Koordinative Bindung zum Quecksilberkation aus und es entsteht der kurzlebige π-Komplex[7] 2. Die Regioselektivität des Wassers wird dabei von den beiden Resten R1 und R2 (H, Alkylreste, Methylreste) durch Mesomerie bestimmt, da diese die Stabilität des nun partial positiv geladenen Kohlenstoffs beeinflussen. Durch die Anlagerung des Wassers spaltet sich ein H+ vom Wasser ab und das vom Quecksilber gelockerte Elektronenpaar bildet eine Bindung zum Quecksilber aus. Folglich entsteht die Struktur 3. Die Doppelbindung des Alkens greift nun ein H+-Kation an und es bildet sich auf der Seite des Sauerstoffs als Übergangszustand ein Carbokation[8] 4, woraus durch Abspaltung des Protons von der Hydroxy-Gruppe und Elektronenverschiebung das Keton 5 entsteht. Durch die Anlagerung eines weiteren Protons an eines der freien Elektronenpaare des Sauerstoffs entsteht die Zwischenstufe 6. Es wird ein Umklappen des Elektronenpaares zum positiv geladenen Sauerstoff hervorgerufen und somit auch das Umklappen der Bindung vom Quecksilber zum wieder entstandenen positiven Carbokation. Es spaltet sich somit Quecksilbersulfat wieder ab und wir erhalten das Enol 7. Aufgrund der Keto-Enol-Tautomerie bildet sich darauf das Keton 8.[9]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Journal of the American Chemical Society 1990, 112, S. 6291–6296.
- Kutscheroff, M. G., Berichte der deutschen chemischen Gesellschaft, 1881, 14, S. 1532 u. 1540.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents, Volume 2, Wiley, 2009, S. 1710–1712, ISBN 978-0-471-70450-8.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Fittig, R. und Schrohe, A., Berichte der deutschen chemischen Gesellschaft (seit ca. 1930 „Chemische Berichte“), 1875, 8, S. 367.
- ↑ Kutscheroff, M.G.: Berichte der deutschen chemischen Gesellschaft. Band 14, 1881, S. 1532 und 1540, doi:10.1002/cber.188101401319.
- ↑ (a) Conway, R.F., U.S. Pat., 24. Juli 1934, 1, 967, S. 225. (b) Carter, A. S., U. S. Pat., Feb 7, 1933, 1, 896, S. 161.
- ↑ Kutscheroff, M.G., Berichte der deutschen chemischen Gesellschaft 1884, 17, S. 13.
- ↑ Thomas, R.J., Campbell, K.N. und Hennion, G.F., Journal of the American Chemical Society, 1938, 60, S. 718.
- ↑ Zerong Wang: Comprehensic Organic Name Reactions and Reagents, Volume 2, Wiley, 2009, S. 1711, ISBN 978-0-471-70450-8.
- ↑ Thomas Klemens Kribber: Rutheniumkatalysierte Hydratisierung von terminalen Alkinen und deren Einsatz in Synthesestrategien, Dissertation RWTH Aachen, 2009 http://publications.rwth-aachen.de/record/51262/files/Kribber_Thomas.pdf S. 4.
- ↑ Zerong Wang: Comprehensic Organic Name Reactions and Reagents, Volume 2, Wiley, 2009, S. 1710–1712, ISBN 978-0-471-70450-8.
- ↑ Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro Jr.: Name Reactions and Reagents in Organic Syntheses, 2. Auflage, Wiley-Interscience, 2005, S. 384 und S. 474, ISBN 0-471-22854-0.