Rotz (Krankheit)
| Klassifikation nach ICD-10 | |
|---|---|
| A24 | Rotz [Malleus] und Melioidose [Pseudorotz] |
| A24.0 | Rotz, Infektion durch Burkholderia mallei, Malleus |
| ICD-10 online (WHO-Version 2019) | |
Der Rotz (auch Mürde oder Hautwurm, lateinisch Malleus) ist primär eine Krankheit der Einhufer (Pferde und Esel), die durch das vor allem in Afrika, Asien und Südamerika vorkommende Bakterium Burkholderia mallei (synonym Malleomyces mallei, früher auch Pseudomonas mallei) verursacht wird. Auch Menschen und andere Säugetiere können sich mit Rotz infizieren. Die Erkrankung ist durch spezifische, eitrig-einschmelzende Prozesse in den oberen Atemwegen, der Lunge sowie in Form von Knoten, Geschwüren und Abszessen der Haut und der Schleimhäute gekennzeichnet. Der Verlauf variiert zwischen akut und chronisch, wobei sich deutliche Speziesunterschiede zeigen. Pferde können sich latent infizieren und sorgen als einziges natürliches Erregerreservoir für die weitere Verbreitung der Krankheit. Die Übertragung erfolgt durch den direkten oder indirekten Kontakt mit infektiösen Körperausscheidungen. Häufige Eintrittspforten des Erregers sind die Schleimhäute des Kopfes sowie die äußere Haut.
Die (Anthropo-)Zoonose Rotz tritt beim Menschen selten auf und verläuft unbehandelt oft tödlich.[1] Eine antibiotische Therapie gestaltet sich langwierig und gelegentlich schwierig. Wirksame Impfungen existieren nicht. Arbeiten mit dem Erreger sind auf Labore der Sicherheitsstufe 3 und höher begrenzt. Wegen seiner Humanpathogenität und potentiell hohen Kontagiosität ist Burkholderia mallei als biologischer Kampfstoff der Klasse B eingeordnet.
Rotz ist eine der ältesten bekannten Seuchen beim Pferd und findet schon im Altertum Erwähnung. Als Gewährsmangel und bei ehemals weltweiter Verbreitung führte die Erkrankung zu hohen Verlusten bei den Armeepferden des 18. bis 20. Jahrhunderts. Die anzeigepflichtige Tierseuche unterliegt strengen Bekämpfungsmaßnahmen, die vor allem auf der Keulung erkrankter und infizierter Tiere basieren. Dank konsequent durchgeführter Eradikationsprogramme ist Rotz mittlerweile in Nordamerika und Westeuropa getilgt, es existieren jedoch endemisch verseuchte Gebiete in Asien, Südamerika und Afrika. Zurzeit wird Rotz als wiederaufflammende Tierseuche (re-emerging disease) eingestuft.

Bedeutung
[Bearbeiten | Quelltext bearbeiten]Rotz gilt als eine sozioökonomisch bedeutsame Tierseuche. Sie wird als Bedrohung der öffentlichen Gesundheit eingestuft und nimmt Einfluss auf den internationalen Handel mit Tieren oder deren Produkten.
Die Feststellung der Erkrankung zieht in der Regel die sofortige Keulung aller infizierten Tiere nach sich. Beträchtliche wirtschaftliche Schäden entstehen nicht nur dem betroffenen Tierhalter, sondern auch dem jeweiligen Land durch international verhängte Handelssperren und kostspielige, aufwändige Bekämpfungsmaßnahmen. Rotz ist eine lebensgefährliche direkte Zoonose, und der Erreger wird als „einer der gefährlichsten Organismen, die in Laboratorien gehandhabt werden können“ eingestuft.[2] Besondere Aufmerksamkeit verdient der Erreger unter Berücksichtigung seiner Verwendbarkeit als potentielles Agens in der biologischen Kriegsführung.
In den Industrienationen hat die ehemals gefürchtete und weit verbreitete Pferdeseuche durch den generellen Rückgang der Pferdepopulation und gezielte staatliche Rotz-Bekämpfungsmaßnahmen ihre frühere Bedeutung längst verloren. Eine große Rolle spielt die Infektion aktuell jedoch noch in weniger entwickelten Ländern mit hoher Pferdedichte. Soziokulturelle und strukturelle Gegebenheiten verhindern dort oftmals eine effektive Bekämpfung der latent infizierten endemischen Herde.
Name
[Bearbeiten | Quelltext bearbeiten]Der Krankheitsname Rotz (mittelhochdeutsch rotz/roz, „Schleim, Rotz, in der mittelalterlichen und frühneuzeitlichen Humoralpathologie auch Phlegma, Weißschleim“) leitet sich vom typischerweise auftretenden Nasensekret bei dieser Erkrankung ab (ahd. roz, von der lautmalerischen indogermanischen Wurzel *ker, *kor, *kr; vgl. das klingende gr. koryza „Nasenschleim“, zugleich Geräusch des Räusperns oder Ausspuckens).[3] Die im englischen Sprachraum übliche Bezeichnung glanders verweist ebenso wie das niederländische droes auf das Wort „Drüsen“, als Hinweis auf die geschwollenen Lymphknoten bzw. auf die entstehenden, länglichen Hautwülste bei den betroffenen Tieren. Im Deutschen wäre es mit dieser Bezeichnung aber zu einer Kollision mit dem Namen der Krankheit Druse (Coryza [!] contagiosa equorum) gekommen – eine häufige Verwechslung bzw. Gleichsetzung der beiden Krankheiten in früheren Zeiten ist anzunehmen. Stattdessen nannte man den Rotz aus demselben Grund auch Wurm, da die Schwellungen wie sich schlängelnde Parasiten unter der Haut scheinen. Auch die Ursache von Furunkeln, Pusteln und Mitessern, in der Tiermedizin etwa auch die Larve von Dasselfliegen bei Hypodermose, stellte man sich im Mittelalter als Wurm vor.[4] Als Wurm[5] tauchen schon in den ältesten Zeugnissen deutscher Sprache heute nicht mehr genau fassbare Beschwerden bei Tieren auf, etwa im altsächsischen Wurmsegen (gang uz, nesso).
Die Differenzierung zwischen der Erkrankung der Atemwege und jener der Haut findet sich außer in der deutschen Sprache auch im Englischen (glanders & farcy), Französischen (morve & farcin) und im Italienischen (morvo & farcino). Im spanischen Sprachraum ist die Erkrankung als muermo bekannt.
Die genaue Etymologie der lateinischen Bezeichnung Malleus bleibt im Dunkeln. Man vermutet einen Zusammenhang mit dem lat. malleus für „Hammer“; es findet sich in mittellateinischen Glossen ein Zusammenhang mit der Wendung „mit dem Hammer schlagen“, die auf die plötzlich einsetzende Wucht der Erkrankung verweisen könnte. Einige antike Autoren sprechen auch allgemein vom morbus malleus – der „schlimmen Krankheit“ –, unter der sie auch typische Rotzsymptome summieren.[6] Ursprünglich wohl aus dem Altgriechischen stammend, böten sich bei der vielfältigen Möglichkeit korrumpierender Lesungen aber diverse Ursprünge ähnlich klingender Wurzeln an, etwa male „Achsel, Achselhöhle“, malesos „heftig, gefräßig, zermalmend“ oder mala-[chia] „Schlaffheit, Energielosigkeit, Weichheit, Schwäche“. Aristoteles bezeichnet in seiner Historia animalium eine Krankheit, die nur Esel befällt, als „Rotz“ (melida).[7]
In der älteren Fachliteratur findet man noch die in der Tiermedizin früher verwendeten Adjektive rotzig bzw. malleös. Neben den Bezeichnungen Maleus und Malleus wird dort auch bisweilen der Name Maliasmus für die Erkrankung verwendet.
Verbreitung
[Bearbeiten | Quelltext bearbeiten]| Land | Jahr der Tilgung |
|---|---|
| Australien | 1891 |
| Großbritannien | 1928 |
| Schweiz | 1937 |
| Vereinigte Staaten | 1942 |
| Österreich | 1952 |
| Deutschland | 1955 |
| Niederlande | 1957 |
| Polen | 1957 |
| Frankreich | 1965 |
Bis Anfang des 20. Jahrhunderts war die Erkrankung weltweit präsent. Durch systematische Test- und Keulungsprogramme ist die Seuche mittlerweile in Westeuropa und Nordamerika erfolgreich getilgt und ihr Erreger kam bis 2009 vor allem in Afrika, Asien und Südamerika[8] vor. In Deutschland trat der letzte Fall bei der heimischen Equidenpopulation 1955 auf, der letzte Krankheitsfall 1995,[9] und die letzte Rotzerkrankung beim Menschen auf deutschem Boden wurde 1973 diagnostiziert.[10] Ende Januar 2015 wurde der Rotz erstmals seit 60 Jahren wieder bei einem Pferd in Deutschland durch den Nachweis Rotz-spezifischer DNA amtlich festgestellt. Das Pferd zeigte keine klinischen Symptome und auch die bakteriologische Untersuchung zuvor verlief negativ.[11][12] Der Infektionsweg für diese Infektion eines Pferdes in Niedersachsen, das vorher in Schleswig-Holstein gehalten wurde, ist unklar.[13] Eine Reihenuntersuchung von 70 Proben hat keine Hinweise auf eine Rotzinfektion in Schleswig-Holstein ergeben.[14]
Zwischen 1996 und 2003 kam der Rotz der Equiden in Bolivien, Brasilien, Eritrea, Äthiopien, Iran, Lettland, der Mongolei, Myanmar, Pakistan, der Türkei und Belarus vor. Im gleichen Zeitraum wurde von Fällen humaner Rotzerkrankung aus Kamerun, Curaçao, Sri Lanka, der Türkei und den USA (Laborinfektion) berichtet.[15] 2007 wurden aus Indien (Kaschmir)[16] und Russland (Südostsibirien)[17] erneut Ausbrüche von Rotz bei Pferden bekannt.
Als nicht rotzfrei oder endemisch durchseucht gelten gemäß Einstufung der Weltorganisation für Tiergesundheit (OIE) zurzeit Brasilien, Indien, Iran und die Mongolei. In Brasilien und Indien ist die Seuche auf bestimmte Regionen begrenzt.
Allgemein ist zwischen Ländern mit offenen Ausbrüchen von Rotz und Ländern mit ausschließlich stillen Infektionen (serologischer Prävalenz) zu unterscheiden. Aus sozioökonomischen Gründen ist nicht in allen Nationen eine konsequente staatliche Überwachung und Bekämpfung des Malleus möglich. Auch sind die an die OIE gemeldeten Daten oft unvollständig. Deshalb ist von der Existenz weiterer endemischer Herde in Afrika, Ostasien, dem Irak, der Türkei und Osteuropa auszugehen. Die Globalisierung des Pferdehandels und Reitsports ermöglicht jederzeit eine Neueinschleppung der Seuche in rotzfreie Gebiete. Diese Gefahr drohte zuletzt 2004 in Dubai und 2005 in Deutschland[1] durch importierte Pferde, die sich jedoch noch in Quarantäne befanden und daher keinen Kontakt zu einheimischen Tierbeständen hatten.[18]
Seit den 1990er Jahren ist die Anzahl rotzkranker Renn-, Militär- und Hobbypferde in Asien und Südamerika kontinuierlich angestiegen, Rotz gilt deshalb als wiederaufflammende Tierseuche (re-emerging disease).[19]
Ätiologie
[Bearbeiten | Quelltext bearbeiten]Der Erreger der Rotzerkrankung ist das Bakterium Burkholderia mallei. Obwohl seit 1993 in die Gattung Burkholderia eingeordnet, wird die frühere Bezeichnung Pseudomonas mallei z. T. noch synonym verwendet.

Burkholderia mallei ist ein gramnegatives Stäbchen, das keine Endosporen bildet und bei 37 °C unter aeroben Bedingungen langsames Wachstum auf einfachen oder zusammengesetzten Nährböden zeigt. Obwohl das Bakterium keine Kapsel im eigentlichen Sinn besitzt, weist es eine kapselähnliche Struktur aus neutralen Zuckerverbindungen auf.[20] Das Fehlen der Begeißelung und die daraus resultierende Unbeweglichkeit stellen ein wichtiges diagnostisches Kriterium dar.
Darüber hinaus grenzt sich Burkholderia mallei gegen andere Mitglieder der Gattungen Burkholderia und Pseudomonas durch seinen echten Parasitismus ab, das heißt, der Erreger kommt in erster Linie im infizierten Organismus vor.[21] Die Virulenz eines Stammes kann sich nach gezielter Übertragung auf hoch empfängliche Wirte (Beimpfung) erhöhen.[21] Frei in der Umwelt ist er dagegen nur mäßig stabil und zeigt sich empfindlich gegen Austrocknung, Licht sowie gängige Desinfektionsmittel. Während er in eingetrockneten Sekreten bereits nach drei Tagen seine Ansteckungsfähigkeit verliert, kann er an feuchten, dunklen Stellen mehrere Wochen infektiös bleiben.[22]
Mit dem Erreger des Pseudorotzes, Burkholderia pseudomallei, weist er im Genomvergleich etwa 70 % Übereinstimmung auf. Eine mögliche These ist, dass der Erreger des Rotzes sich aus Burkholderia pseudomallei entwickelt hat.[23] Die enge Verwandtschaft beider Erreger führt zu ähnlichen Krankheitsbildern und beeinflusst auch die Aussagekraft der serologischen Diagnostik.
Epidemiologie
[Bearbeiten | Quelltext bearbeiten]Wirtsspektrum
[Bearbeiten | Quelltext bearbeiten]Rotz ist eine Erkrankung der Unpaarhufer (Perissodactyla), speziell jedoch der Equidae.[19] Die Hauptwirte für Burkholderia mallei sind Pferde, Esel sowie deren Kreuzungsprodukte. Vom Zebra als potentiellem Wirt ist ebenfalls auszugehen. Bei engem Kontakt zu infizierten Equidae können sich außer dem Menschen auch weitere Säuger-Spezies infizieren. Unter den Haustieren gilt dabei das Kamel als besonders empfindlich.[24] Fälle von natürlichen Rotzinfektionen sind auch für Hunde, Katzen und Ziegen beschrieben.
Bei den Fleischfressern scheinen die Katzen (Felidae) eine erhöhte Empfänglichkeit zu besitzen. Ausbrüche bei Großkatzen in Gefangenschaft sind bekannt, bei Hauskatzen kommen sporadische Erkrankungen vor. Auch Wildtiere wie Bären, Wölfe, Feldmäuse, Kaninchen und Wühlmäuse können sich infizieren. Eine mögliche Erkrankung von Elefanten im Zoo ist ebenfalls dokumentiert.[25] Rinder, Schweine und Vögel gelten für natürliche Infektionen als nicht empfänglich.[26]
Eine experimentelle Infektion ist – mit Ausnahme des Schweines – bei den meisten domestizierten Tierarten möglich. Unter den Nagetieren gelten Hamster und Meerschweinchen als besonders empfänglich, während Hausmäuse nur durch eine sehr hohe Erregerdosis infiziert werden können.
Infektionsquellen und Übertragungswege
[Bearbeiten | Quelltext bearbeiten]Die Infektion mit Burkholderia mallei erfolgt meist über den Mundweg (peroral) und durch Hautkontakt – seltener als Tröpfcheninfektion über die Luft (aerogen) – durch infizierte Pferde. Alle Körperausscheidungen sowie Blut können erregerhaltig sein. Als besonders infektiös gelten Nasensekret, Lungenauswurf, Speichel sowie Eiter aus frisch eröffneten Hautwunden.[27] Die Ansteckung erfolgt durch direkten Tierkontakt oder indirekt über kontaminierte Gegenstände. Eine zentrale Rolle spielt dabei die gemeinsame Nutzung von Krippen und Tränken.[28] Einstreu, Putzzeug, Geschirre sowie mangelhaft desinfizierte tierärztliche Instrumente stellen weitere Infektionsquellen dar. Die Übertragung kann auch über den Deckakt erfolgen.[29] Die Infektion der Leibesfrucht im Muttertier („vertikale Übertragung“) ist möglich, jedoch selten.[30]
Die Übertragung des Erregers auf den Menschen findet oft als Schmutz- und Schmierinfektion durch direkten Kontakt mit kranken Individuen und deren Ausscheidungen statt. Eine weitere Möglichkeit der direkten Infektion ist die Arbeit mit infektiösem Gewebe oder Bakterienkulturen. In der Regel erfolgt der Eintrag des Erregers über kleine Hautwunden.[31] Eine mögliche Durchdringung (Penetration) unverletzter Haut wird vermutet, bleibt aber unbewiesen. Auch Infektionen durch Einatmen (Inhalation) sowie über die Mund-, Augen- und Nasenschleimhäute (oral, konjunktival und nasal) sind möglich.[32] Von Infektionen nach dem Verzehr von Fleisch rotzkranker Tiere wurde berichtet.[33] Eine Übertragung durch den sexuellen Kontakt von Mensch zu Mensch ist in mindestens zwei Fällen belegt.
Fleischfressende Tiere infizieren sich üblicherweise über die Aufnahme von Fleisch, das von rotzkranken Pferden oder Eseln stammt.[34]
Verbreitung der Seuche und Erregerreservoir
[Bearbeiten | Quelltext bearbeiten]Die in vielen Ländern erfolgreich durchgeführte Tilgung des Rotzes belegt, dass die Equiden das einzige natürliche Reservoir darstellen. Die Einschleppung erfolgt durch Einstallung erkrankter oder latent infizierter Tiere, wobei letzteren beträchtliche epidemiologische Bedeutung beizumessen ist.
Da die Empfänglichkeit des einzelnen Tieres von Infektionsdosis, Übertragungsweg und individueller Konstitution abhängt, zeigt die Infektion unter normalen Haltungsbedingungen nur eine langsame Ausbreitungstendenz. Eine Haltung auf engem Raum begünstigt eine Infektion, die Rotzerkrankung gehört deshalb zu den echten Stallseuchen.[28] In der Regel erkranken zuerst die Boxennachbarn. Die Übertragung auf andere Pferde wird jedoch durch natürliches Herden- und Sozialverhalten wie Fellpflege, Beschnuppern und Schnauben wirksam gefördert (so genannte Kontaktseuche). Obwohl Rotz keinen ausgeprägten Saisoncharakter aufweist, kann es in der feuchtkalten Jahreszeit zu gehäuftem Auftreten kommen.
Häufiger Tierwechsel mit vielen Zu- und Abgängen erhöht das Risiko der Einschleppung. Schlechte Haltungsbedingungen, hohe Leistungsanforderungen und ein schlechter Immunstatus gelten als die Infektion fördernde (prädisponierende) Faktoren, die negativen Einfluss auf die Häufigkeit klinisch sichtbarer (manifester) Erkrankungen und den klinischen Verlauf nehmen.[35] Klinischer Rotz trat daher in der Vergangenheit oft gehäuft oder sogar seuchenhaft bei Armeetieren,[26] in Großstädten, bei Fuhrmanns-[30] und Grubenpferden sowie in Gestüten, Sowchosen und Kolchosen auf (Epidemien).
Der Rotz als Kriegstierseuche
[Bearbeiten | Quelltext bearbeiten]Die Kriege des 17. bis 20. Jahrhunderts hatten weltweit eine starke Ausbreitung des Rotzes zur Folge. Die Zusammenstellung berittener Einheiten erfolgte üblicherweise aus Pferden gemischter Herkunft ohne wirksame Eingangskontrolle.[36] Der Transport in die Kriegsgebiete war – vor allem auf dem Seeweg – mit erheblichem Stress verbunden und konnte bereits die Erkrankung auslösen.[37] Die Ausstattung an Pflegepersonal und Veterinären war in der Regel der Tierzahl nicht angemessen.[38]

Während des Kriegsdienstes wurde das Immunsystem der Tiere durch Überanstrengung, Verletzungen, Infektionskrankheiten (z. B. Räude), Mangelernährung, Hitze- und Kältestress stark geschwächt. Die Unterbringung erfolgte in überbelegten, unzureichenden Stallungen, die gemeinsame Nutzung von Tränken, Eimern, Trögen und anderem Zubehör war die Regel. In Pferdedepots und Lazaretten wurden große Tiermengen aufgestallt, die erhebliche Zu- und Abgänge zu verzeichnen hatten.[39] Durch Zusammenschluss und Austausch von Truppenteilen sowie Lieferung von Ersatzpferden erfolgte ein Tierverkehr über weite Strecken.[40] Gründliche diagnostische Untersuchungen der Tiere konnten aus Mangel an Zeit, qualifiziertem Personal und optimaler Ausstattung auch im 20. Jahrhundert nicht immer durchgeführt werden. Der Kontakt mit feindlichen berittenen Einheiten oder einheimischen Equiden sowie die Requirierung von Beutepferden aus verseuchten Gebieten förderte die Einschleppung des Erregers und weitere Verbreitung der Infektion.
In den kriegsführenden Ländern waren die eigentlichen Seuchenspitzen jedoch regelmäßig erst nach Beendigung der bewaffneten Konflikte und Rückkehr der durchseuchten Tiere von der Front zu verzeichnen. Überflüssige Tiere aus Armeebeständen wurden oft ausgemustert und an die Zivilbevölkerung veräußert,[41] was die flächenhafte Ausbreitung der Infektion vor allem in den USA nach dem Amerikanischen Bürgerkrieg enorm förderte.[42] Der durch die Aushebung oder Tierverluste bedingte Mangel an Pferden wurde darüber hinaus auch durch Ankauf von Pferden aus anderen Gebieten gedeckt und begünstigte den Handel mit kranken oder minderwertigen Tieren.[43] Flüchtlingsströme aus den Ostgebieten trugen nach den beiden Weltkriegen maßgeblich zu lokalem Seuchenanstieg bei. Die Zerstörung veterinärbehördlicher Strukturen in besiegten Nationen führte zu verzögerter Bekämpfung des Rotzes.[44]
Ansteckungsgefährdung für den Menschen
[Bearbeiten | Quelltext bearbeiten]Da die natürliche Übertragung vom Pferd auf den Menschen nur unregelmäßig und nicht besonders effizient stattfindet, sind Rotz-Epidemien beim Menschen unbekannt. Selbst bei einer Erkrankungshäufigkeit (Morbidität) von 5–30 % in der Pferdepopulation bleibt die humane Erkrankung ein seltenes Ereignis.[45] Bei erfolgreicher Übertragung gelten jedoch schon wenige Keime als ausreichend, um eine klinische Erkrankung auszulösen.[22]
Traditionell tritt sie als gelegentliche (sporadische) Einzelerkrankung in Bevölkerungsgruppen auf, die gehäuft engen Kontakt zu Pferden haben oder mit infektiösem Material in Berührung kommen können. Zur Risikogruppe gehören daher Veterinäre, Labor- und Schlachthofpersonal, Tierpfleger sowie andere Pferd-assoziierte Berufe.[46] In Gegenden, wo der Rotz nicht endemisch vorkommt oder erstmals eingeschleppt wird (1876 in Kuba), treten gehäuft akute Verläufe von Rotz beim Menschen auf.[47] Während deutsche Soldaten und Veterinäre im Ersten Weltkrieg ernstlich akut erkrankten, zeigten kriegsgefangene Russen dagegen oft einen chronischen Verlauf mit guter Heilungstendenz.[29][35] Die Existenz unerkannt verlaufender, milder oder symptomarmer (subklinischer) Infektionen muss daher ebenfalls berücksichtigt werden. Studien über menschliche Autopsien in Endemiegebieten wiesen Rotz-assoziierte Knötchen bei vielen Menschen nach, die Kontakt zu Pferden gehabt hatten.[45]
In der Laborarbeit hingegen ist B. mallei hochinfektiös, vor allem bei der Entstehung von Gemischen aus Gas oder Luft mit Erregerpartikeln (Aerosolen). Hier kann die Erkrankungsrate bis auf 46 % ansteigen.[45]
Pathogenese
[Bearbeiten | Quelltext bearbeiten]Virulenzfaktoren
[Bearbeiten | Quelltext bearbeiten]Über die Virulenzfaktoren ist bisher noch wenig bekannt. Das Bakterium kommt teilweise intrazellulär vor, was die Bekämpfung durch die Immunabwehr erschwert. Einen weiteren Schutz vor der Elimination durch Fresszellen (Phagozytose) bietet ihm seine kapselähnliche Substanz. Da das Bakterium nach Zerstörung dieser Pseudokapsel für Labormäuse im Infektionsversuch harmlos (avirulent) wird, scheint hier ein Hauptfaktor für seine Virulenz zu liegen.[48]
Die krankmachende Wirkung beruht überwiegend auf der Produktion von Bakterientoxinen, zu denen unter anderem Endotoxine und hitzelabile Toxine gehören.[49] Das Erbgut (Genom) von Burkholderia mallei ist stellenweise hochvariabel. Dies führt nicht nur zur Ausbildung von Stämmen unterschiedlicher Aggressivität, sondern auch zur Bildung voneinander abweichender Oberflächenstrukturen, die vom Immunsystem nicht mehr erkannt werden (antigene Drift).[50]
Ausbreitung im Wirtsorganismus
[Bearbeiten | Quelltext bearbeiten]
Die Ausbreitung des Erregers im Wirt ist mit der Tuberkulose vergleichbar. Im Regelfall stellt der Nasen-Rachen-Raum die Eintrittspforte („Entstehung des Primäraffekts“) dar. Über die ableitenden Lymphbahnen (lymphogen) erfolgt die anschließende Infektion des zuständigen regionären Lymphknotens („Bildung des Primärkomplexes“), in dem sich erste Rotz-Granulome bilden.[51] Über die Blutbahn (hämatogen) oder lymphogen erfolgt je nach Abwehrlage des Organismus die Ausbreitung in weitere Organe, vor allem in die Lunge.[52] Dort kommt es zur Bildung der für die Infektion typischen Rotzveränderungen. Die Infektion kann an diesem Punkt zum Stillstand kommen, oder es erfolgt die langsam fortschreitende (protrahierte) Abschwemmung des Erregers (Dissemination) in weitere Organe und Gewebe.[53] Erreicht der Erreger nach Infektion der Bronchien und Bronchioli den Hohlraum der luftleitenden Wege, so kann durch Hochhusten infektiösen Materials auf sekundärem Wege eine Kontaktinfektion der oberen Atemwege stattfinden (kanalikuläre Ausbreitung).[54] Bei einer Erregeraufnahme über Einatmen entsteht der primäre Nasenrotz, nach Eintritt über verletzte Haut der primäre Hautrotz.[55]
Immunologie
[Bearbeiten | Quelltext bearbeiten]Auch das Überstehen einer Infektion führt nicht zu einer belastbaren Immunität, das heißt, der Organismus ist nicht vor einer Neuerkrankung geschützt. Im Rahmen der Immunreaktion werden vom Wirt Agglutinine zur Immobilisierung des Erregers gebildet, die in der serologischen Diagnostik nachweisbar sind. Trotz der Bildung von Antikörpern ist die eigentliche effektive Immunreaktion durch Makrophagen und T-Zellen vermittelt. Die Verabreichung von Totimpfstoffen führte zwar gelegentlich bei Einzeltieren zu einer Minderung der Empfänglichkeit gegenüber der Infektion, bietet jedoch keinen generellen verlässlichen Schutz.[56] In der Vergangenheit konnte eine Boosterung des Immunsystems durch das Verabreichen von Mallein in Einzelfällen zu einer klinischen Besserung bei rotzkranken Pferden führen. Neue Forschungsergebnisse zeigen im Tierversuch eine verbesserte Schutzwirkung des Organismus durch Verabreichung γ-Interferon-stimulierender Substanzen.[57] Diese so genannten cationic liposome DNA complexes (CLDC) könnten als Grundlage für die Entwicklung einer Expositionsprophylaxe dienen.
Klinisches Bild
[Bearbeiten | Quelltext bearbeiten]Symptome und Verlauf bei Pferden
[Bearbeiten | Quelltext bearbeiten]Die Rotzerkrankung bei Pferden kann akut oder chronisch verlaufen; es sind auch latente Infektionen möglich. Je nach Manifestationsort der Veränderungen unterscheidet man folgende Typen des Rotzes:
- Malleus farciminosus (Hautrotz)
- Malleus humidus (Nasenrotz)
- Malleuspneumonie (Lungenrotz)
Diese Einteilung ist historisch bedingt und gilt heute als nicht mehr aktuell.[58] Die Übergänge zwischen den einzelnen Formen sind fließend, und die Tiere weisen oft gleichzeitig mehrere Symptomkomplexe auf. Das gleichzeitige Auftreten aller Formen wurde früher auch als Rotzwurmkrankheit bezeichnet. Die Inkubationszeit variiert zwischen drei Tagen und mehreren Wochen.
Akuter Rotz
[Bearbeiten | Quelltext bearbeiten]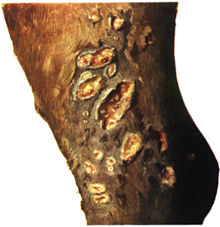
Die akute Verlaufsform ist typisch für Esel sowie Kreuzungsprodukte[35] und wird auch bei ca. drei bis zwölf Prozent an Rotz erkrankter Pferde beobachtet.[59] Der akute Rotz beginnt unspezifisch mit Schüttelfrost und hohem Fieber (40–41 °C), ein- oder beidseitigem Nasenausfluss und einer Rötung (Hyperämie) der Kopfschleimhäute.
Die Kehlgangslymphknoten sowie benachbarte Lymphbahnen und Lymphdrüsen sind oft geschwollen, schmerzhaft und teils mit Abszessen durchsetzt. Auf den Schleimhäuten der Nase, Nebenhöhlen, Luftröhre, Kehlkopf, Schlundkopf sowie auf der Haut bilden sich großflächig jauchig-geschwürige (diphtheroide) Beläge, Knötchen sowie einzelne Geschwüre, die sich schnell ausbreiten. In der Haut kann es zum Absterben handtellergroßer Areale kommen (Hautgangrän). Die Bindegewebsschichten (Submucosa) der Kopfschleimhäute, der Unterhaut und der Muskulatur sind sulzig verändert, mit blutiger Flüssigkeit durchtränkt (entzündliche Exsudation) und geschwollen. Die Ansammlung von Gewebewasser (Ödem) in der Nasenschleimhaut und im Kehlkopfbereich erschwert zusammen mit dem zähen Nasensekret die Atmung. Im Verlauf der Erkrankung verändert der Nasenausfluss sein Aussehen von wässrig über schleimig-eitrig zu blutig-jauchig. Er kann mit Futter oder Speichelresten vermischt sein. Die schmerzhafte Beteiligung des Schlundkopfes führt zum Auswürgen (Regurgitieren) von Futter und zu Schluckbeschwerden, so dass die Futteraufnahme schnell zurückgeht.[60] Bisweilen entsteht eitriger Augenausfluss, in Einzelfällen werden zentralnervöse Symptome beobachtet. Beim Esel sind eigentümlich steife Hals- und Kopfhaltung sowie Lahmheiten beschrieben.[35]
Im weiteren zeigen die Tiere Bewegungsunlust, Abmagerung, Durchfall und Proteinverlust über die Nieren (Proteinurie). Sie werden schnell hinfällig und verenden oft aufgrund einer Lungenentzündung und multiplen Organmetastasen. Esel und Hybride erkranken in der Regel akut bis subakut an Nasen- und Lungenrotz, ein stürmischer septikämischer Verlauf ist ebenfalls möglich.
Chronischer Rotz
[Bearbeiten | Quelltext bearbeiten]Der chronische Rotz tritt überwiegend beim Pferd auf. Die Symptome sind bisweilen nur schwach ausgeprägt und können deshalb zu Anfang und bei nur geringer Belastung leicht übersehen werden. Die Krankheit zieht sich oft jahrelang hin und verläuft in unregelmäßigen fieberhaften Schüben. Die Kehlgangslymphknoten sind meistens reaktiv verändert (derb und knotig), jedoch schmerzlos und aufgrund von Verwachsungen nicht mehr frei verschiebbar. Da die Lunge beim chronischen Geschehen in der Regel mitbeteiligt ist,[61] treten Husten und Atembeschwerden auf. Diese können von einer nur leichten Dyspnoe bei Belastung bis zur Dämpfigkeit variieren. Rasche Ermüdbarkeit, Abmagerung und struppiges Fell sind häufig beobachtete Allgemeinsymptome.[62]
Zusätzlich können Anzeichen von Nasenrotz vorliegen, dieser kann sich in ein- oder beidseitigem Nasenausfluss oder Nasenbluten äußern. Rotzige Knötchen oder Geschwüre können fehlen oder erst sehr spät auftreten, sie finden sich am Nasenseptum und den Nasenmuscheln sowie am Kehlkopf und in der Luftröhre. Der Nasenausfluss ist grauweiß-schleimig bis graugelb-klebrig, er kann Blutbeimengungen und Schleimhautfetzen enthalten. Abgeheilte Veränderungen früherer Rotzschübe sind in der Regel in Form der typischen eisblumenförmigen „Rotznarben“ in der Nasenschleimhaut und in der Luftröhre zu finden. Hautrotz tritt nur in zehn Prozent der Fälle auf.[63] Häufig betroffene Stellen (Prädilektionsstellen) sind die Areale erhöhter mechanischer Belastung (Geschirrlage, Sattellage) an Kopf, Unterbauch, Brust und Hintergliedmaßen. In Haut und Unterhaut entstehen erbsen- bis walnussgroße Knötchen und Abszesse, die geschwürig zerfallen (Dermatitis malleosa ulcerosa), sich jedoch auch wieder zurückbilden können („fliegender Rotz“).[64] Aus eröffneten Herden fließt gelartiger gelblich-grauer Eiter (farcy oil) ab.

Die regionären Lymphknoten schwellen schmerzhaft an. Sind die Lymphknoten der Schenkel betroffen, zeigen die Tiere periodisch auftretende Lahmheit. Die Lymphgefäße im Einzugsbereich der Hautveränderungen sind verhärtet, verdreht und treten wurmstrangartig hervor (farcy pipes). In ihrem weiteren Verlauf können sich perlschnurartige, abszedierende Auftreibungen bilden (Rosenkranz), die sich teilweise nach außen entleeren. Der Hautrotz heilt oft nur schlecht und unter exzessiver Narbenbildung aus. Oft kommt es über den Rumpf verteilt zur Bildung faustgroßer Schwellungen in den tieferen Muskelschichten. Im fortgeschrittenen Stadium kommt es zu Schwellungen an Bauch, Brust, Beinen und den Gelenken. Im Bereich der Hintergliedmaßen bildet sich durch fortgesetzte Lymphabflussstörung und Entzündung der Unterhaut eventuell die so genannte Rotzphlegmone (Dermatitis malleosa diffusa phlegmonasa), die in seltenen Fällen von einer Elephantiasis (Elephantiasis malleosa) begleitet wird. Männliche Tiere zeigen eine Entzündung der Hoden (Orchitis) sowie Schwellungen an Hodensack und äußerem Genitale.[65] Rotzherde in den Knochen führen zu erhöhter Knochenbrüchigkeit, vor allem der Rippen.
Latente Infektion
[Bearbeiten | Quelltext bearbeiten]Die latente Verlaufsform kommt bei Pferden mit guter Abwehrlage vor. Sie verläuft in der Regel still bzw. subklinisch (ohne klinische Symptome), gelegentlich können leichter Nasenausfluss sowie eine subklinische Orchitis beobachtet werden. Solange ein Kräftegleichgewicht zwischen Wirt und Erreger besteht, ruht die Infektion. Bei einer Schwächung des Immunsystems wird sie jedoch aktiviert, latent infizierte Tiere können daher wieder zu Ausscheidern werden.
Symptome und Verlauf beim Menschen
[Bearbeiten | Quelltext bearbeiten]| Verlaufsform | Letalität unbehandelt | Letalität behandelt[66] |
|---|---|---|
| Septikämie | > 95 % | > 50 % |
| Lungenform | 90–95 % | ≈ 40 % |
| Akute Lokalinfektion | Formwechsel | ≈ 20 % |
| Chronische Form | unbekannt | ≈ 50 % |
Die Erscheinungsformen der Erkrankung beim Menschen sind abhängig von der Eintrittspforte und der Ausbreitungstendenz des Erregers. Es wird zwischen der Septikämie, dem Lungenrotz, der akuten lokalen Form sowie dem chronischen Rotz unterschieden. Alle Verlaufsformen können ineinander übergehen, wobei es zur Überlagerung verschiedener Symptomkomplexe kommt. Die Inkubationszeit ist abhängig von der Manifestationsform. Sie beträgt ein bis fünf Tage für den septikämischen Verlauf sowie die lokale Form und 10–14 Tage bei der Lungenform.
Akutes Auftreten von Fieber, Schüttelfrost, Muskel-, Kopf- und Brustschmerzen kennzeichnen den Beginn der Septikämie. Daneben treten Hitzewallungen, Hautausschläge, Veränderungen der Lymphknoten, bläulich verfärbte Schleimhäute (Zyanose), Lichtscheu sowie granulomatöse bzw. nekrotisierende Hautläsionen auf. Erhöhte Herzfrequenz (Tachykardie), Milz- und Leberschwellung, Gelbsucht und Durchfall weisen auf die Beteiligung innerer Organe hin. Der Tod tritt in der Regel 24–48 Stunden nach Auftreten der ersten Symptome durch Multiorganversagen ein.
Die lokalisierte Form ist charakterisiert durch das Auftreten von Knötchen, Abszessen und Geschwüren in den Schleimhäuten, der Haut, den Lymphgefäßen oder des Bindegewebes lokal an der Eintrittspforte. Bei Beteiligung der Schleimhäute kann sich schleimig-eitriger Ausfluss entwickeln, der zum Teil Blutbeimengungen enthält. Das Auftreten rotzspezifischer Läsionen wird von Allgemeinsymptomen wie Fieber, Schweißausbrüchen und Unwohlsein begleitet. Die regionalen Lymphknoten schwellen an und bilden Abszesse, die aufbrechen. Nach ein- bis vierwöchiger Krankheitsdauer besteht die Gefahr einer streuenden (disseminierten) Infektion, die sich durch Hautausschläge sowie Abszesse in inneren Organen zeigt. In erster Linie sind Leber, Milz und Lunge betroffen, prinzipiell können aber sämtliche Weichteilgewebe infiziert werden. Disseminierte Infektionen sind oft die Vorstufe zur Septikämie.
Die Lungenform entwickelt sich oft nach Inhalation des Erregers oder durch die Streuung auf dem Blutwege, ausgehend von anderen Formen. Sie ist charakterisiert durch Lungenabszesse, Pleuraergüsse und Lungenentzündung. Die Symptome umfassen Fieber, Schweißausbrüche, Husten, Brustschmerzen und Atemnot. In der Nase entstehen Geschwüre und Knötchen, begleitet von schleimig-eitrigem (mukopurulentem) Ausfluss. Nach einigen Monaten entwickeln sich zum Teil Hautabszesse. Unbehandelt führt die Lungenform oft zum septikämischen Verlauf.
Der chronische Rotz des Menschen ist gekennzeichnet durch Knötchen, Abszesse und Geschwüre in einer Vielzahl von Organen und Geweben. Haut, Unterhaut, Leber, Milz, Magen-Darm-Trakt, Atemtrakt sowie die Skelettmuskulatur können betroffen sein. Die Symptome sind milder als beim akuten Verlauf, es kommt periodisch zu fieberhaften Rezidiven. Gewichtsverlust und Veränderungen der Lymphknoten (Lymphadenopathie) werden häufig beobachtet.
Prognose
[Bearbeiten | Quelltext bearbeiten]
Die Prognose ist abhängig von Wirtsspezies, Infektionsdosis, Infektionsweg, Virulenz des Erregers, Manifestationsort der Erkrankung, Verlauf und Therapiebeginn.
Akuter Rotz endet in der Regel bei Menschen, Equiden und Fleischfressern unbehandelt nach zwei Wochen tödlich. Klinisch manifester chronischer Rotz kann sich beim Pferd bis zu sieben Jahren hinziehen,[67] beim Menschen sind Verläufe über 25 Jahre bekannt. Fortschreitender Kräfteverfall führt letztlich zum Tod durch Auszehrung (Rotzkachexie),[59] der Tod tritt bisweilen auch plötzlich durch Lungenblutung ein.[64] Chronischer Hautrotz ist prognostisch ungünstig einzustufen. Bei milderem Verlauf der chronischen Erkrankung, guter Pflege und ausreichender Ruhe wurde beim Pferd in der Vergangenheit ein fast vollständiges Verschwinden der Symptome (Remission) innerhalb von drei bis sechs Monaten beobachtet.[68] Stressfaktoren können zwar jederzeit einen Rückfall (Rezidiv) mit Verschlimmerung des Krankheitsbildes zur Folge haben, die Ausheilung ist jedoch auch oft von Dauer.[69]
Von der erfolgreichen Genesung chronisch erkrankter Menschen liegen Erfahrungen aus dem Ersten Weltkrieg vor. Latente Infektionen können spontan ausheilen oder in eine klinisch sichtbare Form der Erkrankung übergehen.
Pathologie
[Bearbeiten | Quelltext bearbeiten]Pathologisch-anatomische Veränderungen
[Bearbeiten | Quelltext bearbeiten]Das pathologische Bild variiert in Abhängigkeit von Manifestationsort, Verlaufsform und Alter der Erkrankung. Während die akute Form eher durch Prozesse gekennzeichnet ist, die mit Gewebezerfall und Entstehung von entzündlichen Sekreten einhergehen („exsudativ-nekrotisierend“), dominiert bei chronischen Verläufen die Granulom- und Gewebeneubildung („produktiv-proliferativ“).[70] Von zentraler diagnostischer Bedeutung (pathognomonisch) ist der Nachweis der spezifischen Rotzknötchen und ihrer verschiedenen Entwicklungsstadien.

Beim akuten Rotz finden sich Erosionen und Rotzknötchen variabler Größe (hirsekorn- bis stecknadelkopfgroß) in den oberen Atemwegen, der Lunge, Haut und Lymphknoten, seltener jedoch in Leber, Milz, Hoden und Knochen. Beim chronischen Rotz sind sie in allen Organen, Weichteilgeweben sowie in Knochen zu finden. Die Farbe ist grauweiß-rötlich und glasig, die Konsistenz variiert von weich zu fest. Als Zeichen chronischer Infektionen und Abheilung können zentral Verkäsungen oder Kalkeinlagerungen auftreten. Nach außen hin sind die Knötchen deutlich durch einen entzündlich geröteten (hämorrhagischen) Randsaum abgegrenzt. Sie zerfallen oft unter Freisetzen von missfarbenem gelblich grünem Eiter und Bildung eines wallartigen Randes. Die so entstandenen Rotzgeschwüre können großflächig zusammenfließen und vor allem in den Kopfschleimhäuten auf Knorpel- und Knochengewebe übergreifen. In Abhängigkeit von den betroffenen Gewebeschichten erfolgt die Wundheilung ohne sichtbare Narben, durch Bildung kleiner weißer Knötchen oder in Form der typischen Rotznarben. Diese sind sternförmig oder eisblumenartig und weisen einen strahligen Verlauf der Narbenleisten auf. Nasenscheidewand, Nasenmuscheln und Gaumen können perforiert sein.[71]
Das pathologische Bild der Lunge ist geprägt von vergrößerten Lymphknoten sowie von Rotzknötchen variabler Zahl und Verteilung (Knötchenrotz). Beim akuten Rotz wird oft eine katarrhalische Form der Lungenentzündung beobachtet. Diese ist gekennzeichnet durch das Vorkommen linsen- bis erbsengroßer Herde, die braunrot verfestigt sind und zentrale Erweichung zeigen. Angrenzendes Gewebe ist dabei gelblich-sulzig durchtränkt, und es kommt zu Ergüssen in die Pleurahöhlen.
Durch Zusammenfließen mehrerer Knötchen entstehen im Lungengewebe die haselnuss- bis walnussgroßen Rotzknoten. Durch Einschmelzung bilden sich dabei Hohlräume (Kavernen). Die Rotzknoten dienen unter anderem als Ausgangspunkt der so genannten lobären malleösen Pneumonie. Diese katarrhalisch-eitrige Form der Lungenentzündung weist keine erregertypischen Besonderheiten auf. Sie kann in eine chronisch-indurative Pneumonie übergehen, für die das parallele Vorliegen frischer Veränderungen neben bereits verhärteten, verkästen oder bindegewebig abgegrenzten Herden typisch ist. Die darin enthaltenen aktiven Herde können den Erreger noch lange Zeit beherbergen. Die Abheilung der Rotzknoten erfolgt durch Verkalkung sowie kontinuierliche Zubildung mit derbem Bindegewebe (Schwielenrotz).
In der Haut, Unterhaut und Muskulatur finden sich Rotzknoten mit zentraler, eitriger Erweichung, die von der Umgebung zum Teil bindegewebig abgegrenzt sind. Die entstandenen Geschwüre weisen eine fünfpfenniggroße Öffnung (ca. 18 mm Durchmesser), roten speckigen Geschwürboden sowie einen gezackten, aufgeworfenen Rand auf (Kesselgeschwüre).[72] Die Wände der Lymphbahnen und ihre Umgebung sind speckig verdickt. Die Lymphknoten sind vergrößert, speckig, mit Rotzknötchen durchsetzt und durch bindegewebige Neubildungen mit ihrer Umgebung verwachsen. An den Gliedmaßen ist die rotzige Lymphangitis oft mit ausgedehnten Entzündungen der Unterhaut vergesellschaftet. In diesem Zusammenhang können auch massive diffuse bindegewebige Zubildungen mit knotigen Hautverdickungen beobachtet werden (Pachydermie).
Histologie
[Bearbeiten | Quelltext bearbeiten]
Die typischen Rotzknötchen stellen aus histologischer Sicht spezifische Rotzgranulome dar. Das Zentrum dieser Granulome enthält eine Zone des Zelluntergangs (Nekrose), die durch das Vorhandensein von Zelltrümmern, neutrophilen Granulozyten sowie Bakterien gekennzeichnet ist. In der subakuten Krankheitsphase wird dieser Herd durch die Epitheloidzellen nach außen hin abgedichtet bzw. abgegrenzt (histiozytäre Demarkation). Die außen anschließende Schicht enthält eine Mischung verschiedener Immunzellen: Lymphozyten, Plasmazellen und Makrophagen. Die Zone faserbildender Zellen (Fibroblasten, Fibrozyten) grenzt das Granulom nach außen hin ab, im weiteren Krankheitsverlauf wird diese Schicht durch die Einlagerung von Kollagenfibrillen zunehmend verstärkt.
Differentialdiagnosen
[Bearbeiten | Quelltext bearbeiten]Beim Pferd sind neben der Druse auch die viral bedingte Rhinopneumonitis, die Rhodococcus-equi-Infektion (Rhodokokkose) sowie weitere Pneumonien bakterieller Ursache, das Luftsackempyem, Lungenparasitosen, Pseudorotz (Melioidose), Tuberkulose, Pseudotuberkulose, Lymphangitis epizootica, Sporotrichose, Dermatophilose sowie Dermatomykosen auszuschließen. Beim Menschen kommen differentialdiagnostisch vor allem der Pseudorotz, Typhus, Syphilis, Tuberkulose, Rotlauf, Lymphangitis sowie Pyämie in Frage.
Diagnostische Verfahren
[Bearbeiten | Quelltext bearbeiten]
Diagnostik am Tier
[Bearbeiten | Quelltext bearbeiten]Die sichere Diagnosestellung anhand äußerlicher Veränderungen ist aufgrund des höchst variablen Krankheitsbildes in der Regel nicht möglich. Vor allem die eindeutige Abgrenzung zur Druse bereitet Schwierigkeiten. Eine klinische Verdachtsdiagnose kann jedoch bei Vorliegen sichtbarer rotztypischer Veränderungen im Nasenbereich oder gleichzeitigem Auftreten der einzelnen Symptomkomplexe gestellt werden. Von großer Bedeutung ist der Vorbericht. In der Vergangenheit versuchte man, den Rotzverdacht durch unsichere Methoden wie Eröffnung der Kieferhöhlen, Ausschälung der Kehlgangslymphknoten oder Punktion der Lunge zu erhärten. Zur Provokation eines eindeutigeren Krankheitsbilds setzte man die Tiere erhöhtem Stress aus oder verabreichte Mallein.[73]
Bei Lungenrotz und Beteiligung innerer Organe oder Knochen können bildgebende Verfahren (Röntgen) weitere Hinweise liefern. Rotz kann auch pathologisch-anatomisch oder histologisch durch Nachweis der rotztypischen Granulome diagnostiziert werden.[74]
Direkter Erregernachweis
[Bearbeiten | Quelltext bearbeiten]Konventionelle Labormethoden
[Bearbeiten | Quelltext bearbeiten]Für den Erregernachweis eignen sich vor allem Sputum sowie Eiter aus geschlossenen Knötchen oder frischen Verletzungen der Haut und Nasenschleimhaut. Mikroskopisch sichtbar werden gerade oder leicht gebogene Stäbchen mit abgerundeten Enden, ca. 2,5 µm × (0,3…0,8 µm) groß. Die überwiegend extrazellulär gelegenen Stäbchen färben sich in der Gram-Färbung nur schwach oder unregelmäßig an. Der mikroskopische Nachweis aus Gewebeschnitten gestaltet sich schwierig, hier finden eher immunhistochemische Methoden Verwendung. Die kulturelle Anzucht erfolgt bevorzugt auf komplexen Nährböden mit Zusätzen von Glycerol, Pferdeserum und Antibiotika. Nach 48 h Inkubation bei 37 °C wird ein feuchter, cremig-weißer Belag sichtbar, der nach Hopfen riecht und bei weiterer Bebrütung dunkler und zäher wird (honigtropfenähnlich). Die endgültige Speziesbestimmung beinhaltet neben dem Nachweis der Unbeweglichkeit auch die biochemische Charakterisierung.
Diagnostischer Tierversuch
[Bearbeiten | Quelltext bearbeiten]Ergänzend kann für den direkten Erregernachweis der Tierversuch eingesetzt werden. Er diente früher in erster Linie der Vermehrung und Reinkultivierung des Rotzbakteriums. Als Impftiere eignen sich traditionell Meerschweinchen, Mäuse, Igel und Katzen. Nach subkutaner oder intraperitonealer Infektion entwickeln männliche Meerschweinchen innerhalb weniger Tage eine tödlich endende Hoden- und Bauchfellentzündung (Strauss’sche Reaktion).
Molekularbiologische Nachweismethoden
[Bearbeiten | Quelltext bearbeiten]Der molekulargenetische Erregernachweis sowie die eindeutige Abgrenzung zu B. pseudomallei gelingt mittlerweile auch durch eine spezifische PCR, die sich jedoch noch in der Testphase (Validierung) befindet. Weitere molekulargenetische Verfahren wie RFLP, Pulsfeld-Gelelektrophorese, 16sRNA-DNA-Sequenzierung und VNTR sind nicht in allen Laboren verfügbar und dienen eher epidemiologischen Fragestellungen.
Indirekter Erregernachweis
[Bearbeiten | Quelltext bearbeiten]Zum indirekten Erregernachweis werden – je nach Fragestellung – unterschiedliche serologische Methoden oder allergische Reaktionen eingesetzt. Die Problematik all dieser Nachweisverfahren liegt einerseits in der mangelnden Abgrenzbarkeit zum Erreger des Pseudorotzes, was zu falsch positiven Ergebnissen aufgrund von Kreuzreaktionen führen kann. Da jedes Verfahren verschiedene Zeitpunkte innerhalb des Krankheitsverlaufes detektiert, sind bei alleiniger Verwendung eines bestimmten Tests falsch negative Ergebnisse möglich.
Serologische Nachweisverfahren
[Bearbeiten | Quelltext bearbeiten]
Die Serumlangsamagglutination (SLA) eignet sich nur für den Nachweis akuter Erkrankungen ab dem sechsten Tag nach Infektion.[75] zehn bis zwölf Wochen nach Infektion fällt sie bereits wieder negativ aus. Die Komplementbindungsreaktion (KBR) wird ab der zweiten Infektionswoche positiv und detektiert chronische Rotzfälle beim Pferd. Das Erscheinen spezifischer komplementbindender Antikörper (Serokonversion) erfolgt zum Teil verzögert (vierte Woche nach der Infektion) und kann in Einzelfällen ganz ausbleiben. Aufgrund ihrer insgesamt hohen Sensitivität (90–95 %) und Spezifität (99 %) ist die Methode jedoch für Kontrollen im internationalen Tierverkehr vorgeschrieben. Für Esel, Hybride und tragende Stuten ist der Test nicht geeignet. Beim Menschen erfolgt keine zuverlässige Serokonversion. Der kombinierte und wiederholte Einsatz von Agglutinations- und Komplementbindungsreaktion führte vielerorts zur erfolgreichen Tilgung des Rotzes und ist auch heute noch aktuell.
Weitere Verfahren, die vereinzelt eingesetzt werden, sind der Rose-Bengal-Test (Russland), Präzipitationstests, der Hämagglutinationshemmtest und die Immunfluoreszenz. Verschiedene ELISA-Methoden finden in der Rotzdiagnostik Anwendung und besitzen eine der KBR vergleichbare Sensitivität. Neue Techniken auf Basis monoklonaler Antikörper erlauben auch die Differenzierung zwischen B. mallei und B. pseudomallei, sind jedoch nicht validiert. Immunoblot-Verfahren werden mittlerweile eingesetzt, um positive oder fragliche KBR-Ergebnisse zu bestätigen.[76]
Malleinisierung
[Bearbeiten | Quelltext bearbeiten]
Der Mallein-Test (Syn. Mallein-Probe) beruht auf einer allergischen Reaktion vom Spättyp, die durch T-Zellen vermittelt wird. Das Mallein ist eine aufgereinigte, lösliche Komponente aus der Zellwand des Rotz-Erregers. Seit seiner Entdeckung 1890 wurde Mallein flächendeckend bei der Eradikation des Rotzes eingesetzt. Man unterscheidet zwischen drei Test-Formen:
- Bei der Mallein-Augenprobe werden einige Tropfen in den Bindehautsack eingebracht, eine positive Reaktion äußert sich innerhalb von 24 h durch eitrigen Augenausfluss sowie Schwellung der Augenlider und des Gesichtsbereiches.
- Bei der intradermal-palpebralen Inokulation werden 0,1 ml Mallein in die Haut des Unterlides injiziert, Reagenten zeigen nach 24–48 h Schwellung der Lider sowie eitrigen Augenausfluss.
- Beim subkutanen Test erfolgt die Injektion von 2,5 ml Mallein im Halsbereich, rotzkranke Tiere zeigen nach 24–48 h scharf abgegrenzte schmerzhafte Schwellungen an der Inokulationsstelle.
Eine positive Reaktion wird in der Regel bei allen drei Verfahren von hohem Fieber mit typischem Verlauf sowie Störungen des Allgemeinbefindens begleitet.
Die subkutane Methode ist die älteste, besitzt jedoch im Vergleich zu den anderen eine deutlich schlechtere Nachweiskraft. Als zuverlässigster Test wurde die intrapalpebrale Form ab dem Ersten Weltkrieg von England, Frankreich, Italien und Rumänien zur Rotzsanierung eingesetzt. Die Mallein-Augenprobe hat sich jedoch aufgrund technischer und hygienischer Vorteile gegenüber den Injektionsformen durchgesetzt. Der Mallein-Test erfasst auch inaktive Stadien der Infektion. Obwohl er insgesamt als sensitivstes Verfahren betrachtet wird, kommt es zu falsch negativen Ergebnissen bei Eseln und Hybriden (erst ab dritter Woche nach Infektion positiv) sowie beim chronischen Rotz der Pferde in weit fortgeschrittenem Stadium (Anergie). Deshalb und auch wegen der Wechselwirkung (Interferenz) des Mallein-Tests mit anschließend durchgeführten serologischen Tests (KBR) wird diese Methode mittlerweile EU-weit nicht mehr angewendet.
Therapie
[Bearbeiten | Quelltext bearbeiten]
Historische Therapieversuche
[Bearbeiten | Quelltext bearbeiten]Obwohl vor allem in der Mitte des 19. Jahrhunderts der Einsatz zahlreicher Therapeutika gegen den Rotz dokumentiert ist (z. B. Rotzschwefel, Halogenverbindungen, Phenol (veraltet Karbolsäure)), wurde die Aussichtslosigkeit nachhaltiger Heilversuche bereits früh erkannt.[77][78] In späterer Zeit führte auch die Anwendung von Rotzvakzinen und Verabreichung von Mallein nicht zum gewünschten sicheren Erfolg bei Mensch und Tier.[79] Bis ins 20. Jahrhundert galt Rotz daher in der Regel als unheilbar.[80] Erfolge konnten nur vereinzelt bei Verätzung oder Kauterisierung lokal begrenzter Veränderungen beobachtet werden.[78] Die tierärztliche Therapie rotzkranker Pferde war darüber hinaus wirtschaftlich unrentabel und wurde aufgrund der Gefährdung von Mensch und Tier kritisch hinterfragt.[81] Die Bekämpfungsschwerpunkte lagen daher beim Tier auf prophylaktischen Maßnahmen wie Verbesserung der Hygiene, Stärkung der allgemeinen Widerstandskraft und Tötung klinisch kranker Tiere.[39]
Aktuelle Therapie
[Bearbeiten | Quelltext bearbeiten]In Ländern, in denen der Rotz erfolgreich getilgt ist, herrscht ein absolutes Therapieverbot. In Endemiegebieten ohne angemessene Entschädigungszahlungen für getilgte Tiere stellen antibiotische Therapie-Versuche aus wirtschaftlichen Gründen eine Alternative zur Tötung dar.[82] Beim Menschen wird Rotz mit Hilfe von Antibiotika behandelt. Da die meisten Fälle von humaner Rotz-Erkrankung in die prä-antibiotische Ära fallen, ist das vorhandene Datenmaterial über eine wirksame Therapie begrenzt. Der Erreger ist von Natur aus bereits gegen viele Antibiotika-Wirkstoffklassen resistent. Die Auswahl möglicher Therapeutika wird durch das reduzierte Penetrationsvermögen von Wirkstoffen ins Innere der Rotzveränderungen, aber auch durch das teilweise intrazelluläre Vorkommen des Erregers weiter eingeschränkt. Unter Laborbedingungen (in vitro) wurde für Doxycyclin, Rifampicin und Ciprofloxacin eine gute Wirksamkeit ermittelt. Experimentell konnte am lebenden Tier (in vivo) für Sulfadiazin eine effektive Wirkung nachgewiesen werden. In der jüngsten Vergangenheit war bei Laborinfektionen der Therapieerfolg bei 3/4 der Fälle auf Sulfadiazin zurückzuführen; Aureomycin und Doxycyclin erwiesen sich ebenfalls als wirksam. Die Therapieempfehlungen variieren je nach Schwere und Manifestationsort der Erkrankung, in der Regel werden jedoch mehrere Antibiotika über einen Zeitraum von mindestens zwei Monaten verabreicht. Die medikamentöse Therapie kann sich bis zu einem Jahr hinziehen, sie wird bei schweren Fällen durch chirurgische Eingriffe unterstützt.[83] Empfohlen wurde (Stand 2009) für die antimikrobielle Therapie bei Menschen zunächst die intravenöse Gabe von Imipenem und Doxycyclin über zwei Wochen und danach Doxycyclin für sechs Monate oral.[84]
Bekämpfung des Rotzes
[Bearbeiten | Quelltext bearbeiten]Prävention beim Menschen
[Bearbeiten | Quelltext bearbeiten]Eine Schutzimpfung existiert nicht. Eine antibiotische Postexpositionsprophylaxe kann in einigen Fällen indiziert sein. Das gezielte Arbeiten mit dem Rotzerreger sowie infektiösen Materialien ist auf Labore der Biosicherheitsstufe 3 (Schutzstufe 3) und höher beschränkt. Besonderer Wert wird dabei auf Maßnahmen zur Verhinderung der Erregerfreisetzung und Verbreitung über die Luft gelegt. Kernpunkte sind räumliche Trennung zu anderen Laborbereichen, strenge Zugangskontrolle, Schleusen, Arbeit unter Sicherheitswerkbänken, Unterdruck im Arbeitsbereich sowie Filterung der Abluft. Strenge Schutzvorkehrungen sind auch im Umgang mit infizierten Tieren, erkrankten Menschen oder kontaminierten Materialien zu ergreifen. Die nötige Schutzkleidung schließt Handschuhe und Gesichtsschild mit ein. Zusätzliche Maßnahmen zum Schutz gegen Aerosole können angezeigt sein. Obwohl die Übertragung von Mensch zu Mensch selten vorkommt, sollten an Rotz erkrankte Patienten isoliert werden. Die beste Prävention besteht in der Eradikation des Rotzerregers aus den Tierbeständen.
Meldepflicht
[Bearbeiten | Quelltext bearbeiten]In Österreich sind Verdachts-, Erkrankungs- und Todesfälle an Rotz gemäß § 1 Abs. 1 Nummer 1 Epidemiegesetz 1950 anzeigepflichtig. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz).
Tierseuchenrechtliche Bestimmungen
[Bearbeiten | Quelltext bearbeiten]Da eine Neueinschleppung des Rotzes in seuchenfreie Gebiete durch das Vorkommen endemischer Herde jederzeit möglich ist, stellen das Verbot der Einfuhr von Einhufern aus verseuchten Regionen sowie die diagnostische Überwachung des internationalen Tierverkehrs wichtige Hauptziele der Rotzbekämpfung dar. Rechtliche Grundlagen sind § 12 des Tierseuchengesetzes, die Methodensammlung des FLI, die Binnenmarkt-Tierseuchenschutz-Verordnung, die Richtlinien 90/426/EWG, 90/425/EWG und 2009/156 EG sowie das Manual of Standards for Diagnostic Tests and Vaccines.[85]
Maßnahmen bei Seuchenausbruch
[Bearbeiten | Quelltext bearbeiten]
Gemäß der Verordnung über anzeigepflichtige Tierseuchen besteht beim Rotz Anzeigepflicht. Die Anzeige hat, auch bei bloßem klinischen Verdacht, unverzüglich beim zuständigen Veterinäramt zu erfolgen. Sie zieht eine sofortige Bestandssperrung durch den Amtstierarzt sowie umfangreiche epidemiologische und diagnostische Verfolgsuntersuchungen aller Kontakttiere nach sich. Bei Feststellung des Ausbruchs ist jegliche Therapie verboten – alle erkrankten und infizierten Tiere müssen ohne Blutentzug getötet und die Tierkörper unschädlich beseitigt werden. Grundlage für ein einheitliches Vorgehen waren bis zum April 2011 die 1974 eingeführten Richtlinien zur Feststellung von Rotz (Malleus) bei Einhufern durch serologische und allergologische Untersuchungsverfahren, nach denen die Infektion mittels blutserologischer Untersuchungen (KBR, LA) und zusätzlich der Mallein-Probe festgestellt wurde. Da mit diesen Methoden falsch-positive Ergebnisse möglich sind, wurde im April 2011 die amtliche Methodensammlung des Friedrich-Loeffler-Instituts (Arbeitsanleitung zur Labordiagnostik anzeigepflichtiger Tierseuchen) angepasst. Besteht ein Rotzverdacht, müssen in zwei- bis dreiwöchigem Abstand Blutproben entnommen und mittels KBR untersucht werden. Positive Ergebnisse sind unverzüglich durch einen Western Blot zu verifizieren. Anschließend werden ein kultureller Nachweis und eine PCR für den molekularbiologischen Nachweis des Erregers durchgeführt.[85]
Ansteckungsverdächtige Tiere sind unter Aufrechterhaltung der Bestandssperre einer sechsmonatigen seuchenprophylaktischen Beobachtung zu unterziehen. In diesem Zeitraum werden in zwei- bis dreiwöchigem Abstand Blutproben entnommen und mittels KBR untersucht. Werden bei diesen Nachuntersuchungen keine weiteren verdächtigen Tiere gefunden, sind zwei Wochen nach der letzten unauffälligen Testung abschließend zwei weitere Blutproben im Abstand von zwei Wochen zu entnehmen. Parallel erfolgte die vorschriftsmäßige Zwischendesinfektion unter Einbeziehung der Stallungen und aller potentiell kontaminierten Gegenstände. Dung-, Einstreu- oder Futterreste sind zu verbrennen. Alternativ können sie desinfiziert, gestapelt und nach drei Wochen untergepflügt werden. Nach Erlöschen der Seuche und Durchführung der Abschlussdesinfektion wird die Bestandssperre aufgehoben.
Maßnahmen zum Schutz freier Territorien
[Bearbeiten | Quelltext bearbeiten]Für den internationalen Tierverkehr mit Drittländern haben die jeweiligen Einfuhrbestimmungen des Bestimmungslandes Gültigkeit. Für die Einfuhr von Equiden nach Deutschland ist die Binnenmarkt-Tierseuchenschutz-Verordnung relevant. In ihr sind die Richtlinien 90/426/EWG und 90/425/EWG umgesetzt, die die Einfuhr aus Drittländern und das innergemeinschaftliche Verbringen von Tieren und Waren nach gemeinschaftlich festgelegten Anforderungen regeln. In der Entscheidung der Kommission 93/197/EWG werden die tierseuchenrechtlichen Bedingungen und der Beurkundungsmodus für die Einfuhr von registrierten Equiden sowie Zucht- und Nutzequiden festgelegt. Danach ist bei der Einfuhr aus bestimmten, namentlich genannten Drittländern eine Überprüfung auf Freisein von Rotz-Antikörpern mittels Komplementbindungsreaktion vorgeschrieben. Diese hat während einer 30-tägigen Quarantäne unter tierärztlicher Aufsicht im Herkunftsland zu erfolgen. Im Herkunftsbestand der Tiere sowie im Umkreis von 30 km darf in den letzten zwölf Monaten kein Rotz aufgetreten sein. Für den Transport bestimmtes Futter und Einstreu muss frei von Krankheitserregern sein. Tiere, die zum endgültigen Verbleib bestimmt sind, werden im Bestimmungsland einer weiteren vierwöchigen Quarantäne unterzogen.
Problematisch erweist sich dabei seit jeher die Tatsache, dass keine einzelne allergologische und serologische Untersuchung eine hundertprozentige Sicherheit bieten kann. Wiederholt kommt es in der KBR bei hohem Probenaufkommen zu falsch positiven Ergebnissen, die weiterer diagnostischer Abklärung bedürfen. Eine besondere Gefährdung für seuchenfreie Gebiete geht jedoch von latent infizierten Tieren aus, die aufgrund mangelnder oder zeitlich verzögerter Antikörper-Bildung in der KBR falsch negative Ergebnisse liefern. Dies war zuletzt 2005 bei einem aus Brasilien importierten Sportpferd der Fall, bei dem es durch den Stress von Transport, Klimawechsel und Futterumstellung zum Ausbruch der Erkrankung kam.[1]
Fleischhygiene
[Bearbeiten | Quelltext bearbeiten]Die Schlachterlaubnis ist für rotzkranke oder seuchenverdächtige Tiere zu versagen. Ebenfalls verboten ist das Abhäuten von Kadavern. Im Rahmen der Fleischbeschau ist bei Einhufern eine systematische Untersuchung von Schädel und Atemtrakt auf Rotzveränderungen durchzuführen. Bei positivem Befund gilt der Tierkörper als untauglich für den menschlichen Verzehr und darf auch nicht als Tierfutter verwertet werden.
Geschichte des Rotzes
[Bearbeiten | Quelltext bearbeiten]Antike und Mittelalter
[Bearbeiten | Quelltext bearbeiten]
Bereits Aristoteles erwähnt in seiner Historia animalium (Band VIII, Kap. 25) eine beim Esel auftretende, tödlich endende Krankheit. Beschriebene Symptomatik und Verlauf verweisen deutlich auf die für diese Spezies typische akute Form der Rotzerkrankung. Auch im Corpus Hippiatricorum Graecorum, einer frühmittelalterlichen Kompilation basierend auf hippiatrischen Werken des 3.–5. Jahrhunderts, findet die Rotzkrankheit Erwähnung.
Antike Schriften ermöglichen nicht immer die eindeutige Zuordnung beschriebener Krankheitsbilder zum Rotz. So werden im Buch III der Mulomedicina Chironis (spätes 4. Jahrhundert) unter dem Begriff morbus malleus mehrere Symptome vorgestellt, für die außer verschiedenen Erscheinungsformen des Rotzes in Antike und Mittelalter auch weitere, zum Teil chronisch unheilbar verlaufende Pferdeseuchen[86] in Frage kommen. Bemerkenswert ist an dieser Stelle das Wissen um die mögliche Übertragbarkeit des Rotzes durch „verdorbene Atemluft“. Im 5. Jahrhundert n. Chr. greift der römische Militärhistoriker Vegetius Renatus für seine Ars veterinarius sive Mulomedicina Teile der Mulomedicina Chironis wieder auf und bezeichnet die Rotzerkrankung fortan als Malleus.
Im Mittelalter gehörte der Rotz nach germanischem Recht zu den Gewährsmängeln und war unter den Bezeichnungen Hauptmönigkeit, Hauptmörigkeit, Hauptsichtig, Haubetisch, Mordisch und Profluvium atticum bekannt.[87]
17. und 18. Jahrhundert
[Bearbeiten | Quelltext bearbeiten]
Erst im 17. Jahrhundert finden sich wieder spärliche schriftliche Hinweise auf die Rotzerkrankung. Vom Renaissance-Autor Filippo Scacco wird 1603 in seiner Trattata di Mescalzia der Hautrotz beschrieben. Der Stallmeister Jacques Labessie de Solleysel erwähnt die Krankheit in seinem Werk Le Parfait Mareschal 1664 und macht darin bereits auf die Ansteckungsgefahr aufmerksam: „es (das Gift) infiziert die Luft und ergreift alle Pferde, die unter einem Dache sind“.[88] Darauf, dass die Pferdekrankheit mit ihren Erscheinungsformen „Rotz“ und „Wurm“ bekannt und durchaus häufig war, weist ihre Zuordnung zu den Gewährsmängeln im Tierkaufrecht hin.[89] Ab ca. 1780 existierten auch bereits erste Verbote für die Schlachtung rotzkranker Pferde zum menschlichen Verzehr.[90]
Aufgrund ihrer zunehmenden wirtschaftlichen und militärischen Bedeutung rückte die Rotzerkrankung im 18. Jahrhundert in den Blickpunkt wissenschaftlichen Interesses. Zur Erforschung und Bekämpfung von Rotz und Rinderpest wurde 1762 in Lyon die erste veterinärmedizinische Bildungsstätte Europas gegründet (vgl. Claude Bourgelat). 1771 wurden auf deutschsprachigem Gebiet die ersten obrigkeitsstaatlichen Maßnahmen zur Eindämmung der Rotzkrankheit erlassen.[91]
Erik Nissen Viborg erkannte 1795, dass „Rotz“ und „Wurm“ nur zwei Ausprägungsformen der gleichen Erkrankung darstellen, und konnte 1797 ihren ansteckenden Charakter durch Verimpfen (Inokulation) infektiösen Materials sowie durch Zusammenstellen gesunder mit kranken Pferden erstmals beweisen. Missglückte Infektionsversuche durch die Tierarzneischule von Alfort (École nationale vétérinaire d’Alfort) führten um die Jahrhundertwende jedoch dazu, dass die Übertragbarkeit durch Ansteckung von namhaften zeitgenössischen Professoren und Ärzten erneut angezweifelt wurde. Die daraus resultierende Lockerung bereits eingeführter Quarantäne- und Bekämpfungsmaßnahmen hatte vielerorts, besonders jedoch in Frankreich, eine rasche und starke Ausbreitung der Seuche zur Folge.
19. Jahrhundert
[Bearbeiten | Quelltext bearbeiten]
Schwierigkeiten beim Erkennen epidemiologischer Zusammenhänge bereitete die Rotzkrankheit aufgrund ihres höchst variablen Krankheitsbildes und durch die Existenz stiller, latenter Infektionsverläufe. Oft wurde sie mit anderen Infektionen verwechselt,[92] besondere Probleme bereitete dabei die Abgrenzung zur Druse.[93] Während die so genannten Kontagionisten an ein übertragbares Agens (Rotzcontagium) glaubten, verfochten die Antikontagionisten die Theorie einer spontanen Entstehung (Spontangenese).[94] Als auslösende Faktoren machte man unter anderem schlechte Haltungsbedingungen verantwortlich. Darüber hinaus hielt sich bis zu Beginn des 20. Jahrhunderts die irrige Meinung, Rotz könne aus anderen Pferdekrankheiten neu entstehen.[95]
Frühe Bekämpfungsmaßnahmen im 19. Jahrhundert beruhten auf einer Meldepflicht der Rotzerkrankung, Aufklärung der Öffentlichkeit bei Seuchenausbruch, Tötungsanordnung und Entschädigung der durch tierärztliche Untersuchung als rotzkrank erklärten Tiere, Quarantäne und eventuelle Tötung von Kontaktpferden sowie gründlicher Reinigung kontaminierter Ställe.[96]
1821 wurde der erste klare Fall von Rotzerkrankung beim Menschen veröffentlicht, das Syndrom war jedoch schon seit längerem aus dem Kreis jener Forscher bekannt, die intensiven Kontakt zu rotzkranken Pferden hatten. 1837 und 1838 wurde von Rayer und Leblanc erneut die Übertragbarkeit akuter Rotz-Infektionen auf den menschlichen Organismus bewiesen und eine Übereinstimmung pathologischer Veränderungen bei Mensch und Tier aufgezeigt.[97] Erst 1849 gelang den Professoren Francois Saint-Cyr und Eloy Barthelemy aus der Schule von Lyon der Nachweis für die Übertragbarkeit des chronischen Rotzes.
Otto Bollinger (1868) und Andreas Christian Gerlach (1874) wiesen unabhängig voneinander die ausschließliche Übertragbarkeit der Erkrankung durch Kontakt mit kranken Tieren oder deren Ausscheidungen nach. 1881 wurde der Rotzerreger durch Victor Babeș erstmals in Organmaterial mikroskopisch nachgewiesen, und 1882 erfolgte die erfolgreiche kulturelle Anzucht durch Charles-Joseph Bouchard, Friedrich Loeffler und Wilhelm Schütz. 1886 konnte der Infektionsverlauf zufriedenstellend geklärt werden (Erfüllung der Koch-Henleschen Postulate).
Entwickelte Impfstoffe und Therapeutika zeigten keinen Erfolg im Kampf gegen den Rotzerreger. Nachdem die alleinige Tilgung rotzkranker Tiere nicht zum Rückgang der Seuche geführt hatte, erkannte man erstmals die Bedeutung klinisch unauffälliger Trägertiere. Die Bestätigung eines klinischen Rotzverdachts war zu diesem Zeitpunkt nur durch die unsichere experimentelle Infektion von Versuchstieren möglich.[94]

Die Entdeckung des Malleins 1890 durch Christophor Ivanovitsch Hellman (Russland), Otto Ivanovitsch Kalning (Estland) und Leonard Pearson (USA) ermöglichte erstmals auch eine Identifizierung latent infizierter Träger und stellte einen ersten wichtigen Schritt auf dem Weg zur Tilgung des Erregers dar. Die 1896 vom Bakteriologen John MacFadyean beobachtete Agglutinationsreaktion von Rotzerregern mit dem Serum rotzkranker Pferde bildete den Grundstock für die erste serologische Methode in der Rotzdiagnostik, die Serumlangsamagglutination (SLA).
Da Pferde noch immer das wichtigste Transportmittel darstellten, erfuhr die Seuche im 19. Jahrhundert durch Kriege, Siedlerströme und den insbesondere auf dem Seeweg zunehmenden internationalen Tierverkehr eine Verbreitung neuen Ausmaßes. Ökonomisch bedeutsame Pferdeverluste sowie ein steigendes Bewusstsein für die Gefährdung des Menschen führten gegen Ende des Jahrhunderts dazu, dass in vielen Ländern einheitliche staatliche Bekämpfungsprogramme etabliert wurden.[98] So wurde die Rotzbekämpfung 1897 ins kanadische Animal Contagious Diseases Act aufgenommen, 1899 trat in Indien der Glanders and Farcy Act in Kraft.
20. Jahrhundert
[Bearbeiten | Quelltext bearbeiten]Nach der Entwicklung des Mallein-Tests als diagnostischer Methode wurde in vielen Ländern die Tötung und Entschädigung positiver Tiere Pflicht. Trotzdem scheiterte der Erfolg zunächst daran, dass an einigen Orten Kontakttiere dem Testen entzogen wurden oder, ebenso wie positive unauffällige Pferde, schnell an unbeteiligte Dritte weiterverkauft wurden, um finanzielle Einbußen zu vermeiden. Besonders an der kanadischen Grenze zu den USA waren vollständige Einfuhrtests durch unkontrollierte Siedlerströme nicht immer möglich und eine konsequente Nachverfolgung von Kontakttieren nahezu ausgeschlossen.[99] Erst nachdem eine adäquate Entschädigung auch auf die Tötung von Kontakttieren ausgedehnt, die Existenz eines klinisch unauffälligen Trägerstatus allgemein akzeptiert und die Hintertreibung der Tötungsanordnung strafbar wurde, machte die Tilgung des Rotzes weltweit schnelle Fortschritte.[98] Bekämpfungsmaßnahmen waren jedoch langwierig und kostspielig, so wurden beispielsweise in Kanada von 1904 bis 1938 mehr als eine Million Dollar Entschädigung für über 13.000 getötete Tiere bezahlt.[100] In den Jahren 1876–1886 betrugen die Tierverluste durch Rotz allein für Preußen 20.500 Stück, die mit 4,5 Millionen Mark entschädigt wurden.[101] Zu den ersten europäischen Ländern, denen die erfolgreiche Eradikation von B. mallei gelang, gehörten Nordirland (1919), Irland (1920) sowie Dänemark und Großbritannien (1928).
In Deutschland hatte die einheitliche staatliche Rotzbekämpfung durch die Veterinärpolizei bereits mit dem Reichsviehseuchengesetz von 1880 begonnen, das durch nachfolgende Gesetze 1894 und 1909 weiter verbessert wurde. Nach der Einfuhr der verpflichtenden Fleischbeschau 1903 konnten bei der Schlachtung Dutzende von Rotzfällen beim Pferd aufgedeckt und damit weitere Seuchenherde eliminiert werden.[102] In den Jahren 1886–1902 wurden insgesamt für Deutschland 13.000 Tiere amtlich als rotzkrank gemeldet. Besonders stark verseucht waren Westpreußen, Posen und Schlesien (besonders russische Grenzgebiete durch Viehschmuggel) sowie einzelne Regionen in Lothringen, Oberbayern und Württemberg.[26]
Mit Einführung der Komplementbindungsreaktion wurde die Rotzdiagnostik dahingehend verfeinert, dass mit einer Seroprävalenz von 0,3 % der Rotz bei deutschen Armeepferden zu Beginn des Ersten Weltkrieges kaum mehr eine Rolle spielte. Die erneute Ausbreitung der Seuche in der Phase des Bewegungskrieges war überwiegend auf den Kontakt mit rotzkranken russischen Beute-Pferden bzw. kontaminierten Stallungen, jedoch auch auf mangelnde Kontrollmöglichkeiten von Ersatzpferden (Remonten) zurückzuführen. Im nachfolgenden Stellungskrieg gelang es durch die von Robert von Ostertag angeregte Einrichtung von Blutuntersuchungsstellen, die Rotzerkrankung bei Armeepferden und auch in der Pferdepopulation des zivilen Hinterlandes zurückzudrängen. Von August 1914 bis zum Ende des Krieges 1918 wurden mehr als 15,5 Millionen Blutproben serologisch untersucht[32] und im deutschen Feldheer insgesamt ca. 31.000 Pferde wegen Rotzes getötet. Trotz des Krieges war die Bedeutung des Rotzes in Deutschland weiter zurückgegangen, so dass 1929 mit der Existenz eines einzigen letzten Seuchengehöftes die endgültige Tilgung in greifbarer Nähe war. In der Seuchenvorschrift der Reichswehr von 1930 blieb Rotz jedoch weiterhin meldepflichtig. Nach einer letzten Seuchenspitze im Zweiten Weltkrieg, bei der die Krankheit jedoch nicht mehr ihre frühere Bedeutung erreichte, gilt sie in Deutschland seit Mitte der 1950er Jahre als getilgt.[44]

Im Russischen Kaiserreich hatte die Rotzkrankheit, bedingt durch die politischen und landwirtschaftlichen Verhältnisse und den Mangel an Tierärzten, stark an Boden gewonnen. Erst 1903 wurde ein Tierseuchengesetz eingeführt, das jedoch keine breite Anwendung fand und die Bekämpfung des Rotzes auf das Merzen klinisch kranker Tiere beschränkte.[103] 1908–1912 wurden auf russischem Gebiet ca. 117.000 Tiere mit klinischen Erscheinungen getötet. Besonders stark verseucht waren die Ukraine, die Krim, das Wolgagebiet und der Kaukasus.[104] Der Erste Weltkrieg und der sich anschließende Bürgerkrieg trieben die Ausbreitung des Rotzes weiter voran, sodass der russische Pferdebestand in den 1920er Jahren ernsthaft gefährdet war. Der Anteil an Mallein-Reagenten betrug in den Jahren 1925 bis 1929 je nach Gebiet zwischen 0,6 und 38,9 %, die akut rotzigen Tiere machten davon in der Regel etwa 1/10 aus.[105] 1925 wurde ein Gesetz zur Rotzbekämpfung verabschiedet, das der starken Verbreitung der Seuche im Land Rechnung trug und wirtschaftlich tragbar war. Zur erfolgreichen Umsetzung des einfachen und robusten Konzepts kam es jedoch erst 1929 nach der Zwangsenteignung und Konzentration der Tierbestände in Sowchosen, Kolchosen und Transportgesellschaften.[106] Das Sanierungsprogramm stützte sich auf die Einführung einer Tierkennzeichnung sowie planmäßig angelegte klinische, allergologische und serologische Kontrollen. Kranke oder verdächtige Tiere mit unklaren Testergebnissen wurden gemerzt. Tiere, die nur auf das Mallein reagierten und ohne klinische Symptome waren, besaßen einen unklaren Ausscheider-Status. Sie wurden daher in speziell ausgewählten, abgelegenen Gehöften zur weiteren Nutzung unter Quarantäne aufgestallt. In regelmäßigen Intervallen wurden diese Malleinwirtschaften klinisch, allergologisch und serologisch nachkontrolliert, so dass Tiere mit aktiver Infektion nach und nach gemerzt werden konnten. Dieses Konzept führte zur Sanierung ganzer Landstriche. Mitte der 1950er Jahre galten auch alle Pferde der sowjetischen Armee als rotzfrei.[107]
Der Zweite Weltkrieg verzögerte die erfolgreiche Tilgung des Rotzes in vielen Ländern, bis 1965 gelang es jedoch, die Erkrankung in den meisten Nationen weltweit zurückzudrängen. Nach drei größeren Ausbrüchen unter Armeetieren in den 1970er Jahren galt 1988 auch in Indien der Rotz als getilgt.[108]
Rotz als biologische Waffe
[Bearbeiten | Quelltext bearbeiten]Da der Erreger als leicht zu verteilen gilt und die Rotz-Erkrankung hohe Morbiditätsraten sowie mittlere Mortalitätsraten aufweist, wurde B. mallei als biologischer Kampfstoff der Kategorie B eingeordnet und der Umgang mit dem Erreger auf Sicherheitslabore der Stufe 3 beschränkt.[109]
Verschiedene Umstände prädestinieren den Rotzerreger zum idealen biologischen Werkzeug (Agens). Die Krankheit ist im Westen durch die erfolgreiche Ausrottung unbekannt geworden, das Krankheitsbild der Zoonose ist variabel, erste Symptome sind unspezifisch. Aus diesem Grund könnten sich nach erfolgter Exposition Diagnosestellung und Therapiebeginn sogar in Gebieten mit fortschrittlicher medizinischer Versorgung verzögern, was zum Anstieg von Morbidität und Letalität sowie Mortalität führt. Obwohl Rotz heilbar ist, liegen wenige Therapieerfahrungen beim Menschen vor. Darüber hinaus existiert die Gefahr gentechnisch veränderter Stämme mit erhöhter Virulenz und atypischer Antibiotikaresistenz.
Da der Erreger noch in freier Wildbahn vorkommt, ist er relativ leicht verfügbar. Wie Erkrankungen bei Laborpersonal in der Vergangenheit bewiesen haben, ist die Infektion durch Einatmen des Erregers sehr wahrscheinlich. Die Bakterien können leicht in Aerosolform gebracht werden. Die Empfänglichkeit von Pferden und anderen Tieren führt im Einsatzfall zur weiteren Ausbreitung des Erregers durch Aufrechterhaltung von heterologen Infektketten.
Eine wirksame Prävention durch aktive oder passive Impfung ist bisher nicht möglich.
Einsatz von Rotz gegen Tiere
[Bearbeiten | Quelltext bearbeiten]
Rotz wurde als eine der ersten biologischen Waffen bereits im 20. Jahrhundert eingesetzt. Im Ersten Weltkrieg besaßen Pferde durch ihren Einsatz in Kavallerie- und Artillerieeinheiten sowie beim Materialtransport noch hohe militärische Bedeutung. Das Deutsche Reich führte sowohl an der West- als auch an der Ostfront eine Reihe von Sabotageakten gegen die USA, Russland, Rumänien und Frankreich durch. Darüber hinaus unternahmen deutsche Agenten wie Anton Dilger den Versuch, in den USA Pferde, Maultiere und Vieh, das zur Versorgung der alliierten Truppen gedacht war, vor der Verschiffung nach Europa mit Rotzkulturen zu verseuchen. Gegen kriegsneutrale Nationen wie Spanien und Argentinien ging man ähnlich vor, um die Lieferung von Equiden an die feindlichen Truppen zu verhindern.[110] Darüber hinaus infizierte man in Mesopotamien 4500 Maultiere mit Rotz.[111] Auch französische Kavalleriepferde waren Ziel einer absichtlichen Rotzansteckung. Durch die Infektion zahlreicher Pferde und Maultiere an der Ostfront gelang es Deutschland und seinen Verbündeten, beim Gegner erfolgreich Truppenbewegungen der Artillerie sowie das Vorankommen der Verpflegungskonvois zu behindern.[111]
Einsatz von Rotz gegen Menschen
[Bearbeiten | Quelltext bearbeiten]Der gezielte Einsatz von Rotzerregern gegen Menschen war im Ersten Weltkrieg verpönt.[110] Im Zusammenhang mit dem Ansteigen der Fallzahlen bei Tieren konnte während und nach dem Krieg in den kontaminierten Gebieten jedoch ein erhöhtes Auftreten der Rotzkrankheit beim Menschen beobachtet werden. Durch Japan wurden zwischen 1932 und 1945 biologische Kampfstoffe auf der Basis von B. mallei entwickelt und damit Tiere, Zivilpersonen sowie Kriegsgefangene im Ping Fan Institut (Einheit 731) in der besetzten Mandschurei infiziert. Es kam jedoch nie zum offenen Einsatz auf einem Schlachtfeld. Die frühere Sowjetunion wurde beschuldigt, in Afghanistan 1982–1984 Rotz als biologische Waffe gegen oppositionelle Truppen eingesetzt zu haben.[111]
Aktuelle Entwicklungen
[Bearbeiten | Quelltext bearbeiten]Als Reaktion auf die vermutete Bedrohung durch von Japan und Deutschland entwickelte Biowaffen begann in den USA 1942 in Fort Detrick die Arbeit mit biologischen Kampfstoffen. Am Rotzerreger wurde bezüglich seiner Einsatzmöglichkeiten geforscht, er wurde jedoch nicht zur Waffe entwickelt. 1971 unterzeichneten die USA die Biowaffenkonvention, und alle Arbeiten an der offensiven Waffenforschung wurden eingestellt. Forschung zum Zwecke der Verteidigung wird weltweit jedoch noch immer durchgeführt. Sie hat die Entwicklung wirksamer Impfstoffe sowie die Erforschung von Virulenzfaktoren und Resistenzmechanismen zum Ziel. Versuche des Erwerbs oder Einsatzes von Rotzerregern durch terroristische Vereinigungen sind bisher nicht bekannt.[98]
Literatur
[Bearbeiten | Quelltext bearbeiten]Die angegebene Literatur diente auch als Quelle für den Artikel.
- Michael Rolle, Anton Mayr (Hrsg.): Medizinische Mikrobiologie, Infektions- und Seuchenlehre. 8. Auflage. Enke, Stuttgart 2007, ISBN 978-3-8304-1060-7.
- Thomas Blaha (Hrsg.): Angewandte Epizootiologie und Tierseuchenbekämpfung. VEB Gustav Fischer, Jena 1988, ISBN 3-334-00204-7.
- Olof Dietz (Hrsg.), Bernhard Huskamp (Hrsg.): Handbuch Pferdepraxis. 2. Auflage. Enke, Stuttgart 1999, ISBN 3-432-29262-7.
- World Organisation for Animal Health: Glanders. (PDF; 115 kB) In: Manual of Diagnostic Tests and Vaccines for Terrestrial Animals.
- Bridget Carr Gregory, David M. Waag: Glanders (PDF), in: Medical Aspects of Biological Warfare, Borden Institute
- Center for Food Security & Public Health, Iowa State University: Glanders (PDF; 526 kB)
- Angela von den Driesch, Joris Peters: Geschichte der Tiermedizin. 5000 Jahre Tierheilkunde. 2. Auflage. Schattauer, Stuttgart 2003, ISBN 3-7945-2169-2.
- Franz Friedberger, Eugen Fröhner: Der Rotz. In: Lehrbuch der speciellen Pathologie und Therapie der Haustiere. Bd. II. Ferdinand Enke, Stuttgart 1904, S. 437–469.
- E. Lührs: Rotz. In: Valentin Strang, David Wirth: Tierheilkunde und Tierzucht: Eine Enzyklopädie der praktischen Nutztierkunde. Band VIII. Urban und Schwarzenberg, 1930, S. 641–662.
- Rotz-Wurmkrankheit der Pferde. In: O. Röder (Hrsg.): Haubner’s Landwirtschaftliche Tierheilkunde. 14. Auflage. Paul Parey, Berlin 1907, S. 417–426.
- Hermann Mießner: Maleus. In: Kriegstierseuchen und ihre Bekämpfung. 5. Auflage. M. & H. Schaper, Hannover 1941, S. 9–44.
- Robert-Rafael Koch: Die Bekämpfung des Rotzes der Einhufer unter den Verhältnissen West- und Osteuropas. Diss. (med. vet.), Gießen 1954.
- Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 9–223, hier: S. 219 f.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Glanders and Melioidosis Fact Sheet am Center for Biosecurity des University of Pittsburgh Medical Centers (UPMC)
- Übersicht über den Rotz (PDF) im Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2008 der Weltorganisation für Tiergesundheit (PDF; 80 kB)
- Präsentation zum Rotz an der Veterinärmedizinischen Fakultät der Universität München (PDF; 1870 kB)
- Burkholderia mallei Resource Page
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Heinrich Neubauer: Zoonosen in Deutschland. Ein Überblick über vorkommende und mögliche Erreger. In: Deutsches Tierärzteblatt. (Dt. TÄbl.) 56, 2008, S. 1342–1346.
- ↑ M. S. Redfearn, N. J. Palleroni, R. Y. Stanier: A comparative study of Pseudomonas pseudomallei and Bacillus mallei. In: Journal of general microbiology. Band 43, Nummer 2, Mai 1966, S. 293–313, ISSN 0022-1287. PMID 5962362.
- ↑ Wolfgang Pfeifer (Hrsg.): Etymologisches Wörterbuch des Deutschen. 2. Auflage. Akademie, Berlin 1993, S. 1140; Kluge: Etymologisches Wörterbuch der deutschen Sprache. Bearb. von Elmar Seebold. 24. Auflage. De Gruyter, Berlin / New York 2002, S. 772.
- ↑ Gundolf Keil: Randnotizen zum „Stockholmer Arzneibuch“. In: Studia neophilologica. Band 44, Nr. 2, 1972, S. 238–262, hier: S. 254 f.
- ↑ Vgl. beispielsweise auch: A. Müller, R. W. Schlecht, Alexander Früh, H. Still Der Weg zur Gesundheit: Ein getreuer und unentbehrlicher Ratgeber für Gesunde und Kranke. 2 Bände, (1901; 3. Auflage 1906, 9. Auflage 1921) 31. bis 44. Auflage. C. A. Weller, Berlin 1929 bis 1931, Band 1 (1931), S. 188 f.: Der Rotz (Wurm; Malleus).
- ↑ Vgl. von den Driesch/Peters, S. 49.
- ↑ Vgl. von den Driesch/Peters, S. 30.
- ↑ Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 218 f.
- ↑ Tierseuchenbericht 2011 des BMELV. In: Deutsches Tierärzteblatt. (DTBL) 60. Jahrgang, Mai 2012, S. 714–715.
- ↑ FLI weist bei importiertem Pferd Rotz-Infektion nach
- ↑ Tiermedizin: Der Rotz ist zurück. In: Forschung Aktuell. Deutschlandfunk, 29. Januar 2015, abgerufen am 30. Januar 2015.
- ↑ In Hautproben eines getöteten Pferdes wurde „Rotz“-spezifische DNA nachgewiesen. Niedersächsisches Ministerium für Landwirtschaft, 28. Januar 2015, abgerufen am 22. Februar 2015.
- ↑ Infektionskrankheit Rotz bei Pferd in Niedersachsen festgestellt – Weitere Untersuchungen in Schleswig-Holstein angelaufen. Pressemitteilung. Ministerium für Energiewende, Landwirtschaft, Umwelt und ländliche Räume in Schleswig-Holstein, 30. Januar 2015, abgerufen am 30. Juni 2015.
- ↑ Weiterhin keine Verdachtsfälle von Rotz bei Pferden in Schleswig-Holstein. Pressemitteilung. Ministerium für Energiewende, Landwirtschaft, Umwelt und ländliche Räume in Schleswig-Holstein, 4. Februar 2015, abgerufen am 30. Juni 2015.
- ↑ Vgl. Gregory & Waag, S. 124.
- ↑ Vgl. http://www.indianexpress.com/news/22-horses-detected-with-glanders-in-nainital/31759/
- ↑ Vgl. http://www.flutrackers.com/forum/showthread.php?t=28997
- ↑ M. Elschner, E. Liebler-Tenorio, P. Wohlsein, E. Lange, V. Kaden: Rotz – Ein im Jahr 2006 nach Deutschland importierter Rotz-Fall zeigt, dass diese Erkrankung eine allgegenwärtige Gefahr ist ( vom 17. Dezember 2010 im Internet Archive) (PDF; 7,1 MB) In: Friedrich-Loeffler-Institut. Jahresbericht 2006. S. 66–71.
- ↑ a b Vgl. World Organisation for Animal Health: Glanders ( vom 19. März 2013 im Internet Archive) (PDF; 115 kB).
- ↑ Vgl. Gregory & Waag, S. 127.
- ↑ a b Vgl. Friedberger & Fröhner, S. 440.
- ↑ a b Vgl. Gregory & Waag, S. 125.
- ↑ E. Yabuuchi, Y. Kosako, H. Oyaizu, I. Yano, H. Hotta, Y. Hashimoto, T. Ezaki, M. Arakawa: Proposal of Burkholderia gen. nov. and transfer of seven species of the genus Pseudomonas homology group II to the new genus, with the type species Burkholderia cepacia (Palleroni and Holmes 1981) comb. nov. In: Microbiology and immunology. Band 36, Nummer 12, 1992, S. 1251–1275, ISSN 0385-5600. PMID 1283774.
- ↑ Vgl. Lührs, S. 646.
- ↑ Geschichte der Elefantenhaltung im Kölner Zoo
- ↑ a b c Vgl. Friedberger & Fröhner, S. 441.
- ↑ Vgl. Lührs, S. 647.
- ↑ a b Vgl. Mießner, S. 10.
- ↑ a b Vgl. Mießner, S. 13.
- ↑ a b Haubner, S. 418.
- ↑ Hertwig: Übertragung thierischer Ansteckungsstoffe auf Menschen. In: Jahrbuch der in- und ausländischen gesammten Medizin. Band 8, Nr. 1, 1835, S. 15.
- ↑ a b Vgl. Lührs, S. 657.
- ↑ Vgl. Lührs, S. 648 f.
- ↑ Vgl. Jacob Reiff: Rotz bei Löwen und Tigern. Diss. (vet. med.) Gießen 1919, S. 5 (Einleitung).
- ↑ a b c d Vgl. Lührs, S. 655.
- ↑ Vgl. Basil Clarke: The Story of the British War-Horse from Prairie to Battlefield In: The Great War – The Standard History of the All Europe Conflict. Band 9, Amalgamated Press, London 1917.
- ↑ Vgl. Fallbericht eines vernachlässigten Bengalischen Kavallerie-Regiments 1883. (Army (India) – Veterinary Department – Glanders in Cavalry Regiments. HC Deb 05 March 1883 vol 276 cc1408-9)
- ↑ Vgl. Army Medical Services Museum: History of the Royal Army Veterinary Corp ( vom 21. August 2008 im Internet Archive).
- ↑ a b Vgl. The Confederate Cavalry and the "Great Glanders Epizootic" ( vom 7. Oktober 2014 im Internet Archive).
- ↑ Vgl. Paul Lukoschus: Die Bewegung der anzeigepflichtigen Equidenseuchen (Rotz, Räude, Beschälseuche) im Deutschen Reich seit 1910 bis heute und die Ursachen für diese Bewegung. Diss. (med. vet.) Gießen 1964, S. 23.
- ↑ Vgl. Koch, S. 20.
- ↑ Vgl. J. B. Derbyshire: The eradication of glanders in Canada. In: The Canadian veterinary journal. La revue vétérinaire canadienne. Band 43, Nummer 9, September 2002, S. 722–726, ISSN 0008-5286. PMID 12240535. PMC 339565 (freier Volltext).
- ↑ Vgl. Kosuch, S. 25–27.
- ↑ a b Vgl. Lukoschus, S. 25 f.
- ↑ a b c Center for Food Security & Public Health, Iowa State University: Glanders. (PDF; 526 kB). Abgerufen am 2. März 2013.
- ↑ Robert von Ostertag: Der heutige Stand der Zoonosefrage. In: Virchows Archiv. Band 275, Nr. 1, 1930, S. 596.
- ↑ Vgl. Lührs, S. 642.
- ↑ Vgl. Gregory & Waag, S. 128.
- ↑ Vgl. Mießner, S. 14.
- ↑ W. C. Nierman et al.: Structural flexibility in the Burkholderia mallei genome. In: Proceedings of the National Academy of Sciences. Band 101, Nummer 39, September 2004, S. 14246–14251, ISSN 0027-8424. doi:10.1073/pnas.0403306101. PMID 15377793. PMC 521142 (freier Volltext).
- ↑ Vgl. W. Drommer: Rotz (Malleus). In: Leo-Clemens Schulz (Hrsg.): Pathologie der Haustiere. Band II: Krankheiten und Syndrome. Gustav Fischer, Jena, 1991, S. 19.
- ↑ Vgl. Ernst Joest (Hrsg.): Spezielle pathologische Anatomie der Haustiere. Dritter Band. Richard Schoetz, Berlin 1924, S. 788–791.
- ↑ Vgl. Dietz, S. 659.
- ↑ Vgl. Joest, S. 577.
- ↑ Vgl. Drommer, S. 19.
- ↑ Vgl. Lührs, S. 656.
- ↑ A. Goodyear, L. Kellihan, H. Bielefeldt-Ohmann, R. Troyer, K. Propst, S. Dow: Protection from pneumonic infection with burkholderia species by inhalational immunotherapy. In: Infection and immunity. Band 77, Nummer 4, April 2009, S. 1579–1588, ISSN 1098-5522. doi:10.1128/IAI.01384-08. PMID 19179415. PMC 2663177 (freier Volltext).
- ↑ Vgl. Lührs, S. 654.
- ↑ a b Vgl. Haubner, S. 420.
- ↑ Vgl. Mießner, S. 12.
- ↑ Vgl. Friedberger & Fröhner, S. 449 f.
- ↑ Vgl. Haubner, S. 419.
- ↑ Vgl. Haubner, S. 423.
- ↑ a b Vgl. Friedberger & Fröhner, S. 451.
- ↑ Vgl. Haubner, S. 49.
- ↑ Vgl. Center for Food Security & Public Health, Iowa State University: Glanders (PDF; 526 kB)
- ↑ Vgl. Friedberger & Fröhner, S. 452.
- ↑ Vgl. Dr. Krüger-Hanssen: Über Rotzkontagium. Jahrbücher der in- und ausländischen gesammten Medizin, Band XIV, Nr. 2 (1837), S. 182 f.
- ↑ Vgl. Joest, S. 791 f.
- ↑ Vgl. Joest, S. 571.
- ↑ Vgl. Joest, S. 573.
- ↑ Vgl. Friedberger & Fröhner, S. 448.
- ↑ Vgl. Friedberger & Fröhner, S. 454.
- ↑ Vgl. Ferdinand Pieter Keyser: Die Diagnose des Rotzes am Kadaver. Diss. (vet. med.) Bern 1910.
- ↑ Vgl. Mießner, S. 27.
- ↑ Mandy Elschner, Peggy Marten, Holger Scholz: Etablierung eines Immunoblot-Verfahrens als Bestätigungstest für die Komplementbindungsreaktion in der serologischen Rotz-Diagnostik. In: Kurzfassungen der Vorträge und Poster zur 26. AVID-Tagung – Bakteriologie – Bad Staffelstein / Kloster Banz, 24.–26. Oktober 2007. Hrsg. v. der Deutschen Veterinärmedizinischen Gesellschaft e. V. [o. O.] [o. J.]
- ↑ Vgl. Christian Hallwachs: Abhandlung über die sichere Anwendung des Kalkes, als Vorbeugungsmittels wider die Krankheiten des Lymphsystems, besonders wider den Rotz und den Hautwurm bei dem Pferdegeschlechte. [o. O.], 1822.
- ↑ a b Vgl. Friedberger & Fröhner, S. 468.
- ↑ Vgl. Erich Kopkow: Behandlung eines Falles von chronischem Rotz beim Menschen mit Rotzvakzine. Diss. (med.) Königsberg i. Pr. 1934.
- ↑ Rotz. In: Meyers Konversations-Lexikon. 1888.
- ↑ Vgl. C. Küttner: Beitrag zur Frage über den Rotz beim Menschen. Virchows Archiv, Band 39, Nr. 4 (1867), S. 583.
- ↑ Ghulam Muhammad, M. Zargham Khan, Muhammad Athar: Clinico-Microbiological and Therapeutic Aspects of Glanders in Equines. In: Journal of Equine Science. 9, S. 93–96, doi:10.1294/jes.9.93.
- ↑ Vgl. Gregory & Waag, S. 139 f.
- ↑ Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 160.
- ↑ a b Hermann-Josef Petermann und Susanne Diekmann: Modernisierung der Rotz-Untersuchungs-Richtlinien. In: Deutsches Tierärzteblatt. (Dt. TÄbl.) 60, 2012, S. 908–914.
- ↑ Wilhelm Rieck: Zur Pathologie der Pferdeseuchen im Mittelalter. In: Gundolf Keil, Rainer Rudolf, Wolfram Schmitt, Hans J. Vermeer (Hrsg.): Fachliteratur des Mittelalters. Festschrift Gerhard Eis. Stuttgart 1968, S. 277–292.
- ↑ Vgl. Friedberger & Fröhner, S. 437 f.
- ↑ Vgl. von den Driesch, S. 173.
- ↑ Vgl. Nadja Kosuch: Tierseuchen und ihre Bekämpfung an der Mittelweser im Spiegel Nienburger Quellen (17.–19.Jahrhundert). Diss. (med. vet.) Hannover. Tenea Wissenschaft, Berlin 2004, S. 26 f.
- ↑ Vgl. Petra Sedlmeier: Von der außerordentlichen Fleischbeschau zur Kontrolle der Eigenkontrolle. Entwicklung der Tierärztlichen Lebensmittelüberwachung in Baden und Württemberg. Diss. (med. vet.) [Gießen]. VVB Laufersweiler, Wettenberg 2005, S. 8.
- ↑ Verordnung Carl’s I., Herzog zu Braunschweig-Lüneburg (1713–1780, Reg.-Antr. 1735, Neffe Kaiser Karls VI. und Schwager Friedrich’s des Großen, Stifter des Collegium Carolinum), den Pferde-Rotz der Meldepflicht unterwerfend. Gegeben Braunschweig 4. April 1771. Quelle: luederhniemeyer.com
- ↑ J. Raritsch: Einige Worte über die Pathogenese der Rotz- und Wurmkrankheit des Pferdes. Virchows Archiv, Band 1–2 (1862), S. 33 ff.
- ↑ Vgl. Küttner, S. 559.
- ↑ a b Vgl. von den Driesch, S. 174.
- ↑ Vgl. Meyers Konversationslexikon 1888.
- ↑ Vgl. Die Medizinalpolizei in den preußischen Staaten. Ein Handbuch für Polizei- und Medizinalbeamte, namentlich für Ärzte, Wundärzte, Geburtshelfer, Apotheker und Thierärzte. Bearbeitet von Walther und Zeller, Zweither Theil, Verlag von Gottfried Basse, Quedlinburg/Leipzig 1830, S. 573 f. und S. 595 f.
- ↑ Vgl. G. Jeanselme: Fall von akutem Rotz und Wurm bei den Menschen. Jahrbuch der in- und ausländischen gesammten Medizin. Band 17, 1838, S. 175–177.
- ↑ a b c Vgl. Gregory & Waag, S. 123.
- ↑ Vgl. Derbyshire, S. 722 ff.
- ↑ Vgl. Derbyshire, Conclusions.
- ↑ Vgl. Friedberger & Fröhner, S. 442.
- ↑ Vgl. von Ostertag, S. 596 f.
- ↑ Vgl. Koch, S. 8.
- ↑ Vgl. Koch, S. 10.
- ↑ Vgl. Koch, S. 25 f.
- ↑ Vgl. Koch, S. 29.
- ↑ Vgl. Koch, S. 33.
- ↑ R. D. Verma: Glanders in India with special reference to incidence and epidemiology. In: Indian Veterinary Journal, 1981, Band 58, Nummer 3, S. 177–183.
- ↑ Bioterrorism Agents/Diseases. Centers for Disease Control and Prevention.
- ↑ a b Rotz und Milzbrand. In: Der Spiegel. Nr. 30, 1998, S. 55 (online).
- ↑ a b c Vgl. Gregory & Waag, S. 122.