Meinwald-Umlagerung
Die Meinwald-Umlagerung ist eine Namensreaktion in der organischen Chemie. Die Reaktion ist nach ihrem Entwickler, dem US-amerikanischen Chemiker (Organische Chemie, Biochemie) Jerrold Meinwald (1927–2018), benannt. Sie gehört zu den Umlagerungsreaktionen und dient der Synthese von Carbonylverbindungen aus Epoxiden.[1][2]
Übersichtsreaktion
[Bearbeiten | Quelltext bearbeiten]In dieser Reaktion erfolgt unter Katalyse einer Lewis-Säure die Umwandlung eines Epoxids zu einer Carbonylverbindung (R1, R2, R3 = H, Alkyl, Aryl).

Reaktionsmechanismus
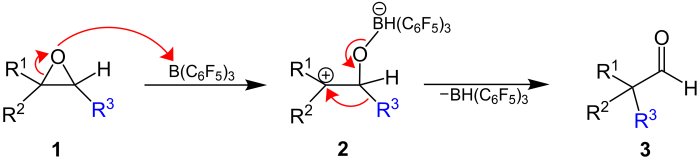
[Bearbeiten | Quelltext bearbeiten]Der erste Schritt der Meinwald-Umlagerung ist der elektrophile Angriff der Lewis-Säure, in diesem Beispiel Tris(pentafluorophenyl)boran, auf das freie Elektronenpaar des Sauerstoffs im Epoxidring (1). Das unter Ringöffnung gebildete Zwischenprodukt (2) besitzt ein Carbeniumion. Im zweiten Schritt wandert der Rest R3 zum Carbeniumion, was letztlich zur Bildung der Carbonylgruppe (3) unter Abspaltung der Lewis-Säure führt.[3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Michael B. Smith: March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure , John Wiley & Sons, Hoboken, New Jersey, 7. Auflage, 2013, S. 1344, ISBN 978-0-470-46259-1.
- ↑ Martine R. Tiddens, Robertus J. M. Klein Gebbink, Matthias Otte: The B(C6F5)3-Catalyzed Tandem Meinwald Rearrangement–Reductive Amination, Org. Lett. 2016, S. 3714–3717. doi:10.1021/acs.orglett.6b01744.
- ↑ Zerong Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Hoboken, New Jersey 2010, ISBN 978-0-470-63885-9, Meinwald Rearrangement, S. 1880–1882, doi:10.1002/9780470638859.conrr422.