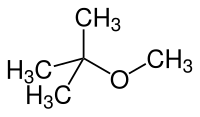
MTBE
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Methyl-tert-butylether | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C5H12O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit charakteristischem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 88,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,74 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
55 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,3664 (25 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
MTBE (nach IUPAC-Nomenklatur: 2-Methoxy-2-methylpropan, ausgeschrieben auch Methyl-tert-butylether) ist eine organisch-chemische Verbindung aus der Stoffgruppe der aliphatischen Ether. Er hat zum einen wegen seiner Verwendung als Zusatzstoff in Ottokraftstoffen sowie zum anderen als Lösungsmittel in der organischen Chemie eine gewisse großtechnische Bedeutung erlangt.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]MTBE wird großtechnisch durch säurekatalysierte Veretherung von Isobuten mit Methanol bei Temperaturen von 40–90 °C und Drücken von 3–20 bar an sauren Ionentauscherharzen hergestellt.[7]

Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]MTBE ist eine farblose, typisch etherartig riechende Flüssigkeit. Die Verbindung siedet unter Normaldruck bei 55 °C. Der Schmelzpunkt liegt bei −109 °C. Die Mischbarkeit mit Wasser ist begrenzt: In 100 g Wasser lösen sich bei Raumtemperatur maximal 4,8 g MTBE, umgekehrt lösen sich in 100 g MTBE maximal 1,4 g Wasser.[8] Das Azeotrop mit Wasser siedet bei Normaldruck bei 52,9 °C mit einer Azeotropzusammensetzung von 96,5 % MTBE und 3,5 % Wasser (jeweils Massenanteile).[8] Mit Methanol wird bei einem Gehalt von 10 Ma% ein bei 51 °C siedendes Azeotrop gebildet.[9]
Thermodynamische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 6,34991, B = 1312,52 und C = −26,03 im Temperaturbereich von 315 K bis 365 K.[10]
Die wichtigsten thermodynamischen Eigenschaften sind in der folgenden Tabelle aufgelistet:
| Eigenschaft | Typ | Wert [Einheit] |
|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−315,4 kJ·mol−1[11] −285,0 kJ·mol−1[11] |
| Standardentropie | S0liquid S0g |
265,3 J·mol−1·K−1[12] als Flüssigkeit 357,8 J·mol−1·K−1[12] als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −3368,97 kJ·mol−1[13] |
| Heizwert | Hu | 35 MJ/kg[14] |
| Wärmekapazität | cp | 187,5 J·mol−1·K−1 (25 °C)[12] als Flüssigkeit |
| Schmelzenthalpie | ΔfH0 | 7,6 kJ·mol−1[15] beim Schmelzpunkt |
| Schmelzentropie | ΔfS0 | 46,18 kJ·mol−1[15] beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH0 | 27,94 kJ·mol−1[16] beim Normaldrucksiedepunkt |
| Kritische Temperatur | TC | 223,25 °C[17] |
| Kritischer Druck | PC | 33,97 bar[17] |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·exp(−β·Tr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 46,23 kJ/mol, β = 0,2893 und Tc = 497,1 K im Temperaturbereich zwischen 298 K (24,85 °C) und 343 K (69,85 °C) beschreiben.[16]
-
Dampfdruckfunktion von MTBE
-
Temperaturabhängigkeit der Verdampfungsenthalpie von MTBE
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]MTBE bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −28 °C. Der Explosionsbereich liegt zwischen 1,6 Vol.‑% (58 g/m3) als untere Explosionsgrenze (UEG) und 8,4 Vol.‑% (310 g/m3) als obere Explosionsgrenze (OEG).[8] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −33 °C sowie einen oberen Explosionspunkt von −5 °C. Die Grenzspaltweite wurde mit 1 mm bestimmt.[2] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[2] Die Zündtemperatur beträgt 460 °C.[18] Der Stoff fällt somit in die Temperaturklasse T1. Die elektrische Leitfähigkeit ist mit 3,0·10−11 S·m−1 eher gering.
Entsprechend den Gefahrgutvorschriften ist MTBE der Klasse 3 (Entzündbare flüssige Stoffe) mit der Verpackungsgruppe II (mittlere Gefährlichkeit) zugeordnet (Gefahrzettel: 3).[2]
Isomere
[Bearbeiten | Quelltext bearbeiten]Konstitutionsisomere der Verbindung sind Isobutylmethylether, n-Butylmethylether und sec-Butylmethylether.
Verwendung
[Bearbeiten | Quelltext bearbeiten]| MTBE | |
|---|---|
| Kurzbeschreibung | Klopfschutzmittel für Ottokraftstoffe |
| Eigenschaften | |
| Aggregatzustand | flüssig |
| Oktanzahl | |
| Flammpunkt |
−28 °C |
| Zündtemperatur | 460 °C |
| Explosionsgrenze | 1,6–8,4 Vol.-% |
| Temperaturklasse | T1 |
| Sicherheitshinweise | |
| UN-Nummer |
2398[2] |
| Gefahrnummer |
33[2] |
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |
MTBE wird hauptsächlich als Klopfschutzmittel in Ottokraftstoffen zugesetzt. Es erhöht die Oktanzahl und führt dabei zu einer Verringerung der Klopfneigung des Ottomotors. Es ersetzt Tetraethylblei in unverbleiten Kraftstoffen.
Es ist auch in Starthilfesprays enthalten, welche bei Startschwierigkeiten in den Ansaugtrakt des Verbrennungsmotors eingespritzt werden.
MTBE findet in der organischen Chemie zunehmend Verwendung als Lösungsmittel sowie Extraktionsmittel. Es ersetzt dabei Ether wie Diethylether oder Tetrahydrofuran, da MTBE eine sehr geringe bis keine Neigung zur Bildung von Peroxiden durch Autoxidation besitzt.[8] Dies liegt daran, dass auf der tert-Butyl-Seite am α-ständigen Kohlenstoffatom kein Peroxid gebildet werden kann (da es als tertiäres Kohlenstoffatom kein Wasserstoffatom trägt) und eine Peroxidbildung an der Methylgruppe mechanistisch über ein sehr instabiles Methyl-Radikal verlaufen müsste.
Umweltverträglichkeit
[Bearbeiten | Quelltext bearbeiten]Diskutiert wird die Umweltverträglichkeit von MTBE besonders im Hinblick auf das Grundwasser. In den USA kam es aufgrund von Tankleckagen zu Verunreinigungen des Trinkwassers. Die Beimischung ist deshalb in etlichen US-Bundesstaaten verboten[20] und ist dort durch tert-Amylmethylether (TAME) ersetzt worden. Die Grundwassergefährdung durch Kraftstofflagerung an Tankstellen wird z. B. in Deutschland als untergeordnet betrachtet, da hier an den Tankstellen zumeist doppelwandige Erdtanks verwendet werden. MTBE kann aufgrund des intensiven Geruchs schon in geringen Spuren wahrgenommen werden. Zurzeit wird in Deutschland vermehrt ETBE (aus Bioethanol und Isobuten) eingesetzt, um die erforderlichen Bio-Beimischungsquoten erfüllen zu können (siehe auch Bioethanol).
Sicherheitshinweise und Risikobewertung
[Bearbeiten | Quelltext bearbeiten]Wegen der leichten Entzündbarkeit sollte mit tert-Butylmethylether stets unter einem Abzug gearbeitet werden. Die Haut sollte gegen Spritzer durch Tragen von Kittel und geeigneten Schutzhandschuhen geschützt werden. Beim Abfüllen größerer Mengen ist es ratsam, Maßnahmen gegen elektrostatische Aufladung zu treffen (Verwendung von Blechkannen und -trichtern, die geerdet werden).
- Bei Einatmen: betroffene Person sofort an die frische Luft bringen. Die Dämpfe können Kopfschmerzen und Benommenheit bis hin zur Ohnmacht hervorrufen.
- Bei Hautkontakt: mit viel Wasser und Seife abwaschen. Intensiver Hautkontakt kann zu denselben Symptomen wie das Einatmen führen.
- Bei Augenkontakt: intensiv mit Wasser ausspülen (Augendusche). Arzt hinzuziehen.
- Bei Verschlucken: Mund mit viel Wasser ausspülen. Arzt hinzuziehen.
MTBE wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von MTBE waren die Besorgnisse bezüglich hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie als potentieller endokriner Disruptor. Die Neubewertung fand ab 2014 statt und wurde von Frankreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[21][22]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Volker Linnemann (2003): Umweltverhalten von MTBE nach Grundwasserkontamination. Schriften des Forschungszentrums Jülich, Reihe Umwelt/Environment Band/Volume 40, ISBN 3-89336-339-4; hdl:2128/152.
- Günter Pahlke, Heike Leonhardt, Matthias Tappe: Mögliche Umweltbelastungen durch die Nutzung von MTBE (Methyl-tertiär-Butylether) als Kraftstoffzusatz in Deutschland und Westeuropa. Umweltbundesamt Berlin in der Zeitschrift Erdöl Erdgas Kohle, Heft 10, 2000.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu T-BUTYL METHYL ETHER in der CosIng-Datenbank der EU-Kommission, abgerufen am 12. Dezember 2021.
- ↑ a b c d e f g h i j k l m n o p Eintrag zu Methyl-tert-butylether in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Eintrag zu tert-Butylmethylether. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-344.
- ↑ Eintrag zu tert-butyl methyl ether im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 1634-04-4 bzw. MTBE), abgerufen am 2. November 2015.
- ↑ Patent EP0082316B1: Verfahren zur Herstellung von Methyl-Tert.-butylether (MTBE) und weitgehend von i-Buten und von Methanol befreiten Kohlenwasserstoff-Raffinaten und Vorrichtung hierfür. Angemeldet am 20. November 1982, veröffentlicht am 3. Juli 1985, Anmelder: EC Erdölchemie GmbH, Erfinder: Bernhard Schleppinghoff, Martin Becker.
- ↑ a b c d K. Watanabe, N. Yamagiwa, Y. Torisawa: Cyclopentyl Methyl Ether as a New and Alternative Process Solvent. In: Org Process Res Dev. 11 (2007), S. 251–258; doi:10.1021/op0680136.
- ↑ I.M. Smallwood: Handbook of organic solvent properties. Arnold, London 1996, ISBN 0-340-64578-4, S. 210–211.
- ↑ A. Aucejo, S. Loras, R. Munoz: Isobaric Vapor-Liquid Equilibrium in the Systems 2-Methylpentane + Methyl 1,1-Dimethylethyl Ether, + Ethyl 1,1-Dimethylethyl Ether, and + Methyl 1,1-Dimethylpropyl Ether. In: J. Chem. Eng. Data 43 (1998), S. 973–977; doi:10.1021/je980090b.
- ↑ a b H. Arntz, K. Gottlieb: High-pressure heat-flow calorimeter determination of the enthalpy of reaction for the synthesis of methyl t-butyl ether from methanol and 2-methylpropene. In: J. Chem. Thermodyn. 17 (1985), S. 967–972; doi:10.1016/0021-9614(85)90009-6.
- ↑ a b c R.J.L. Andon, J.F. Martin: Thermodynamic properties of organic oxygen compounds. 40. Heat capacity and entropy of six ethers. In: J. Chem. Thermodynam. 7 (1975), S. 593–606; doi:10.1016/0021-9614(75)90194-9.
- ↑ J.O. Fenwick, D. Harrop, A.J. Head: Thermodynamic properties of organic oxygen compounds. 41. Enthalpies of formation of eight ethers. In: J. Chem. Thermodyn. 7 (1975), S. 943–954; doi:10.1016/0021-9614(75)90158-5.
- ↑ B. Höhlein, Th. Grube, P. Biedermann, H. Bielawa, G. Erdmann, L. Schlecht, G. Isenberg, R. Edinger: Methanol als Energieträger ( vom 13. August 2016 im Internet Archive), Forschungszentrums Jülich, 2003. ISBN 3-89336-338-6.
- ↑ a b J.F. Martin, R.J.L. Andon: Thermodynamic properties of organic oxygen compounds. Part LII. Molar heat capacity of ethanoic, propanoic, and butanoic acids. In: J. Chem. Thermodynam. 14 (1982), S. 679–688; doi:10.1016/0021-9614(82)90083-0.
- ↑ a b V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- ↑ a b T.E. Daubert, J.W. Jalowka, V. Goren: Vapor pressure of 22 pure industrial chemicals. In: AIChE Symp. Ser., 1987, 83, 256, S. 128–156.
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen, Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ a b François GARIN: Formulations of Fuels ( vom 15. Oktober 2005 im Internet Archive) (PPT).
- ↑ EPA, Gasoline Composition Regulations Affecting LUST Sites (PDF; 1,1 MB)
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Tert-butyl methyl ether, abgerufen am 28. November 2023.



