Mukaiyama-Hydratisierung
Die Mukaiyama-Hydratisierung ist eine organisch-chemische Reaktion, die von dem japanischen Chemiker Teruaki Mukaiyama (1927–2018) entdeckt wurde.[1]
Übersichtsreaktion
[Bearbeiten | Quelltext bearbeiten]Bei der Mukaiyama-Hydratisierung wird formal ein Äquivalent Wasser an ein Alken addiert. Als Sauerstoffquelle für die entstehende Alkohol-Gruppe dient Luftsauerstoff, Wasserstoff wird vom Phenylsilan bereitgestellt. Dabei entsteht das Markownikow-Produkt. Als Katalysator für diese Reaktion dient Cobalt(II)acetylacetonat [Co(acac)2]:
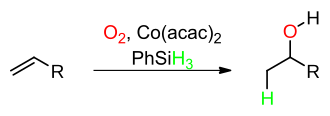
Mechanismus
[Bearbeiten | Quelltext bearbeiten]Der Mechanismus der Mukaiyama-Hydratisierung ist nicht vollständig geklärt. Einen ersten Mechanismus publizierte Mukaiyama 1989. Dabei nimmt er an, dass aus Alken, Cobalt-Katalysator (CoL2), Sauerstoff und dem Phenylsilan (PhSiH3) als Wasserstoffquelle ein Cobalt-Peroxid-Addukt entsteht. Durch eine Transmetallierung entsteht ein Silylperoxid. Unter Katalyse der Cobaltverbindung wird die Sauerstoff-Sauerstoff-Bindung gespalten und der Alkohol entsteht:

Varianten
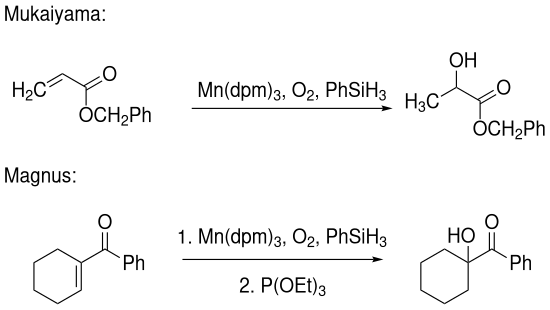
[Bearbeiten | Quelltext bearbeiten]Neben der Umsetzung von Alkenen existieren auch Protokolle zur Hydratisierung von α,β-ungesättigten Carbonylverbindungen. Sowohl die Variante nach Mukaiyama[2] als auch die von Magnus[3] nutzen einen Mangan-basierten Katalysator, in dem das Acetylacetonat gegen 2,2,6,6-Tetramethyl-3,5-heptandion (Dipivaloylmethan, dpm) ausgetauscht wurde. Während Mukaiyamas Arbeit sich hauptsächlich mit der Umsetzung von α,β-ungesättigten Benzylestern beschäftigt, gelingt es Magnus auch cyclische α,β-ungesättigte Ketoverbindungen zu hydratisieren:
Anwendung
[Bearbeiten | Quelltext bearbeiten]Die Mukaiyama-Hydratisierung findet in der Totalsynthese des Sesquiterpen (+)-Omphadiol Verwendung. Dabei wird im ersten Schritt der Synthese (R)-Carvon hydratisiert. Dabei fungiert iso-Propanol (i-PrOH) als Lösungsmittel.[4]

Kritik
[Bearbeiten | Quelltext bearbeiten]Die Mukaiyama-Hydratisierung zählt aus der Perspektive der Atomökonomie zu den weniger effizienten Reaktionen, da neben dem Zielmolekül (Alkohol) erhebliche Abfallmengen in mindestens stöchiometrischen Anteilen entstehen. Deshalb beschränkt sich die Anwendung auf den Labormaßstab.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Shigeru Isayama, Teruaki Mukaiyama: A New Method for Preparation of Alcohols from Olefins with Molecular Oxygen and Phenylsilane by the Use of Bis(acetylacetonato)cobalt(II). In: Chemistry Letters. Band 18, Nr. 6, Juni 1989, S. 1071–1074, doi:10.1246/cl.1989.1071.
- ↑ Satoshi Inoki, Koji Kato, Shigeru Isayama, Teruaki Mukaiyama: A New and Facile Method for the Direct Preparation of α-Hydroxycarboxylic Acid Esters from α,β-Unsaturated Carboxylic Acid Esters with Molecular Oxygen and Phenylsilane Catalyzed by Bis(dipivaloylmethanato)manganese(II) Complex. In: Chemistry Letters. Band 19, Nr. 10, 1. Oktober 1990, S. 1869–1872, doi:10.1246/cl.1990.1869.
- ↑ Philip Magnus, Andrew H Payne, Michael J Waring, David A Scott, Vince Lynch: Conversion of α,β-unsaturated ketones into α-hydroxy ketones using an MnIII catalyst, phenylsilane and dioxygen: acceleration of conjugate hydride reduction by dioxygen. In: Tetrahedron Letters. Band 41, Nr. 50, 9. Dezember 2000, S. 9725–9730, doi:10.1016/S0040-4039(00)01727-5 (sciencedirect.com [abgerufen am 12. Januar 2020]).
- ↑ Gang Liu, Daniel Romo: Total Synthesis of (+)-Omphadiol. In: Angewandte Chemie International Edition. Band 50, Nr. 33, 2011, S. 7537–7540, doi:10.1002/anie.201102289.