Mycoplasma gallisepticum
| Mycoplasma gallisepticum | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
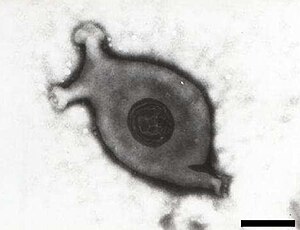
Mycoplasma gallisepticum | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Mycoplasma gallisepticum | ||||||||||||
| Edward & Kanarek 1960 |
Mycoplasma gallisepticum (MG) ist ein Prokaryont aus der Klasse der Mollicutes und der Familie der Mycoplasmataceae und bewohnt die oberen Atemwege. MG unterscheidet sich von Bakterien durch das Fehlen einer Zellwand. Das Genom dieser Art wurde im Jahr 2012 vollständig sequenziert.[1]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Mycoplasma gallisepticum kommt als Erreger von Atemwegserkrankungen bei Geflügel, z. B. Hühnern und Puten vor und lässt sich aus deren Respirationstrakt isolieren. Bei der Infektion kommt es häufig zu einer Mischinfektion mit anderen viralen oder bakteriellen Krankheitserregern.[2]
Merkmale
[Bearbeiten | Quelltext bearbeiten]Arten der Gattung Mycoplasma (auch als Mykoplasmen bezeichnet) weisen die Besonderheit auf, dass sie keine sonst für Bakterien typische Zellwand besitzen. Damit ähneln sie eher einem Protoplasten, was sich auch in der Zellmorphologie zeigt: Sie sind von vielgestaltiger (pleomorpher), veränderlicher, bläschenförmiger Gestalt. Ihr Wachstum erfolgt aerob bis fakultativ anaerob, und obwohl sie im Rahmen einer Gramfärbung als gramnegativ dargestellt werden, da ihnen die Zellwand fehlt, haben genetische Untersuchungen ergeben, dass sie mit grampositiven Kokken mit geringem GC-Gehalt in der DNA verwandt sind.[3]
Die Zellen sind wegen der fehlenden Mureinschicht zwar anfällig für osmotische Schwankungen des umgebenden Mediums, sind aber im Vergleich zu einem Protoplasten weniger labil. Dies ist auf die Anwesenheit von Sterinen in der Cytoplasmamembran zurückzuführen, Mycoplasma gallisepticum benötigt daher Cholesterin (Cholesterol) im Medium, um wachsen zu können. Da sie aber normalerweise als Parasiten einen Wirtsorganismus besiedeln, erhalten sie von dessen Zellen Sterine und andere essentielle Stoffwechselkomponenten.[4] Zusätzlich finden sich noch Lipoglycane in der Zellmembran, wie diese auch bei den Thermoplasmatales, einer Ordnung innerhalb der Archaea, vorzufinden sind. Sie ermöglichen es den Bakterienzellen, sich an Zelloberflächenrezeptoren von tierischen Wirtszellen anzuheften, ähnlich wie dies bei den Lipopolysacchariden der gramnegativen Bakterien der Fall ist.[3]
Stoffwechsel
[Bearbeiten | Quelltext bearbeiten]Mycoplasma gallisepticum ist wie alle Vertreter dieser Gattung als „Stoffwechselkrüppel“ anzusehen. Im Verlauf der Evolution hat das Bakterium viele nicht-essentielle Gene verloren, zum einen die für die Bildung einer Zellwand, aber auch die für die Synthese vieler Stoffwechselprodukte, die es von den Wirtszellen zur Verfügung gestellt bekommen hat.[5] Das zeigt sich auch an dem sehr kleinen Genom dieser Art, das gerade einmal 986 Kilobasenpaare (kb) aufweist, das ist weniger als ein Fünftel der Genomgröße von Escherichia coli.[1] Benötigte Stoffwechselkomponenten muss es entweder von den Wirtszellen erhalten oder sie müssen dem Nährmedium zugesetzt werden.
Nachweise
[Bearbeiten | Quelltext bearbeiten]Bei der Isolierung des Erregers ist zu beachten, dass er aufgrund seiner Eigenschaften nicht lange in der Umwelt überleben kann, daher sind z. B. Abstriche des infizierten Gewebes mit einem Tupfer in einer sterilen Nährlösung aufzubewahren, um die Zellen gegen Austrocknung zu schützen.[4]
Auf festen Nährmedien, die Agar-Agar enthalten, bildet Mycoplasma gallisepticum Kolonien, die einem Spiegelei ähnlich sehen. Dieses typische Aussehen ist darauf zurückzuführen, dass die Zellen so wachsen, dass sie von dem Medium eingebettet werden. Wenn man sie auf einem Nährmedium anzüchten möchte, genügen gängige Komplettmedien für Bakterien nicht, da sie aufgrund ihrer geringen Genom-Größe die Fähigkeit zur Synthese zahlreicher Stoffwechselkomponenten verloren haben. Die Kultivierung von M. gallisepticum ist daher aufwändig, denn es müssen sehr komplexe Nährmedien verwendet werden, z. B. ein Hefeextrakt-Pepton-Rinderherz-Infusionsmedium, das zusätzlich noch frisches Serum enthält, um den Bedarf an Sterinen und ungesättigten Fettsäuren abzudecken.[3]
Der Nachweis einer Infektion mit Mycoplasma gallisepticum erfolgt daher meistens durch Nachweis der im infizierten Organismus gebildeten Antikörper mit Hilfe des ELISA-Verfahrens, weiterhin ist noch ein Real-time Multiplex PCR Testkit zugelassen, um direkt die DNA des Bakteriums nachzuweisen.[6]
Veterinärmedizinische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Infektionsquellen und Infektionskrankheiten
[Bearbeiten | Quelltext bearbeiten]Die Infektion gilt als Aufbereiter der CRD (Chronic Respiratory Disease), die durch Sekundärerreger ein klinisches Gesamtbild ergibt. Eine Infektion durch Mycoplasma gallisepticum beim Haushuhn erfolgt als Schmierinfektion über die Stalleinrichtung, als Tröpfcheninfektion und direkt durch die Henne auf den Embryo. Die Erkrankung (Mykoplasmose) äußert sich in der Regel durch zunächst trockenes kurzes Niesen, das durch die Nasenlöcher bei geschlossenem Schnabel ausgestoßen wird. Bei einer fortschreitenden Ausbreitung im Respirationstrakt ist auch klarer Ausfluss aus den Nasenöffnungen in Form eines feuchten Films hin zur Schnabelspitze erkennbar. Dieser Film wird besonders dann auffällig, wenn Futterreste und Einstreu um die Öffnungen kleben.
Bei Puten sind die Symptome z. T. ähnlich und werden als infektiöse Sinusitis bezeichnet, es wurden aber auch Veränderungen in Gelenken und somit Motorik beschrieben.
Obwohl M. gallisepticum nur kurze Zeit in der Umwelt überleben kann, gelingt es dem Erreger, sich schnell auf einen neuen Wirt zu übertragen. Die Massentierhaltung in der Geflügelzucht begünstigt dies. Es muss noch weiter untersucht werden, inwiefern Wildvögel mit Kontakt zu infizierten Tieren innerhalb der Geflügelzucht als Vektoren für die Übertragung von Mycoplasma gallisepticum fungieren.[5]
Pathogenität
[Bearbeiten | Quelltext bearbeiten]Die Pathogenität der Mycoplasmen ist noch nicht hinreichend geklärt, es wird vermutet, dass die in der Zellmembran enthaltenen Lipoglycane daran beteiligt sind, da sie die Produktion von Antikörpern bei Versuchstieren auslösen.[3] M. gallisepticum kann sich an die tierischen Zellen des Zielgewebes anheften, in sie eindringen und intrazellulär verbleiben. Außerdem vermögen sie die dreidimensionale Struktur ihrer Oberflächenantigene zu verändern, es wird vermutet, dass sie durch diesen Mechanismus die Immunantwort des Wirtsorganismus umgehen, um so im Wirt zu überdauern. Die genauen Abläufe auf zellulärer und molekularer Ebene, die zu den klinischen Symptomen führen, sind immer noch unklar, es ist wahrscheinlich, dass die pathogenen Strukturen der Zellmembran als Endotoxin wirken, sie werden frei, nachdem die Zelle zerstört wird.[5] Diese Toxine lagern sich im Respirationstrakt ab und machen so das Tier für den Verzehr eingeschränkt nutzbar.
Therapie
[Bearbeiten | Quelltext bearbeiten]Eine Sanierung des betroffenen Bestandes ist nur über die Unterbrechung der Infektionskette durch eine ausreichend lange Ausstallung möglich. Mycoplasma gallisepticum reagiert auf das Antibiotikum Tylosin. Die Symptome können damit kurzfristig zurückgedrängt werden, die Reinfektion erfolgt aber bei durchgehendem Stallbesatz prompt, da das Bakterium außerhalb des Körpers in der Umwelt (Stall, Auslauf) eine beschränkte Zeit seine Infektionsfähigkeit erhält. Ein Auftreten von Symptomen erleichtert die Infektion durch weitere wirtschaftlich bedeutende Atemwegserkrankungen wie z. B. Infektiöse Bronchitis (IB) und Aviäre Rhinotracheitis (ART).
In Österreich gibt es Bestrebungen, die durch Forschungsarbeit der Veterinärmedizinischen Universität in Wien gestärkt werden, Geflügelbestände durch gezieltes Stallmanagement frei von Mycoplasma gallisepticum zu bekommen. Grund ist der Zoonosenverdacht. So soll das Bakterium beim Menschen unter anderem Reizungen der Augenbindehaut (Konjunktivitis) hervorrufen.
Quellen
[Bearbeiten | Quelltext bearbeiten]- Klaus Damme, Ralf-Achim Hildebrand: Geflügelhaltung. Ulmer 2002, ISBN 978-3800139293
- Vortrag von Detlef Bibl im Rahmen der Ausbildung zum Veterinärmediziner an der Vet.med. Univ. Wien
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Mycoplasma gallisepticum auf der Webseite der Genoms Online Database (GOLD). Abgerufen am 2. März 2013.
- ↑ Jahresbericht des FLI 2005 (PDF; 2,8 MB) des Friedrich-Loeffler-Instituts, abgerufen am 2. März 2013.
- ↑ a b c d Michael T. Madigan, John M. Martinko, Jack Parker: Brock Mikrobiologie. Deutsche Übersetzung herausgegeben von Werner Goebel, 1. Auflage. Spektrum Akademischer Verlag GmbH, Heidelberg/Berlin 2000, ISBN 978-3-8274-0566-1.
- ↑ a b Herbert Hof, Rüdiger Dörries: Duale Reihe: Medizinische Mikrobiologie. 3. Auflage. Thieme Verlag, Stuttgart 2005, ISBN 978-3-13-125313-2.
- ↑ a b c J. M. Bradbury: Gordon Memorial Lecture. Poultry mycoplasmas: sophisticated pathogens in simple guise. In: British poultry science. Band 46, Nummer 2, April 2005, S. 125–136, ISSN 0007-1668. PMID 15957431. (Review).
- ↑ Liste der nach § 17 c TierSG zugelassenen Mittel (PDF; 352 kB) des Friedrich-Loeffler-Instituts, abgerufen am 2. März 2013