Natriumtellurat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
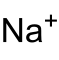 
| ||||||||||
| Allgemeines | ||||||||||
| Name | Natriumtellurat | |||||||||
| Andere Namen |
| |||||||||
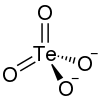
| Summenformel | Na2TeO4 | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 237,58 g·mol−1 | |||||||||
| Aggregatzustand |
fest[2] | |||||||||
| Dichte |
4,26 g·cm−3[1] | |||||||||
| Löslichkeit |
löslich in Wasser[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Natriumtellurat ist eine anorganische chemische Verbindung des Natriums aus der Gruppe der Tellurate.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Natriumtellurat kann durch Dehydration von Dinatrium-tetrahydrogen-orthotellurat Na2H4TeO6 und anschließende Reaktion mit Natriumnitrat gewonnen werden.[1]
Ebenfalls möglich ist die Darstellung durch Erhitzung von Natriumtellurit an Luft.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Natriumtellurat ist ein farbloser[1] Feststoff, der löslich in Wasser ist.[2] Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pbcn (Raumgruppen-Nr. 60), die sich bei 420 °C in eine monokline Kristallstruktur ändert.[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Natriumtellurat wird als Zwischenprodukt bei der Extraktion von Tellur verwendet. Lösungen von Natriumtellurat werden für schwarze oder blau-schwarze Beschichtungen auf Eisen, Stahl, Aluminium und Kupfer verwendet.[2][5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d B. Kratochvíl, L. Jenšovský: The crystal structure of sodium metatellurate. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 33, 1977, S. 2596, doi:10.1107/S0567740877008978.
- ↑ a b c d e f Datenblatt Sodium tellurate(VI) hydrate, Te 45% min bei Alfa Aesar, abgerufen am 19. April 2019 (Seite nicht mehr abrufbar).
- ↑ Wolfgang A. Herrmann, Christian Erich Zybill: Synthetic Methods of Organometallic and Inorganic Chemistry, Volume 4, 1997 Volume 4: Sulfur, Selenium and Tellurium. Georg Thieme Verlag, 2014, ISBN 3-13-179191-8, S. 201 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Cyrille Galven, Thierry Pagnier u. a.: β-Na2TeO4 : Phase Transition from an Orthorhombic to a Monoclinic Form. Reversible CO Capture. In: Inorganic Chemistry. 57, 2018, S. 7334, doi:10.1021/acs.inorgchem.8b00993.
- ↑ Guangcheng Xi, Yiya Peng u. a.: Synthesis, Characterization, and Growth Mechanism of Tellurium Nanotubes. In: Crystal Growth & Design. 5, 2005, S. 325, doi:10.1021/cg049867p.
