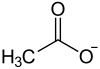
Neodymacetat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Neodymacetat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H9NdO6 | ||||||||||||||||||
| Kurzbeschreibung |
purpurroter Feststoff (Hydrat)[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 321,37 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
2,184 g·cm−3 (Hydrat)[2] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Neodym(III)-acetat ist eine chemische Verbindung des Neodyms aus der Gruppe der Acetate.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Neodym(III)-acetat kann durch Reaktion von Neodymsalzen mit Essigsäure gewonnen werden.[5] Wasserfreies Neodym(III)-acetat kann durch direkte Oxidation von Neodym mit Malonsäure in einer Glasampulle bei 180 °C gewonnen werden.[6]
Ebenfalls möglich ist die Darstellung des Hydrates durch Auflösung von Neodym(III)-oxid in Eisessig, die Alkalisierung mit Natriumhydroxid auf einen pH-Wert von 4 und anschließende langsame Verdampfung der Lösung.[2] Bei unterschiedlichen pH-Werten können unterschiedliche Hydrate erhalten werden.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Neodym(III)-acetat ist als Hydrat ein purpurroter Feststoff, der löslich in Wasser ist.[3] Die Löslichkeit der Verbindung erhöht sich bei Zugabe von Natriumacetat, wobei sich ein blauer Komplex bildet.[8] Einkristalle des Anhydrates zeigen eine hellviolette Farbe und besitzen eine monokline Kristallstruktur mit der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3) mit a = 2201,7(2), b = 1850,0(1), c = 2419,0(3) pm, β = 96,127(8)°. Die meisten Nd3+-Kationen werden durch neun (oder acht) Sauerstoffatome der Acetatliganden koordiniert, die diese Polyeder zu leicht gewellten Schichten verbinden, die in [010]-Richtung gestapelt sind.[6] Vom Hydrat kommen mehrere Formen mit unterschiedlichem Kristallwassergehalt vor. Diese besitzen eine Kristallstruktur mit der Raumgruppe P21/m (Raumgruppen-Nr. 11). Im Temperaturbereich von 130–212 °C geben diese in Stufen ihr Kristallwasser ab und bilden das Anhydrat. Im Temperaturbereich von 320–430 °C zersetzt sich das Anhydrat unter Bildung von Nd2O2(CO3), welches sich über eine weitere Zwischenstufe bei 880 °C zu Neodym(III)-oxid zersetzt.[9] Das Tetrahydrat und das Sesquihydrat kristallisieren in der Raumgruppe P1 (Raumgruppen-Nr. 2).[10]

Verwendung
[Bearbeiten | Quelltext bearbeiten]Neodym(III)-acetat wird hauptsächlich für Glas, Kristall und Kondensatoren verwendet. Es ist nützlich in Schutzgläsern für Schweißerbrillen. Es wird auch in Kathodenstrahlröhrenbildschirmen verwendet, um den Kontrast zwischen Rot- und Grüntönen zu verstärken. In der Glasherstellung wird es wegen seiner attraktiven violetten Färbung des Glases sehr geschätzt.[4] Die Verbindung kann auch zur Herstellung von Nanopartikeln von Neodym(III)-oxid verwendet werden.[11]
Uranylacetat ist seit Jahrzehnten das Standardkontrastmittel in der Transmissionselektronenmikroskopie (TEM). Neodymacetat könnte Uranylacetat als Kontrastmittel ersetzen.[12]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt Neodym(III)-acetat , 99.9% bei Sigma-Aldrich, abgerufen am 7. Mai 2022 (PDF).
- ↑ a b Anna Mondry, Krystyna Bukietyńska: Electronic absorption spectroscopy of neodymium acetate single crystals. In: Journal of Alloys and Compounds. Band 275-277, 1998, S. 818–821, doi:10.1016/S0925-8388(98)00449-6.
- ↑ a b Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 480 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Datenblatt Neodymium(III) acetate hydrate, 99.9% (REO) bei Alfa Aesar, abgerufen am 7. Mai 2022 (Seite nicht mehr abrufbar).
- ↑ Himadri B. Bohidar, Kamla Rawat: Design of Nanostructures. Wiley, 2017, ISBN 978-3-527-81043-7 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Sonia Gomez Torres, Gerd Meyer: Anhydrous Neodymium(III) Acetate. In: Zeitschrift für anorganische und allgemeine Chemie. Band 634, Nr. 2, 2008, S. 231–233, doi:10.1002/zaac.200700407.
- ↑ Zhang Yugeng, Zhao Guiwen: Synthesis and Spectral Studies of Three Neodymium Acetate Complexes. In: Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry. Band 25, Nr. 3, 1995, S. 371–381, doi:10.1080/15533179508218227.
- ↑ A. K. Holliday, A. G. Massey: Non-Aqueous Solvents in Inorganic Chemistry. Elsevier Science, 2013, ISBN 978-1-4831-5941-6, S. 75 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Noura Mossaed Saleh, Ghada Adel Mahmoud, AbdelRahman AbdelMonem Dahy, Soliman Abdel-Fadeel Soliman, Refaat Mohamed Mahfouz: Kinetics of nonisothermal dehydration of unirradiated and γ-ray irradiated neodymium (III) acetate hydrate. In: Radiochimica Acta. Band 107, Nr. 2, 2019, S. 165–178, doi:10.1515/ract-2018-2998.
- ↑ De Gruyter: 20. Jahrestagung Der Deutschen Gesellschaft Für Kristallographie, MS17-P08 Structural study of hydrous neodymium acetates, P. Held', P. Becker', L. Bohaty' 'Institute for Crystallography, University of Cologne, Koeln. De Gruyter, 2015, ISBN 978-3-486-99463-6, S. 119 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Leszek Kępiński, Mirosław Zawadzki, Włodzimierz Miśta: Hydrothermal synthesis of precursors of neodymium oxide nanoparticles. In: Solid State Sciences. Band 6, Nr. 12, 2004, S. 1327–1336, doi:10.1016/j.solidstatesciences.2004.07.003.
- ↑ Jeroen Kuipers, Ben N. G. Giepmans: Neodymium as an alternative contrast for uranium in electron microscopy. In: Histochemistry and Cell Biology. Band 153, Nr. 4, 2020, S. 271–277, doi:10.1007/s00418-020-01846-0, PMID 32008069, PMC 7160090 (freier Volltext).

![{\displaystyle {\mathsf {\ \!\ {\Biggr ]}_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c1612a700092b47771b120bfd06c71bf7852a77)
