Nozaki-Hiyama-Kishi-Reaktion
Die Nozaki-Hiyama-Kishi-Reaktion ist eine Nickel-katalysierte Chrom-vermittelte Kupplungsreaktion. Dabei wird aus einem Aldehyd unter Umsetzung mit Allyl- oder Vinylhalogeniden ein sekundärer Allyl- oder Vinylalkohol gebildet. Auch Alkinylhalogenide können verwendet werden, wobei Propargylalkoholeentstehen.[1] Die Reaktion wurde als erstes von Tamejiro Hiyama und Hitoshi Nozaki im Jahre 1977 veröffentlicht. Sie ist zusätzlich nach Yoshito Kishi benannt. Dabei wurde eine Chrom(II)-Salzlösung mit Benzaldehyd und Allylchlorid umgesetzt.[2]

Wenn man diese Reaktion mit einer Grignard-Reaktion oder der Addition von Lithiumorganylen vergleicht ist sie, bedingt durch die relativ schwächere Nucleophilie des Chrom-Organyls, sehr viel selektiver und es werden funktionelle Gruppen wie Ketone, Ester, Amide und Nitrile toleriert. Jedoch ist das Chrom-Organyl im Sinne von HSAB hart genug, um mit α,β-ungesättigten Aldehyden eine 1,2-Addition einzugehen. Als Lösungsmittel werden DMF und DMSO benutzt, da diese die Chromsalze gut lösen.
Nickel(II)-Salze als Katalysator
[Bearbeiten | Quelltext bearbeiten]Im Jahre 1983 wurde von den gleichen Autoren beobachtet, dass Vinylhalogenide, Vinyltriflate und Arylhalogenide unter ähnlichen Bedingungen reagieren.[3] 1986 wurde dann festgestellt, dass katalytische Mengen Nickel(II)-chlorid die Reaktion beschleunigt.[4]
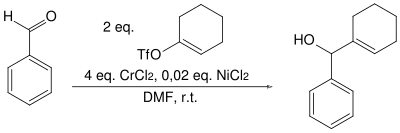
Unabhängig davon kam Yoshito Kishi im gleichen Jahr im Rahmen der Palytoxin-Totalsynthese zum gleichen Ergebnis.[5]
Palladiumacetat zeigte ebenfalls gute katalytische Aktivität in dieser Reaktion.
Reaktionsmechanismus
[Bearbeiten | Quelltext bearbeiten]Nickel wird zunächst durch das Chrom(II) zum Element reduziert, wobei das Chrom in die Oxidationsstufe +III oxidiert wird. Danach folgt eine oxidative Addition von Nickel in die Kohlenstoff-Halogen-Bindung zu einer Grignard-artigen Verbindung. Nach einer Ummetallierung durch Chrom(III) entsteht ein Nucleophil, welches den Aldehyd angreifen kann.
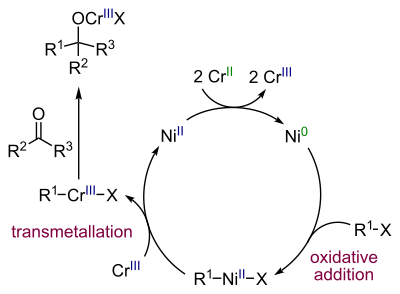
Bei der Reaktion muss die Menge an Nickelkatalysator gering gehalten werden, um Nebenreaktionen zu vermeiden.[6]
Ähnliche Reaktionen sind zum Beispiel die Grignard-Reaktion (Magnesium), die Barbier-Reaktion (Zink) oder Reaktionen mit Organolithium-Reagentien.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Antony A. Okumu, Craig J. Forsyth: Synthesis of the C1–C19 Domain of Azaspiracid-34. In: Organic Letters. Band 21, Nr. 2, 18. Januar 2019, S. 356–359, doi:10.1021/acs.orglett.8b03451.
- ↑ Y. Okude, S. Hirano, T. Hiyama, H. Nozaki: In Grignard-type carbonyl addition of allyl halides by means of chromous salt. A chemospecific synthesis of homoallyl alcohols, in: J. Am. Chem. Soc. 1977, 99, 3179–3181.
- ↑ K. Takai, K. Kimura, T. Kuroda, T. Hiyama, H. Nozaki: Selective grignard-type carbonyl addition of alkenyl halides mediated by chromium(II) chloride, in: Tetrahedron Lett. 1983, 24, 5281–5284.
- ↑ K. Takai, M. Tagashira, T. Kuroda, K. Oshima, K. Utimoto, H. Nozaki: Reactions of alkenylchromium reagents prepared from alkenyl trifluoromethanesulfonates (triflates) with chromium(II) chloride under nickel catalysis, in: J. Am. Chem. Soc. 1986, 108, 6048–6050.
- ↑ H. Jin, J. Uenishi, W. J. Christ, Y. Kishi: Catalytic effect of nickel(II) chloride and palladium(II) acetate on chromium(II)-mediated coupling reaction of iodo olefins with aldehydes, in: J. Am. Chem. Soc. 1986, 108, 5644–5646.
- ↑ K. Takai, K. Sakogawa, Y. Kataoka, K. Oshima, K. Utimoto: Preparation and Reaction of Alkenylchromium Reagents: 2-Hexyl-5-phenyl-1-penten-3-ol In: Organic Syntheses. 72, 1995, S. 180, doi:10.15227/orgsyn.072.0180; Coll. Vol. 9, 1998, S. 472–477 (PDF).