Vitamin K
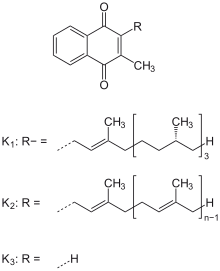
Vitamin K1 = Phyllochinon.
Vitamin K2 = Menachinon-n.
Vitamin K3 = Menadion
K-Vitamine (K für Koagulation) gehören neben den Vitaminen A, D und E zu den fettlöslichen Vitaminen und werden unter dem Sammelbegriff Vitamin K zusammengefasst. Das gemeinsame Grundgerüst der K-Vitamine ist eine 2-Methyl-1,4-naphthochinon-Struktur (Menadion). Sie sind ein Kofaktor in Reaktionen der γ-Glutamylcarboxylase. Über diesen Mechanismus werden mehrere Gerinnungsfaktoren in einen aktivierbaren Zustand versetzt und gerinnungshemmende Faktoren aktiviert und reguliert.
Ferner spielen K-Vitamine für die Aktivierung von Osteocalcin (ein Knochenprotein), Calbindin und der Liganden für einige Rezeptor-Tyrosinkinasen wie zum Beispiel das Growth-arrest-specific gene-6 eine wichtige Rolle für das Zellwachstum.
In Pflanzen ist Vitamin K1 für die Photosynthese unverzichtbar.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Der Entdeckung des Vitamins gingen Beobachtungen von Landwirten voraus: Nachdem Hausrinder mit verdorbenem oder siliertem Süßklee gefüttert wurden, zeigten sie schwere Blutungen mit tödlichem Ausgang (sogenanntes „sweet clover poisoning“).[1] Dies dokumentierte 1922 der kanadische Tierarzt Frank W. Schofield vom Ontario Veterinary College und erkannte den Einfluss des im Süßklee enthaltenen Cumarins (Cumarin ist ein Vitamin K-Antagonist).[2]
Die Existenz eines „Vitamins K“ (Koagulationsvitamin, antihämorrhagisches Vitamin) wurde durch den dänischen Forscher Henrik Dam postuliert. Bei Untersuchungen zur Cholesterinsynthese von Küken war ihm 1929 aufgefallen, dass es bei diesen durch die dabei verabreichte besondere cholesterinfreie Diät nach mehr als zwei bis drei Wochen zu Blutungen unter der Haut sowie in Muskeln und anderen Organen kam. Zudem standen diese Symptome mit einem geringen Gehalt des Blutgerinnungsfaktors Prothrombin (Faktor II) in Verbindung.[1] Dass diese Erscheinungen durch einen Mangel an den damals bekannten Vitaminen (z. B. A, D oder B1) selbst entstünden, konnte er mit seinen Arbeiten ausschließen.
1931 berichteten die kanadischen Forscher William McFarlane, William Graham Jr. und Frederick Richardson[3] am Ontario Agricultural College anlässlich Untersuchungen zum Vitamin-A- und -D-Bedarf von Hühnern über Blutungen und einer verzögerten Blutgerinnung, nachdem sie diese an den Flügeln markiert hatten. Diese Beobachtung wurde jedoch zunächst nicht weiter untersucht.[4][5] 1933 fanden die US-amerikanischen Forscher Walther Holst und Everett Halbrook[6] an der University of California heraus, dass diese Blutungsneigung bei Küken durch Verfüttern von frischem Kohl verhindert werden konnte, führten dies aber fälschlicherweise auf einen Mangel an Vitamin C zurück.[4]
Nachdem bald darauf auch reines Vitamin C zur Verfügung stand, verabreichte Dam den Hühnern dieses parenteral, um noch auszuschließen, dass eine beeinträchtigte Resorption aus dem Verdauungstrakt (als Folge einer durch die Diät gestörten Darmfunktion) für die Blutungen verantwortlich gemacht werden könne. Und nachdem die Verfütterung von Weizenkeimöl keinen Schutz bot, andererseits die Verabreichung von Getreidekörnern und Samen die Gerinnungsstörung verhinderte, fühlte er sich 1934 berechtigt, den Mangel einer bestimmten, wenn auch noch unbekannten Substanz in der Nahrung für die beobachteten Probleme verantwortlich zu machen. Zudem konnte er Hämorrhagien bei Hühnern durch die Gabe eines Etherextraktes aus Luzernen behandeln.[1]
Weitere Fütterungsversuche folgten und 1935 wurde diese Substanzgruppe schließlich als ein essentielles Vitamin mit lipophilen Eigenschaften erkannt. Der Buchstabe K wurde ursprünglich der Einfachheit halber gewählt, weil das Fehlen dieser Substanz eine ausreichende Ko-agulationfähigkeit (Gerinnung) des Blutes behinderte.[5] Zudem waren die vorausgehenden Buchstaben bereits durch anderen Vitamine vergeben. Die Reinigung und chemische Synthese von Vitamin K1 wurde 1939 durch die Arbeiten von Herman J. Almquist und Klose an der University of California in Berkeley, Louis F. Fieser & Kollegen an der Harvard University sowie insbesondere die Strukturbestimmung durch die Arbeitsgruppe um Edward Adelbert Doisy erreicht.[7] 1943 erhielten Dam für die Entdeckung sowie Doisy für die Entdeckung der chemischen Natur dieser Vitamingruppe gemeinsam den Nobelpreis für Medizin.[8]
Die genaue biochemische Funktion des Vitamin K wurde schließlich Ende der 1970er Jahre aufgeklärt.[9]
Vertreter
[Bearbeiten | Quelltext bearbeiten]Bei Vitamin-K handelt es sich um fettlösliche Substanzen, sogenannte Vitamere. Allen gemeinsam ist das Grundgerüst 2-Methyl-1,4-Naphthochinon (Menadion), das an der C3-Position unterschiedlich substituiert ist.[10] Voraussetzungen für die Vitamin-K-Aktivität sind neben dem unsubstituierten, aromatischen Ring die Methylgruppe; die lipophile Seitenkette (die je nach K-Vitamin unterschiedlich lang sein kann) bestimmt die Fettlöslichkeit und andere Eigenschaften.[11] Optimal sind natürliche Terpenketten mit 20 Kohlenstoffatomen. Seitenketten unter 8 Kohlenstoffatomen führen außer bei Menadion zur Inaktivität.
Von Bedeutung im (menschlichen) Stoffwechsel sind nur das Vitamin K1 und K2.

- Vitamin K1 bzw. Phyllochinon kommt in unterschiedlichen Konzentrationen in den Chloroplasten der Grünpflanzen als normaler struktureller und funktioneller Bestandteil des Photosyntheseapparates (Photosystem I) vor und zum Teil in deren Früchten. Zudem können es auch Algen und manche Cyanobakterien synthetisieren.[7] Es ist das wichtigste natürlich vorkommende K-Vitamin und macht 75-90 % des durch die Nahrung aufgenommenen Vitamin K aus.[12] Jedoch zeigt es eine geringe Bioverfügbarkeit. Vitamin K1 enthält eine Phythlykette von 20 Kohlenstoffatomen.

- Vitamin K2 bzw. Menachinon wird von Bakterien (z. B. von auch im Darm vorkommenden Stämmen wie von Escherichia coli oder Bacteroides fragilis) und einigen Archaeen produziert.[7] Vitamin K2 bildet eine Gruppe von Menachinonen unterschiedlicher Länge ihrer mehrfach ungesättigter Isoprenoid-Seitenkette; sie werden als MK-n bezeichnet. Hierbei steht n für die Anzahl der Isoprenoid-Einheiten (n=4 bis 13).[12] Die meisten Bakterien bilden Menchinone mit mittellanger bis langer Seitenketten (MK-6 aufwärts).[10] Wichtigste Vertreter der Vitamin K2-Gruppe sind MK-7 (ehemalige Bezeichnung Vitamin K35) sowie MK-4. Letzteres wird aber nicht von Mikroorganismen synthetisiert, stattdessen ist es eine ursprünglich aus Vitamin K1 metabolisierte Verbindung.[7]
- Vitamin K3 bzw. Menadion ist eine synthetisch hergestellte Substanz ohne Seitenkette (diese wird vom menschlichen Organismus nach der Aufnahme ergänzt). Das wasserunlösliche Vitamin K3 wurde früher in Form des wasserlöslichen Hydrogensulfit-Addukts als künstliches „Provitamin K“ angewandt.
- In der Literatur werden ferner noch weitere synthetische K-Vitamine (K4, K5, K6,...) erwähnt. So wird z. B. entweder 2-Methyl-1,4-naphthohydrochinon (Menadiol)[13][14] oder dessen Ester wie Menadioldiacetat (Acetomenaphthon) als Vitamin K4 bezeichnet.[15][16]
Resorption und Stoffwechsel
[Bearbeiten | Quelltext bearbeiten]Aufgrund der Hitzestabilität der Vitamin-K-Gruppe treten beim Zubereiten, insbesondere beim Garen nur wenig Vitaminverluste auf. Der Vitamin K1-Gehalt von Lebensmitteln, auch Speiseölen, wird größtenteils weder durch Erhitzen in einer Mikrowelle, noch durch Kochen beeinträchtigt.[12] Vitamin K ist auch gegenüber Sauerstoff stabil.[1] Unter Einstrahlung von Sonnen- oder UV-Licht kommt es zu starken Verlusten an Vitamin K1 (46 % bzw. 87 % nach zwei Tagen), weswegen eine Lagerung im Dunkeln empfohlen wird.[12]
Alle natürlich vorkommenden (fettlöslichen) Vitamin K-Formen sind in Alkohol wenig, in Wasser unlöslich.[1] Das mit der Nahrung aufgenommene Vitamin K wird unter Mitwirkung von Gallensäure und Pankreaslipase als Emulgatoren in gemischte Mizellen überführt, was eine funktionierende Bauchspeicheldrüse voraussetzt.[10] Diese werden durch aktiven Transport in die Enterozyten des proximalen Ileums aufgenommen.[17] Vitamin K2 gelangt dagegen durch Diffusion in das Darmgewebe.[11]
Hierbei verbessern die in der Nahrung befindlichen Öle und Fette die Aufnahme. 3 bis 50 % des verzehrten Vitamin K1 werden aufgenommen, bei MK-7 liegt die Aufnahme höher.[17] Die Aufnahme von in der Nahrung enthaltenem Vitamin K2 (gerade längerkettige Menachinone) ist hoch, wenn nicht sogar durch die Anwesenheit anderer Fette vollständig.[12] Ferner ist die Bioverfügbarkeit reinen Vitamin K1 besser als im Vergleich zu reinen MK-4 oder MK-9, aber geringer als bei reinem MK-7. Dies liegt daran, dass in der Nahrung vorkommendes Vitamin K1 fest im Pflanzengewebe gebunden ist. Es gibt jedoch keinen Unterschied in der Bioverfügbarkeit von Vitamin K1 verschiedener Nahrungsmittel, auch die Zubereitung wie Kochen verbessert diese nicht. (Pflanzen-)Fette können jedoch diese um den Faktor 3 erhöhen. Außerdem hängt der Grad der Aufnahme vom jeweiligen Individuum ab. Die Aufnahme von Vitamin K wird ferner durch bestimmte Medikamente beeinflusst: Cholestyramin und Rifampicin senken die Absorption.[12] Bei Orlistat sollen Patienten den Fettgehalt ihrer Diät reduzieren, um gewissen Nebenwirkungen zu vermeiden, was sich indirekt auf die Vitamin K-Aufnahme negativ auswirkt.
Von den Enterozyten wird Vitamin K1, an Chylomikronen gebunden, über die Lymphe in die Vena cava inferior transferiert und gelangt damit schließlich in die Gewebe, in denen es verwendet wird (insbesondere in Form von Chylomikronenresten in die Leber).[17][12] Hier kann eine Speicherung bis zu 14 Tagen erfolgen. Vitamin K2 wird in VLDL/LDL-Partikel transportiert. In allen Fällen wird die zelluläre Aufnahme von Vitamin K durch Lipoprotein-Rezeptoren vermittelt.
Im Blut hat MK-7 eine Halbwertszeit von 72 Stunden, MK-9 etwa 60 Stunden, bei Vitamin K1 beträgt diese 1–2 Stunden, ähnlich kurz ist die von MK-4.[12] Im Serum ist die Konzentration von Vitamin K1, MK-4, MK-5, MK-6 und MK-8 niedrig (nanomolarer Bereich).[12] Durch den hohen Konsum von Nattō liegt die Serumkonzentration von MK-7 bei Japanern etwa bei 16 nM, während diese bei Europäern unter 1 nM liegt. Im Körper befinden sich etwa 0,55 mg/kg Körpergewicht Vitamin K1, bei Vitamin K2 wurde dieser Wert nicht bestimmt.
Im Nabelschnurblut findet sich kein Vitamin K, es wird kaum diaplazentar übertragen. Der fetale Vitamin-K-Vorrat in der Leber beträgt ein Fünftel dessen eines älteren Kindes oder eines Erwachsenen.
Die K-Vitamine werden – nachdem ihre Seitenkette verkürzt wird – glucuronidiert gleichermaßen via Galle über den Stuhl und über die Nieren in den Urin wieder ausgeschieden.[17] Der Abbau wird hierbei durch eine ω-Oxidation der Seitenkette initiiert, weitere β-Oxidationen kürzen anschließend die Seitenkette.
Funktionen beim Menschen
[Bearbeiten | Quelltext bearbeiten]Die wesentliche Bedeutung von Vitamin K liegt in seinem Beitrag zur posttranslationalen Einführung einer Carboxygruppe in die γ-Position (endständige Position) von Glutamylresten verschiedener Proteine, wodurch diese aktiviert werden.[10][12] Es sind mindestens 19 Proteine mit geringer Masse (5–10 kDa) bekannt, die über eine γ-Carboxy-Glutaminsäure (Gla) verfügen und für deren Synthese daher Vitamin K notwendig ist.[17] Davon sind u. a. sieben Proteine mit dem Blut-Gerinnungssystem verbunden. Diese Proteine werden auch als Vitamin K-abhängige Proteine (VKDP) bzw. Gla-Proteine bezeichnet.[17] Allen gemeinsam ist die Fähigkeit, dass die Gla-Reste nach ihrer Carboxylierung Komplexe mit Calciumionen bilden.
Für Vitamin K2 ist inzwischen eine essenzielle Funktion als Elektronentransporter in den Mitochondrien nachgewiesen.[18]
Vitamin-K-Zyklus
[Bearbeiten | Quelltext bearbeiten]
Im rauen endoplasmatischen Retikulum wird Vitamin-K (chemisch als Chinon vorliegend) zu seiner biologisch aktiven Form, dem Vitamin-K-Hydrochinon (auch: Vitamin KH2) reduziert. KH2 dient bei der γ-Carboxylierungsreaktion als Kofaktor der γ-Glutamylcarboxylase (GGCX) und wird zu einem Vitamin-K-2,3-Epoxid umgewandelt, während die Glutaminsäure (Glu) des Proteins mittels CO2 und Energie aus ATP zur γ-Carboxy-Glutaminsäure (Gla) carboxyliert wird.
γ-Carboxy-Glutaminsäure ist eine nicht-kanonische Aminosäure, sie besitzt als funktionelle Gruppe eine Malonsäurestruktur. Malonsäure ist eine Dicarbonsäure, ihre beiden Carboxylgruppen besitzen gerade den Abstand zueinander, dass sie mit Ca2+ Chelatkomplexe bilden können.[19] Diese Chelat-Bildungs-Fähigkeit ist Voraussetzung der Blutgerinnung. Die beiden endständigen Carboxygruppen von Gla ermöglichen daher die Chelatbildung von Calciumionen und daher die biologische Funktion jener Proteine.[17]
Das Epoxid des Vitamin K wird anschließend mittels einer membranständigen Vitamin-K-Epoxid-Reduktase (VKORC1) zum Chinon des Vitamin K zurückverwandelt und der Zyklus kann von Neuem beginnen. Durch diese Wiederverwertung ist der physiologische Bedarf an Vitamin K vergleichsweise gering.
Proteine, die durch den Vitamin K-Zyklus carboxyliert werden, besitzen eine 18 aminosäurelange homologe Sequenz, die sich unmittelbar upstream der carboxylierten Proteindomäne befindet.[12] Diese Domäne bindet die GGCX. Nach der Carboxylierung werden die Proteine wahrscheinlich durch den sekretorischen Weg via den Golgi-Apparat aus der Zelle transportiert. Dabei erfolgt meistens ein Abschneiden der Prosequenz (z. B. bei Prothrombin durch Ca2+-abhängige Serinprotease), um das aktive Protein zu erhalten. Bei manchen Proteinen verbleibt aber diese Prosequenz, z. B. beim Matrix-Gla-Protein (MGP). Zudem beeinflusst der Grad der Carboxylierung die anschließende Sekretion – bei den Gerinnungsfaktoren II (Prothrombin) sowie X (Stuart-Prower-Faktor) kann dies auch im uncarboxylierten Zustand passieren, während dies bei Protein C und Z ausschließlich in carboxylierter Form geschieht.[12]
Die biologische Aktivität von Vitamin K ist also auf seine Fähigkeit zurückzuführen, zwischen seinen oxidierten (Chinon) und reduzierten (Hydrochinon) Formen im Vitamin-K-Zyklus zu wechseln. Die Aktivität der Vitamere unterscheidet sich aber in Bezug auf die Carboxylierung.[12] Während Vitamin K3 keine solche aufweist, ist Vitamin K1 weniger aktiv als MK-4; und je mehr Isoprenoid-Einheiten der Seitenkette vorliegen, desto geringer wird diese. Bei der Vitamin K-abhängigen Synthese von Gerinnungsfaktoren ist MK-7 aktiver als K1.
Die Epoxidreduktase und die Vitamin-K-Reduktase können durch die gerinnungshemmenden Medikamente Dicoumarol, Marcumar und Warfarin inhibiert werden. Fehlt Vitamin K oder wird es durch einen Antagonisten blockiert, kann es zwar als Chinon zu KH2 durch eine cytosolische NAD(P)H-abhängige Oxidoreduktase bzw. NAD(P)H-Dehydrogenase reduziert werden.[12] Jedoch gerät der Zyklus danach ins Stocken, da das Epoxid nicht Substrat für dieses Enzym ist.
Das Allel des Apolipoproteins E2 scheint ein Risikofaktor für die Entwicklung eines Vitamin-K-Mangels zu sein.[20]
Blutgerinnung
[Bearbeiten | Quelltext bearbeiten]Vitamin K ist daran beteiligt, die Gerinnungsfaktoren II (Prothrombin), VII (Proconvertin), IX (Christmas-Faktor) und X (Stuart-Prower-Faktor) in ihre gerinnungswirksamen Formen zu überführen. Dies passiert auch bei den gerinnungshemmenden Protein C, S und Z, die als Vorstufen in der Leber und in den Endothelzellen synthetisiert werden.[10] In allen Fällen ermöglicht die Carboxylierung das Binden von Calciumionen an den Carboxyglutamatresten (Gla), wodurch es zu einer Konformationsänderung kommt. Dadurch wird die Phospholipid-bindende Domäne exponiert, und die Proteine werden an den Phospholipidmembranen von Thrombozyten verankert.[12] Dort formen sie membrangebundene Komplexe mit anderen Gerinnungsfaktoren.[10] Die Vitamin K-abhängige Carboxylierung ist ein essentieller Schritt für ihre biochemische Aktivität im Gerinnungssystem.
Gerinnungshemmende Arzneistoffe der Cumarin-Gruppe wie Phenprocoumon oder Warfarin können durch vergleichsweise kleine Mengen Vitamin K (1 mg) in ihrer Wirkung aufgehoben werden; sind sie im Einsatz, darf kein Vitamin K zusätzlich zur normalen Nahrung gegeben werden.
Knochenstoffwechsel
[Bearbeiten | Quelltext bearbeiten]Für die Knochenmineralisation ist Osteocalcin (OC) beteiligt, das größtenteils in Osteoblasten synthetisiert wird. Durch Vitamin K werden drei Glu-Reste carboxyliert, die Signalsequenz wird durch Peptidasen abgespalten.[12] Das prozessierte OC wird dann in die Knochenmatrix ausgeschieden und hat – analog den Gerinnungsfaktoren – eine hohe Affinität zu Calciumionen. Diese kommen im Hydroxylapatit vor, so dass das Protein daran bindet. Ursprünglich dachte man, dass carboxyliertes Osteocalcin die Bildung von Hydroxyapatit initiieren würde; stattdessen reguliert es dessen Größe und die Anordnung der Apatitkristalle in den Kollagenfasern. Dies hat Einfluss auf die Knochendichte und die Schutzwirkung gegenüber Knochenbrüchen. Während der Knochenresorption fällt der pH-Wert in den Knochen, was in einer Decarboxylierung von Osteocalcin und dessen Freisetzung resultiert. Unter- bzw. decarboxyliertes Osteocalcin (ucOC) gilt als Hormon, es gibt Hinweise darauf, dass es die Freisetzung von Insulin (was die Knochenresorption stimuliert) bewirkt.[12] Darüber hinaus dient es als Marker für die Knochenqualität, bei Knochenbrüchen sind dessen Werte erhöht. Eine Supplementation von Vitamin K senkt die Serumwerte und beeinflusst das Verhältnis von ucOC zum Gesamtgehalt von OC. Dadurch eignet es sich zur Bestimmung des Vitamin K-Spiegels (vgl. Abschnitt Nachweismethoden und Statusbestimmung).
Während der Nurses’ Health Study, einer Studie mit über 72.000 Probandinnen, wurde gezeigt, dass Vitamin K1 einen wesentlichen Einfluss auf das Osteoporoserisiko hat.[21] Die Gruppe, die am wenigsten Vitamin K1 zu sich nahm, hatte ein um ca. 42 % erhöhtes Risiko für Hüftknochenbrüche (verursacht durch Osteoporose). Interessanterweise zeigte sich außerdem, dass Probanden mit höherer Vitamin-D-Einnahme bei gleichzeitiger geringer Vitamin-K-Einnahme ein erhöhtes Knochenbruch-Risiko aufwiesen. Aufgrund dieser und anderer Studien hat die Europäische Behörde für Lebensmittelsicherheit (EFSA) ein positives Gutachten erstellt – damit ist eine gesundheitsbezogene Aussage („Vitamin K trägt zur Erhaltung normaler Knochen“) erlaubt.[22][23] Im Gutachten der EFSA ist eine ausreichende Vitamin-K-Aufnahme durch eine ausgewogene Ernährung gewährleistet.
Vitamin K1 und K2 wurden in verschiedenen klinischen Studien auf ihre Wirksamkeit in der Osteoporoseprophylaxe und -therapie getestet: Frauen nach der Menopause gelten als wichtige Risikogruppe für eine Osteoporose. Nach Auswertung verschiedener Studien hat eine Vitamin-K-Supplementation keinen Effekt, das Risiko von Wirbelbrüchen zu senken.[23] Bezüglich Brüchen an anderen Knochen zeigte sich allenfalls ein kleiner Nutzen, der aber bei Studien mit guter Qualität nicht mehr zum Vorschein kommt.[23] Daher ist wegen fehlender wissenschaftlicher Belege das Bewerben mit einer Schutzwirkung vor Osteoporose nicht zulässig.[24]
Zellwachstumsregulierung
[Bearbeiten | Quelltext bearbeiten]Es existiert eine Reihe von Vitamin-K-abhängigen Rezeptor-Ligand-Systemen, die am Zellmetabolismus, dem Zellüberleben, ihren Transformationen und ihren Replikationen beteiligt sind. Hierzu gehören das Gas6, ein Vitamin-K-abhängiges Protein, welches als Ligand an verschiedene Rezeptor-Tyrosinkinasen bindet und diese aktiviert.[25] Eine Überexpression von Gas6 wurden in verschiedenen Krebszellen beobachtet.[12] Zudem hat man bei Krebszellen von Brust- und Hauttumoren einen veränderten Carboxylierungsgrad Gla-reicher Proteine (Gla-rich proteins, GRP) gefunden; der Carboxylierungsgrad wird durch Vitamin K vermittelt.[26][27]
Ob Vitamin K eine Rolle bei der Prävention von Krebserkrankungen hat, ist Gegenstand der Forschung. Die Datenlage aus Interventionsstudien ist nicht ausreichend, um daraus Schlüsse zu ziehen.[28][26] Beobachtungsstudien geben ein uneinheitliches Bild.[12] Eine längerfristige Einnahme von Vitamin K-Antagonisten im Rahmen einer Antikoagulationstherapie war mit einem reduzierten Krebsauftreten assoziiert[29]; speziell bei Prostatakrebs gibt es aber divergierende Reviews.[30][31]
Gefäßverkalkung
[Bearbeiten | Quelltext bearbeiten]Es wird vermutet, dass auch der Prozess der Gefäßverkalkung durch Proteine mit γ-carboxylierten Glutaminsäureresten („Gla-Proteine“) gesteuert ist. Verkalkungen großer Arterien kommen vor allem bei älteren Menschen mit Osteoporose vor, die einen wenig gesättigten Vitamin-K-Status haben. Es wird daher spekuliert, dass Vitamin K vor „Arterienverkalkung“ schützt.[32]
Vitamin K2 ist wichtig für ein gesundes Herz-Kreislauf-System: Die Rotterdam-Herz-Studie zeigte, dass Menschen, die sich über einen zehnjährigen Beobachtungszeitraum von Nahrungsmitteln mit hohem Anteil an natürlichem Vitamin K2 (mindestens 32 µg täglich) ernährten, deutlich weniger Calciumablagerungen in den Arterien und eine weit bessere Herz-Kreislauf-Gesundheit aufwiesen als andere. Das Ergebnis der Studie ist, dass Vitamin K2 das Risiko, eine Gefäßverkalkung zu entwickeln oder an einer Herz-Kreislauf-Erkrankung zu sterben, um 50 % reduziert.[33] Eine weitere Studie zeigte, dass Vitamin K2 die Kalzifikation nicht nur verhindern, sondern sogar umkehren kann: In der Studie wurde Ratten der Vitamin-K-Antagonist Warfarin verabreicht, um eine Verkalkung der Arterien herbeizuführen. Ein Teil der Ratten erhielt danach Vitamin-K2-haltiges Futter, während die anderen mit normaler Nahrung gefüttert wurden. Das Vitamin K2 führte bei den Tieren zu einer Reduktion des Calciumgehalts in den Arterien um 50 %.[34]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]In Nahrungsmitteln kommt Vitamin K vor allem in Form von Phyllochinon (Vitamin K1) vor; es findet sich in allen grünen und damit photosynthetisch aktiven Pflanzen(teilen), z. B. Spinat, Blattsalat und andere Salatarten, Gemüsekohl, Petersilie oder Avocado.[10] Daneben enthalten Kernöle und andere Öle Vitamin K1.
Menaquinon (Vitamin K2) ist v. a. in tierischen Produkten enthalten, gerade die Leber enthält viel MK-4, MK-9 und MK-11. In Fleisch (Huhn) und Fleischprodukten kommt hauptsächlich MK-4 vor.[10] Zudem findet es sich in (Frisch-)Käse oder Quark. Dies liegt daran, dass zur Fermentation dieser Milchprodukte Bakterien zugegeben werden, die hauptsächlich MK-8 (Laktobazillen) bzw. MK-9 (Propionibakterien) erzeugen.[17] Die größte Quelle an Vitamin K2 stellt das japanische Nattō dar.[17][10] Bei Eiern tritt insbesondere MK-4 auf, ferner findet sich Vitamin K2 in Schokolade, Brot oder Gewürzen.
Zwar vermag das Mikrobiom des Darmes MK-8 (Enterobakterien), MK-10 und MK-11 (Bacteroides) zu bilden, aber dieses wird kaum aufgenommen.[17] Dies liegt an den im Darm fehlenden Lipasen und Gallensäuren.
Wichtig ist, dass das Vitamin K kaum diaplazentar übertragen wird und das Neugeborene auch mit der Muttermilch wenig Vitamin K erhält. Entgegen der weitverbreiteten Meinung, dass das Kolostrum im Vergleich zur Muttermilch viel Vitamin K enthalte, konnte in einer Studie gezeigt werden, dass es praktisch keine Unterschiede im Vitamin-K-Gehalt von Muttermilch und Kolostrum gibt. Der Vitamin-K-Gehalt der Muttermilch hängt von der Nahrungszufuhr der Mutter ab und liegt bei etwa 3 µg/l.[35]
Bedarf
[Bearbeiten | Quelltext bearbeiten]Die EFSA gibt als empfohlene Tagesdosis (Adequate Intake) für alle Alters- und Geschlechtsgruppen eine Aufnahmemenge von 1 µg/kg Körpergewicht Phyllochinon an.[36] Sie differenziert hierbei aber nicht weiter zwischen der Aufnahme von Vitamin K1 und K2. Anhand Referenzkörpergewichte empfiehlt die EFSA Säuglingen zwischen 7 und 11 Monaten täglich etwa 10 µg Vitamin K, bei Personen über 18 Jahren etwa 70 µg. Anfang des Jahres 2017 wurde diese bereits im Jahre 1993 formulierte Zufuhrempfehlung erneut bestätigt.
Das Bundesinstitut für Risikobewertung (BfR) gibt ähnliche Werte für die D-A-CH-Region an. Die tägliche Aufnahme steigert sich mit dem Alter: Kinder unter 7 Jahren sollen 20 µg pro Tag, von 7 bis unter 10 Jahren 30 µg pro Tag, von 10 bis unter 13 Jahren 40 µg pro Tag und von 13 bis unter 15 Jahren 50 µg pro Tag einnehmen. Danach unterscheidet sie bei Jugendlichen und Erwachsenen nach Geschlecht. So werden von 15 bis 51 Jahren 70 µg (Männer) bzw. 60 µg (Frauen) empfohlen. Im Alter erhöht sich weiter der Bedarf: Bei ab 65-Jährigen liegt die Tagesempfehlung bei 80 µg (Männer) bzw. 65 µg (Frauen). Schwangere und Stillende sollen 60 µg täglich einnehmen.
Eine Tagesverzehrempfehlung von Vitamin K1 und K2 in Nahrungsergänzungsmitteln wird durch das BfR von maximal 80 µg bzw. 25 µg angegeben.[36] Zudem sollen Personen, die gerinnungshemmende Medikamente (vom Cumarintyp) einnehmen, vor dem Verzehr von Vitamin K-haltigen Nahrungsergänzungsmitteln ärztlichen Rat einholen.
Da Neugeborene dem (seltenen) Risiko eines klinisch relevanten Vitamin-K-Mangels mit der Gefahr gefährlicher Hirnblutungen ausgesetzt sind, wird eine Vitamin-K-Prophylaxe in den meisten Ländern der Welt so bald wie möglich nach der Geburt, also noch im Kreißsaal, dringend empfohlen.[37]
Nachweismethoden und Statusbestimmung
[Bearbeiten | Quelltext bearbeiten]Die genaue Bestimmung des Vitamin K-Status gelingt am besten durch Auswertung verschiedener Biomarker, auch in Kombination von Verzehrshäufigkeitsfragebögen (Abfrage Verzehrshäufigkeiten von Lebensmitteln über einen längeren Zeitraum).[17]
- Urintests (z. B. auf Menadion, Gla, oder 5C/7C-Metabolite der Vitamin K-Vitamere) sind zwar sensitiv, aber schwer zu implementieren, da sie Urinabnahmen über einen Zeitraum von 24 Stunden bedürfen.
- Die Bestimmung der Serumkonzentration von Phylloquinon eignet sich gut für die Bestimmung von Vitamin K eher größerer Populationsgruppen. Dies liegt daran, dass zwischen Individuen starke Schwankungen auftreten. Allgemein ist die Abnahme im nüchternen Zustand empfohlen, zudem soll der Messwert mit der Triglyceridkonzentration abgeglichen werden. Die Plasmakonzentration von Vitamin K1 wird je nach Nachweismethode mit 0,3–1 ng/ml Blut angegeben.[11]
- Als verlässlicher Marker gilt die Bestimmung dephosphorylierten, untercarboxylierten Matrix-Gla-Proteins (dp-ucMGP) mittels ELISA. Ungenügend carboxyliertes Osteocalcin (ucOC) ist ein relativ guter Marker für den Vitamin K-Status, was ebenfalls mittels ELISA bestimmt wird. ucOC wird entweder als Verhältnis von untercarboxylierten Osteocalcin zum Totalwert angegeben (% ucOC), oder als Verhältnis von untercarboxylierten zu carboxyliertem Osteocalcin (ucOC/cOC).
Nicht geeignet ist die Bestimmung untercarboxylierten bzw. ungenügend carboxylierten Prothrombins, da es stark von der Leberfunktion abhängt. Serumwerte von Menaquinon sind in der Regel zu niedrig für eine verlässliche Bestimmung mittels HPLC. Eine Ausnahme stellen Individuen dar, die viel Nattō konsumieren (z. B. in Japan). Empfohlen wird hier die Abnahme im nüchternen Zustand, zudem soll der Messwert mit der Triglyceridkonzentration abgeglichen werden.[17]
Mit dem Koller-Test (Änderung des Quickwertes nach einmaliger intravenöser Gabe von Vitamin K) kann festgestellt werden, ob eine Carboxylierungsstörung der Vitamin-K-abhängigen Gerinnungsproteine an einer mangelhaften Resorption von Vitamin K (Vitamin-K-Mangel in der Leber z. B. bei Cholestase) oder an einem Leberzellschaden mit einer Proteinsynthesestörung und daher an einer Verwertungsstörung für Vitamin K liegt.
Neuere analytische Verfahren ermöglichen die sichere qualitative und quantitative Bestimmung von Vitamin K, auch neben anderen lipophilen Vitaminen, nach angemessener Probenvorbereitung durch Kopplung der HPLC mit der Massenspektrometrie.[38][39][40][41] Die Verfahren eignen sich auch für die Analytik von Nahrungsmitteln.[42][43][44][45]
Mangelerscheinung (Hypovitaminosen)
[Bearbeiten | Quelltext bearbeiten]Insgesamt sind bei normaler Ernährung ernstere Hypovitaminosen und Avitaminosen selten (wenn man den Bedarf nicht nach den Erfordernissen einer Osteoporoseprophylaxe etc. bemisst, die wesentlich höhere Dosen erfordert). Es gibt jedoch einige Situationen, in denen sie sehr wohl auftreten können.
Medikamentöse Antikoagulation
[Bearbeiten | Quelltext bearbeiten]Cumarin-Derivate, die zur oralen Antikoagulation eingesetzt werden, sind Gegenspieler (Antagonisten) des Vitamin K und können bei Überdosierung zu lebensgefährlichen Blutungen aufgrund eines relativen Vitamin-K-Mangels führen. Dabei sind die Cumarin-Derivate Enzymhemmer vor allem der Vitamin-K-Epoxid-Reduktase (VKOR) und führen somit, trotz ausreichenden Vorhandenseins von Vitamin-K-Epoxid, zu einem Mangel an Vitamin-K-Hydrochinon, das für den Carboxylase-Schritt bei der Proteinbildung der Vitamin-K-abhängigen Proteine notwendig ist.
Da es Polymorphismen im VKORC1-Gen, das das VKOR-Enzym codiert, gibt, die unterschiedlich stark von Cumarin-Derivaten gehemmt werden, gibt es teilweise Schwierigkeiten, die korrekte Cumarin-Dosierung zu finden und Überlegungen, mittels eines Gentests VKOR-Polymorphismen vorab nachzuweisen. Ob dies allerdings tatsächlich zu einer besseren Dosierung und weniger Komplikationen führt, ist trotz dreier großer Studien unklar.[46]
Vitamin-K-Mangelblutung (VKMB) des Neugeborenen
[Bearbeiten | Quelltext bearbeiten]Die Serumkonzentration von Vitamin K1 ist bei Neugeborenen noch sehr gering, da es kaum plazentagängig ist.[37] Dadurch resultiert eine eingeschränkte Syntheseleistung von Vitamin-K-abhängigen Gerinnungsfaktoren bis zum Ende der Schwangerschaft. Im Vergleich zur Säuglingsnahrung ist die Vitamin-K1-Konzentration in Muttermilch gering (etwa 2,5 µg/l).[37] Bei Babynahrung wird zusätzlich mittels Vitamin K supplementiert. Daher haben gestillte Neugeborene ohne zusätzliche Vitamin-K-Prophylaxe ein Risiko, an einer Vitamin-K-Mangelblutungen (VKMB, Morbus haemorrhagicus neonatorum) zu erkranken. Erst ab dem 3. bis 4. Lebenstag erreichen die Serumkonzentrationen an Vitamin K1 diejenigen im Bereich eines Erwachsenen.[37]
Eine VKMB wird je nach Zeitpunkt der klinischen Symptomatik klassifiziert.[37] Eine frühe VKMB tritt innerhalb von 24 Stunden nach Geburt, die klassische VKMB zwischen dem 2. und 7. Lebenstag auf, bei beiden mit einer Wahrscheinlichkeit von 1:60–1:250 Neugeborenen[47] (insbesondere bei Müttern, die bestimmte Medikamente wie enzyminduzierende Antiepileptika, Cumarine oder Tuberkulostatika einnahmen). Die späte VKMB (2. bis zur 12. Lebenswoche) wird mit einer Wahrscheinlichkeit von 1:14.000–1:25.000 beobachtet.[47] In sehr schweren Fällen kann die VKMB zum Tode führen (z. B. durch plötzliche Hirnblutungen).[48] Insbesondere Neugeborene mit einer Leber- oder Gallenkrankheit, Frühgeborene oder fehlernährte Säuglinge haben ein hohes Risiko, da diese das wenige Vitamin K, das angeboten wird, nicht richtig resorbieren und verwerten können. Die Blutungen treten in der Regel in den ersten zwölf Wochen auf.[49]
Zur Vermeidung gerade von lebensbedrohlichen Blutungen durch Vitamin-K-Mangel wird eine Supplementation kurz nach der Geburt empfohlen. Weltweit wird dies unterschiedlich gehandhabt: Entweder dosiert man 1 mg Vitamin K intramuskulär (z. B. Australien, USA[47]), 3 × 2 mg Vitamin K1 oral postnatal (U1), zwischen dem 3. und dem 10. Lebenstag (U2) und zwischen der 4. und der 6. Lebenswoche (U3) (z. B. in Deutschland, Schweiz)[37] oder 1 mg nach der Geburt oral und anschließend täglich 150 µg bis zur 12. Woche (Niederlanden[50]). Das Risiko für eine späte Vitamin-K-Mangelblutung kann so auf 0:100.000 bzw. 0,44:100.000 reduziert werden.[51][52] In Deutschland wird eine einmalige i. m. Gabe von 1 mg Vitamin K rasch nach der Geburt wirksamer als die orale Gabe betrachtet.[37]
Eine frühere Assoziation einer intramuskulär verabreichten Vitamin-K-Dosis bei Neugeborenen und einer späteren Leukämieerkrankung konnte nicht mehr bestätigt werden.[37]
Fehlernährung
[Bearbeiten | Quelltext bearbeiten]Auch durch eine Vitamin-K-arme Ernährung (z. B. durch langes Fasten) kann ein Mangel mit Störungen der Blutgerinnung auftreten. Dies ist jedoch sehr selten und kommt dann meistens als Mischform mit Mangelzuständen anderer Nährstoffe oder Vitamine vor. Auch können Mangelerscheinungen bei Dialysepatienten auftreten.[17]
Eine längere Vitamin-E-Überdosierung kann auch zu einem Vitamin K-Mangel führen.[17]
Resorptionsstörungen
[Bearbeiten | Quelltext bearbeiten]Ursache eines Vitamin-K Mangels kann eine verminderte Aufnahme von fettlöslichen Vitaminen, z. B. in Folge einer exokrinen Pankreasinsuffizienz sein.[53] Zudem können chronisch-entzündliche Darmerkrankungen wie Morbus Crohn zu einer verringerten Aufnahme (Malabsorption) von Vitamin K und damit zu einem Mangel führen.[17]
Überdosierungen (Hypervitaminosen)
[Bearbeiten | Quelltext bearbeiten]Oral verabreichtes Vitamin K zeigt eine geringe akute und chronische Toxizität, eine tolerierbare obere Einnahmemenge (Tolerable Upper Intake Level) wurde aufgrund unzureichender Daten nicht abgeleitet.[36]
Eine Hypervitaminose ist nicht bekannt, wenn man von der Substitutionsbehandlung beim Neugeborenen absieht: Hier kann Vitamin K in hohen Dosen eine Hämolyse auslösen, weil beim Neugeborenen der noch wenig entwickelte Glucuronidierungsmechanismus durch Vitamin K so sehr in Anspruch genommen wird, dass Bilirubin nicht mehr ausreichend glucuronidiert werden kann und somit eine Ausscheidungsstörung für Bilirubin auftritt (Neugeborenenikterus), der sich pathologisch ausweiten kann.[11] Dies betraf vor allem den Einsatz des Menadions in der Vitamin-K-Prophylaxe, welches vorübergehend eingesetzt wurde, weil es als wasserlösliches Provitamin sicherer resorbiert werden sollte. Eine intramuskuläre Gabe von 1 mg Vitamin K1 nach der Geburt führt zu einem 100-fach erhöhten Blutspiegel nach 4 Tagen.
Vitamin K schwächt aber die therapeutische Wirkung oraler Antikoagulanzien vom Cumarin-Typ (Vitamin-K-Antagonisten) ab.[36] Daher sollen Personen, die solche gerinnungshemmenden Medikamente einnehmen, ihre Vitamin K-Aufnahme aus Lebensmitteln möglichst konstant halten. Vor dem Verzehr Vitamin K-haltiger Nahrungsergänzungsmittel sollten sie zudem den Rat eines Arztes einholen.
Behandlung von Vergiftungen mit gerinnungshemmenden Rattengiften
[Bearbeiten | Quelltext bearbeiten]Zur Bekämpfung von Nagetieren greift man mittlerweile auf gerinnungshemmende Rodentizide der zweiten Generation zurück.[54] Diese enthalten Warfarin als Vitamin-K-Antagonisten (speziell die länger wirkenden und potenteren „Superwarfarine“) oder lang wirksame Antikoagulantien, z. B. Brodifacoum, Bromadiolon, Chlorphacinon, Difenacoum oder Diethalion. Frisst das Nagetier den so präparierten Fertigköder, führt dies zu einer verzögerten Blutgerinnung und tödlichen Blutungsneigung.
Bei Verdacht auf Vergiftungen mit solchen gerinnungshemmenden Rattengiften wird Vitamin K1[55] eingesetzt, es kann oral oder intravenös verabreicht werden.[56][54]
Literatur
[Bearbeiten | Quelltext bearbeiten]- C. G. Victora, P. van Haecke: Vitamin K prophylaxis in less developed countries: policy issues and relevance to breastfeeding promotion. In: Am. J. Public. Health, 1998, Band 88, S. 203–209; PMID 9491008; PMC 1508196 (freier Volltext).
- Alexandra Schek: Vitamin K – ein Update, Teil 1. englische Version (PDF; 2,3 MB), 14. November 2017, Ernährungs-Umschau.
- Alexandra Schek: Vitamin K – ein Update, Teil 2. englische Version (PDF; 0,3 MB), 13. Dezember 2017, Ernährungs-Umschau.
- Dietary reference values for vitamin K. (PDF, englisch), EFSA, 22. Mai 2017, doi:10.2903/j.efsa.2017.4780
- Přemysl Mladěnka et al.: Vitamin K – sources, physiological role, kinetics, deficiency, detection, therapeutic use, and toxicity. In: Nutrition Reviews. Band 80, Nr. 4, 10. März 2022, S. 677–698, doi:10.1093/nutrit/nuab061, PMID 34472618, PMC 8907489 (freier Volltext).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- A. Goldinger: Vitamin-K-Gehalt verschiedener Lebensmittel. Universität Mainz.
- Höchstmengenvorschläge für Vitamin K in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF; 168 kB) Bundesinstitut für Risikobewertung, 2021.
- Vitamin K-Produkte – was ist sinnvoll? Verbraucherzentrale, 11. Oktober 2021.
- Uwe Gröber, Klaus Kisters: Ein altes Vitamin in neuem Licht. Deutsche Apotheker Zeitung, 22. Mai 2014.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Klaus Pietrzik, Ines Golly, Dieter Loew: Handbuch Vitamine: Für Prophylaxe, Therapie und Beratung. 1. Auflage. Urban&Fischer, Elsevier, München 2008, ISBN 978-3-437-55361-5, S. 364.
- ↑ F. W. Schofield: A Brief Account of a Disease in Cattle Simulating Hemorrhagic Septicaemia due to Feeding Sweet Clover. In: The Canadian Veterinary Journal = La Revue Veterinaire Canadienne. Band 25, Nr. 12, Dezember 1984, S. 453–455, PMID 17422488, PMC 1790685 (freier Volltext) – (Reprint des 1922 erschienenen Papers).
- ↑ W. D. McFarlane, W. R. Graham, F. Richardson: The fat-soluble vitamin requirements of the chick: The vitamin A and vitamin D content of fish meal and meat meal. In: The Biochemical Journal. Band 25, Nr. 1, 1931, S. 358–366, doi:10.1042/bj0250358, PMID 16744587, PMC 1260646 (freier Volltext).
- ↑ a b Vivian McAlister: Control of coagulation: a gift of Canadian agriculture. In: Clinical and Investigative Medicine. Medecine Clinique Et Experimentale. Band 29, Nr. 6, Dezember 2006, S. 373–377, PMID 17330453.
- ↑ a b Henrik Dam: The Discovery of Vitamin K, Its Biological Functions and Therapeutical Application. (PDF) Nobel Lecture, 12. Dezember 1946, abgerufen am 3. Oktober 2023 (englisch).
- ↑ Walther F. Holst, Everett R. Halbrook: A "Scurvy-Like" Disease in Chicks. In: Science. Band 77, Nr. 1997, 7. April 1933, S. 354–354, doi:10.1126/science.77.1997.354, PMID 17794290.
- ↑ a b c d Gilles J. Basset et al.: Phylloquinone (Vitamin K1): Occurrence, Biosynthesis and Functions. In: Mini Reviews in Medicinal Chemistry. Band 17, Nr. 12, 2017, S. 1028–1038, doi:10.2174/1389557516666160623082714, PMID 27337968.
- ↑ Informationen der Nobelstiftung zur Preisverleihung 1943 an Henrik Dam und Edward A. Doisy (englisch)
- ↑ Uwe Gröber und Klaus Kisters: Ein altes Vitamin in neuem Licht. In: Deutsche Apotheker Zeitung. 22. Mai 2014, abgerufen am 30. März 2022.
- ↑ a b c d e f g h i Dominique Turck et al.: Dietary reference values for vitamin K. In: EFSA Journal. Band 15, Nr. 5, Mai 2017, doi:10.2903/j.efsa.2017.4780, PMID 32625486, PMC 7010012 (freier Volltext).
- ↑ a b c d H.K. Biesalsky (Hrsg.): Ernährungsmedizin. 2. Auflage. Georg Thieme Verlag, Stuttgart 1999, ISBN 3-13-100292-1.
- ↑ a b c d e f g h i j k l m n o p q r s Přemysl Mladěnka et al.: Vitamin K – sources, physiological role, kinetics, deficiency, detection, therapeutic use, and toxicity. In: Nutrition Reviews. Band 80, Nr. 4, 10. März 2022, S. 677–698, doi:10.1093/nutrit/nuab061, PMID 34472618, PMC 8907489 (freier Volltext).
- ↑ Klaus Pietrzik, Ines Golly, Dieter Loew: Handbuch Vitamine: Für Prophylaxe, Therapie und Beratung. 1. Auflage. Urban&Fischer, Elsevier, München 2008, ISBN 978-3-437-55361-5, S. 365.
- ↑ Louis D. Fiore et al.: Anaphylactoid reactions to vitamin K. In: Journal of Thrombosis and Thrombolysis. Band 11, Nr. 2, April 2001, S. 175–183, doi:10.1023/a:1011237019082, PMID 11406734.
- ↑ Vitamin K2 added for nutritional purposes in foods for particular nutritional uses, food supplements and foods intended for the general population and Vitamin K2 as a source of vitamin K added for nutritional purposes to foodstuffs, in the context of Regulation (EC) N° 258/97[1] -. In: Scientific Opinion of the Panel on Dietetic Products, Nutrition and Allergies. EFSA, S. 6, abgerufen am 30. März 2022 (englisch).
- ↑ Robin J. Marles et al.: US Pharmacopeial Convention safety evaluation of menaquinone-7, a form of vitamin K. In: Nutrition Reviews. Band 75, Nr. 7, 1. Juli 2017, S. 553–578, doi:10.1093/nutrit/nux022, PMID 28838081.
- ↑ a b c d e f g h i j k l m n o Alexandra Schek: Vitamin K – ein Update, Teil 1. In: Ernährungs-Umschau. 14. November 2017, abgerufen am 30. März 2022.
- ↑ M. Vos, G. Esposito u. a.: Vitamin K2 Is a Mitochondrial Electron Carrier That Rescues Pink1 Deficiency. In: Science. 336, 2012, S. 1306–1310, doi:10.1126/science.1218632.
- ↑ Vitamin K Dependent Modifications of Glutamic Acid Residues in Prothrombin. (PDF) In: Proc. Nat. Acad. Sci. USA, Juli 1974, Vol. 71, No. 7, S. 2730–2733.
- ↑ A. M. Craciun, C. Vermeer: Apolipoprotein E genotype may influence urinary gammacarboxyglutamate (Gla) concentrations in young individuals. In: General physiology and biophysics. ahead of print, 2. Juli 2013, PMID 23817635, doi:10.4149/gpb_2013030
- ↑ D. Feskanich, P. Weber, W. C. Willett, H. Rockett, S. L. Booth, G. A. Colditz: Vitamin K intake and hip fractures in women: a prospective study. In: The American journal of clinical nutrition, Band 69, Nummer 1, Januar 1999, S. 74–79, PMID 9925126.
- ↑ Scientific Opinion on the substantiation of health claims related to vitamin K and maintenance of bone. In: EFSA Journal, 2009, 7 (9), S. 1228, doi:10.2903/j.efsa.2009.1228
- ↑ a b c Iris Hinneburg: Osteoporose: Schützt Vitamin K vor spröden Knochen? In: Medizin transparent. 9. Juni 2020, abgerufen am 27. August 2020.
- ↑ Vitamin K-Produkte – was ist sinnvoll? In: Verbraucherzentrale. 11. Oktober 2021, abgerufen am 16. April 2022.
- ↑ Sassan Hafizi, Björn Dahlbäck: Gas6 and protein S. Vitamin K-dependent ligands for the Axl receptor tyrosine kinase subfamily. In: The FEBS journal. Band 273, Nr. 23, Dezember 2006, S. 5231–5244, doi:10.1111/j.1742-4658.2006.05529.x, PMID 17064312.
- ↑ a b Alexandra Schek: Vitamin K – ein Update, Teil 2. In: Ernährungs-Umschau. 13. Dezember 2017, abgerufen am 8. April 2022.
- ↑ Huiyu Xiao et al.: Role of emerging vitamin K-dependent proteins: Growth arrest-specific protein 6, Gla-rich protein and periostin (Review). In: International Journal of Molecular Medicine. Band 47, Nr. 3, März 2021, S. 2, doi:10.3892/ijmm.2020.4835, PMID 33448308, PMC 7834955 (freier Volltext).
- ↑ B. P. Marriott, D. F. Birt, V. A. Stallings, A. A. Yates (Hrsg.): Present Knowledge in Nutrition, Eleventh Edition. Academic Press (Elsevier), London, United Kingdom 2020, ISBN 978-0-323-66162-1, Vitamin K, S. 137–154 (englisch).
- ↑ Mohammed Shurrab et al.: Long-Term Vitamin K Antagonists and Cancer Risk: A Systematic Review and Meta-Analysis. In: American Journal of Clinical Oncology. Band 42, Nr. 9, September 2019, S. 717–724, doi:10.1097/COC.0000000000000571, PMID 31313676.
- ↑ Jin-Dan Luo et al.: Is use of vitamin K antagonists associated with the risk of prostate cancer?: A meta-analysis. In: Medicine. Band 97, Nr. 49, Dezember 2018, S. e13489, doi:10.1097/MD.0000000000013489, PMID 30544443, PMC 6310569 (freier Volltext).
- ↑ Kasper Bruun Kristensen et al.: Use of vitamin K antagonists and risk of prostate cancer: Meta-analysis and nationwide case-control study. In: International Journal of Cancer. Band 144, Nr. 7, 1. April 2019, S. 1522–1529, doi:10.1002/ijc.31886, PMID 30246248.
- ↑ L. J. Schurgers u. a.: Role of vitamin K and vitamin-K-dependent proteins in vascular calcification. In: Zeitschrift für Kardiologie, Band 90, 2001, Nr. 3, S. 57–63. PMID 11374034
- ↑ Geleijnse u. a.: Dietary intake of menaquinone is associated with a reduced risk of coronary heart disease: the Rotterdam Study In: J Nutr., 2004 Nov, 134(11), S. 3100–3105, PMID 15514282
- ↑ Schurgers u. a.: Regression of warfarin-induced medial elastocalcinosis by high intake of vitamin K in rats In: Blood, 2007 Apr 1, 109(7), S. 2823–2831, PMID 17138823.
- ↑ LM Canfield et al.: Vitamin K in colostrum and mature human milk over the lactation period--a cross-sectional study. In: Am J Clin Nutr., 1991 Mar;53(3), S. 730–735.
- ↑ a b c d Höchstmengenvorschläge für Vitamin K in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: Bundesinstitut für Risikobewertung. 2021, abgerufen am 9. Januar 2022.
- ↑ a b c d e f g h S2k-Leitlinie - Prophylaxe von Vitamin-K-Mangel-Blutungen (VKMB) bei Neugeborenen. (PDF) AWMF, März 2016, abgerufen am 13. April 2022.
- ↑ X Fu, JW Peterson, M Hdeib, SL Booth, MA Grusak, AH Lichtenstein, GG Dolnikowski: Measurement of deuterium-labeled phylloquinone in plasma by high-performance liquid chromatography/mass spectrometry. In: Anal Chem., 1. Juli 2009, 81(13), S. 5421–5425; PMID 19563214.
- ↑ RE Kopec, RM Schweiggert, KM Riedl, R Carle, SJ Schwartz: Comparison of high-performance liquid chromatography/tandem mass spectrometry and high-performance liquid chromatography/photo-diode array detection for the quantitation of carotenoids, retinyl esters, α-tocopherol and phylloquinone in chylomicron-rich fractions of human plasma. In: Rapid Commun Mass Spectrom., 30. Juni 2013, 27(12), S. 1393–1402; PMID 23681818.
- ↑ M Sim, JR Lewis, RL Prince, I Levinger, TC Brennan-Speranza, C Palmer, CP Bondonno, NP Bondonno, A Devine, NC Ward, E Byrnes, CJ Schultz, R Woodman, K Croft, JM Hodgson, LC Blekkenhorst: The effects of vitamin K-rich green leafy vegetables on bone metabolism: A 4-week randomised controlled trial in middle-aged and older individuals. In: Bone Rep., 26. April 2020, 12, S. 100274; PMID 32455149.
- ↑ A Meinitzer, D Enko, S Zelzer, F Prüller, N Alonso, E Fritz-Petrin, M Herrmann: Development of a liquid chromatography mass spectrometry method for the determination of vitamin K1, menaquinone-4, menaquinone-7 and vitamin K1-2,3 epoxide in serum of individuals without vitamin K supplements. In: Clin Chem Lab Med., 18. April 2022, 60(7), S. 1011–1019; PMID 35427444.
- ↑ JM Oberson, E Campos-Giménez, J Rivière, F Martin: Application of supercritical fluid chromatography coupled to mass spectrometry to the determination of fat-soluble vitamins in selected food products. In: J Chromatogr B Analyt Technol Biomed Life Sci., 1. Juni 2018, 1086, S. 118–129; PMID 29665470.
- ↑ N Campillo, J Marín, P Viñas, I Garrido, J Fenoll, M Hernández-Córdoba: Microwave Assisted Cloud Point Extraction for the Determination of Vitamin K Homologues in Vegetables by Liquid Chromatography with Tandem Mass Spectrometry. In: J Agric Food Chem., 12. Juni 2019, 67(23), S. 6658–6664; PMID 31094511.
- ↑ E Dunlop, J Jakobsen, MB Jensen, J Arcot, L Qiao, J Cunningham, LJ Black: Vitamin K content of cheese, yoghurt and meat products in ralia. In: Food Chem., 15. Dezember 2022, 397, S. 133772; PMID 35907393.
- ↑ H Wen Lee, X Bi, C Jeyakumar Henry: Carotenoids, tocopherols and phylloquinone content of 26 green leafy vegetables commonly consumed in Southeast Asia. In: Food Chem., 15. August 2022, 385, S. 132729; PMID 35313196.
- ↑ Bruce Furie: Do Pharmacogenetics Have a Role in the Dosing of Vitamin K Antagonists? In: New England Journal of Medicine. 369, 2013, S. 2345–2346, doi:10.1056/NEJMe1313682
- ↑ a b c What is Vitamin K Deficiency Bleeding? CDC, 19. Dezember 2019, abgerufen am 14. April 2022 (englisch).
- ↑ Ludwig Weissbecker: Vitamin K-Avitaminose (Hypoprothrombinämie). In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; 2. Auflage: ebenda 1961, S. 1089 f.
- ↑ A. H. Sutor et al.: Vitamin K deficiency bleeding (VKDB) in infancy. ISTH Pediatric/Perinatal Subcommittee. International Society on Thrombosis and Haemostasis. In: Thrombosis and Haemostasis. Band 81, Nr. 3, März 1999, S. 456–461, PMID 10102477.
- ↑ J. Peter de Winter, Koen F. M. Joosten, Marloes M. Ijland, Henkjan J. Verkade, Martin Offringa: [New Dutch practice guideline for administration of vitamin K to full-term newborns]. In: Nederlands Tijdschrift Voor Geneeskunde. Band 155, Nr. 18, 1. Januar 2011, S. A936, PMID 21672291.
- ↑ M. Cornelissen u. a.: Prevention of vitamin K deficiency bleeding: efficacy of different multiple oral dose schedules of vitamin K. In: Eur J Pediatr., 1997, Vol. 156, S. 126.
- ↑ R. von Kries, A. Hachmeister, U. Göbel: Can 3 oral 2 mg doses of vitamin K effectively prevent late vitamin K deficiency bleeding? In: Eur J Pediatr., 1999, Vol. 158 Suppl. 3, S. 183.
- ↑ Silke Klapdor, Eva Richter, Rainer Klapdor: Fettlösliche Vitamine bei Erkrankungen der Bauchspeicheldrüse. In: Ernährungs-Umschau, Ausgabe 08/12, S. 436–441.
- ↑ a b S. Buderus, M. Adenäuer: Gerinnungshemmendes Rattengift. In: Giftzentrale Bonn. Universitätsklinikum Bonn, abgerufen am 28. Januar 2023.
- ↑ Recognition and Management of Pesticide Poisonings. (PDF) Chapter 18. Rodenticides. In: Environmental Protection Agency. S. 175, abgerufen am 28. Januar 2023 (englisch).
- ↑ D. Nicholas Bateman, Colin B. Page: Antidotes to coumarins, isoniazid, methotrexate and thyroxine, toxins that work via metabolic processes. In: British Journal of Clinical Pharmacology. Band 81, Nr. 3, März 2016, S. 437–445, doi:10.1111/bcp.12736, PMID 26255881, PMC 4767197 (freier Volltext) – (englisch).