Polysuccinimid
| Strukturformel | |||
|---|---|---|---|
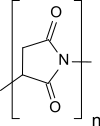
| |||
| Strukturelement ohne Angabe zur Stereochemie | |||
| Allgemeines | |||
| Name | Polysuccinimid | ||
| Andere Namen |
| ||
| CAS-Nummer | 39444-67-2[1] | ||
| Monomer | Succinimid | ||
| Summenformel der Wiederholeinheit | C4H3NO2 | ||
| Molare Masse der Wiederholeinheit | 97,07 g·mol−1 | ||
| Art des Polymers |
Polykondensationsprodukt | ||
| Eigenschaften | |||
| Aggregatzustand |
fest | ||
| Dichte |
0,55 g·cm−3[2] | ||
| Löslichkeit |
| ||
| Sicherheitshinweise | |||
| |||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||
Polysuccinimid (PSI), auch als Polyanhydroasparaginsäure oder Polyaspartimid bezeichnet, entsteht bei der thermischen Polykondensation von Asparaginsäure und stellt das einfachste Polyimid dar. PSI ist wasserunlöslich, aber in einigen aprotisch dipolaren Lösungsmitteln löslich. Seine reaktive Natur macht Polysuccinimid zu einem vielseitigen Ausgangsmaterial für funktionelle Polymere aus nachwachsenden Rohstoffen.
Der Name ist von dem der Salze der Bernsteinsäure, der strukturell verwandten Succinate, abgeleitet.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Darstellung von PSI wurde bereits 1897 von Hugo Schiff[7] berichtet. Beim Erhitzen trockener Asparaginsäure für etwa 20 Stunden im Flüssigkeitsbad auf 190 °C bis 200 °C wurden farblose Produkte erhalten. Oberhalb 200 °C tritt schwache Gelbfärbung auf, Ausbeute fast quantitativ.[8]

Bei den schiffschen Versuchen entstanden in einer Feststoffreaktion durch Polykondensation unter Wasserabspaltung Oligomere und niedrigmolekulare Polymere, wie generell bei Abwesenheit starker Säuren, die die thermische Zersetzung von freien Aminoendgruppen und damit Kettenabbruchsreaktionen unterdrücken. Die Bildung des Polyimids PSI lässt sich anhand der intensiven Absorptionsbande im Infrarotspektrum bei 1714 cm−1 verfolgen. Neben dem relativ niedrigen Polymerisationsgrad liefern viele in der Patentliteratur beschriebene Verfahrensvarianten oft verzweigte und gelb bis braun verfärbte Produkte.[9]
Bei neueren Arbeiten stand das Ziel der Erhöhung der molaren Masse und einer linearen Kettenstruktur unter Vermeidung von Zersetzungsreaktionen im Vordergrund. Mit einem einfachen „Backofenverfahren“, bei dem eine Mischung oder Paste aus kristalliner Asparaginsäure und konzentrierter Phosphorsäure oder Polyphosphorsäure in dünner Schicht für 2 Stunden bis 4 Stunden auf 200 °C erhitzt wird, fällt PSI mit molaren Massen im Bereich von 30,000 g/mol und creme-weißem Farbton an.[10] Die Durchführung der Polykondensation in mehreren Schritten[11] (Vorkondensation, Zerkleinerung des Vorkondensats, Nachkondensation), mit anderen wasserentziehenden Substanzen (z. B. Zeolithe, Triphenylphosphit[12]) oder in Gegenwart von Lösungsmitteln[13] (z. B. Propylencarbonat) liefert höhermolekulare Produkte mit molaren Massen im Bereich von 10.000 g/mol bis 200.000 g/mol. In der Patentliteratur wird allerdings nicht auf die Polymermorphologie, insbesondere auf den Verzweigungsgrad, eingegangen.
Ein neueres Patent[14] beschreibt die einfache Darstellung von hochmolekularem, praktisch farblosem und linearem, unverzweigtem PSI, indem zunächst die als Zwitterion vorliegende kristalline und praktisch wasserunlösliche Asparaginsäure mit einer wässrigen, flüchtigen Säure, bevorzugt Salzsäure, gelöst und mit dem Kondensationsmittel Phosphorsäure versetzt wird. Die resultierende homogene Lösung wird bei 120 °C eingedampft und die erhaltene glasartige Masse anschließend bei 180 °C bis 200 °C für mindestens eine Stunde polykondensiert. Die Phosphorsäure wird ausgewaschen und das getrocknete PSI durch milde alkalische Hydrolyse in wasserlösliche Polyasparaginsäure überführt, deren molare Masse durch Gelpermeationschromatographie bestimmt werden kann. Das Verfahren liefert reproduzierbar PSI mit molaren Massen über 100.000 g/mol.
Syntheserouten für PSI, die von Maleinsäure-Monoammoniumsalz,[15] Maleinsäureanhydrid und Ammoniak[16] oder von dem dabei intermediär gebildeten Maleinsäuremonoamid[17] ausgehen, erzielen nur niedrige molare Massen von einigen 1.000 g/mol und gefärbte Produkte, ebenso wie „grüne“ Prozessvarianten in überkritischem Kohlenstoffdioxid und unter Vermeidung von Mineralsäuren als Katalysatoren.[8]

Wegen der niedrigeren Kosten der aus fossilen Rohstoffen hergestellten Edukte Maleinsäureanhydrid und Ammoniak wird auch in der Herstellung des kommerziellen Produkts Baypure® PSI keine L-Asparaginsäure eingesetzt.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Polysuccinimid fällt bei der thermischen Polykondensation als geruchsloses, nicht-hygroskopisches, creme-weißes bis braunes Pulver an, das in aprotisch dipolaren Lösungsmitteln wie Dimethylformamid, Dimethylacetamid, Dimethylsulfoxid, N-Methylpyrrolidon, Triethylenglycol oder Mesitylen/Sulfolan-Gemisch löslich ist. PSI hydrolysiert in Wasser nur sehr langsam. In verdünnt alkalischen Medien (z. B. 1N Natronlauge) erfolgt Hydrolyse in α- und β-Position der Succinimid-(2,5-Pyrrolidindion)-Ringstrukturen und Racemisierung am chiralen Zentrum der Asparaginsäure zum gut wasserlöslichen Natriumsalz der Poly-(α, β)-DL-Asparaginsäure. Dabei wird zu ca. 30 % die α-Form, zu ca. 70 % die β-Form in zufälliger Anordnung entlang der Polymerkette gebildet.[18]
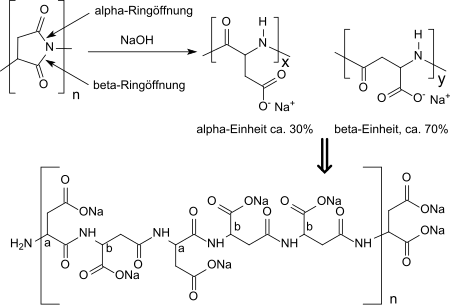
Bei höheren Alkalikonzentrationen oder längeren Einwirkungszeiten werden auch die Amidverknüpfungen in der Polymerkette unter Abbau der molaren Masse angegriffen. Das Vorliegen von Amidbindungen macht die bei der Hydrolyse selbst von hochvernetztem PSI erhaltene Polyasparaginsäure relativ gut (ca. 70 % in Abwasser) bioabbaubar.[19]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Das von der Bayer AG entwickelte[20] und von Lanxess AG unter dem Markennamen Baypure® DSP vermarktete Polysuccinimid[2] mit einem Gewichtsmittel der mittleren Molmasse MG von 4,400 g/mol wird bereits bei leicht erhöhten pH-Werten partiell hydrolysiert und dadurch in hochvernetzter Form quellbar bzw. in linearer Form wasserlöslich. Die durch Teilhydrolyse entstehende Copoly-(succinimid-asparaginsäure) und insbesondere die Polyasparaginsäure (Handelsname Baypure® DS 100) eignet sich als langanhaltend wirksamer Inhibitor gegen Kalkablagerungen in der Wasseraufbereitung und bei Anwendungen in der Öl- und Bergbauindustrie, sowie als Abbindeverzögerer für Zement in der Bauindustrie.[20] In der Patentliteratur[12] werden für PSI Anwendungen als Chelatbildner, Inhibitor gegen Kesselsteinbildung, Dispergier- und Feuchthaltemittel, sowie Düngemitteladditiv erwähnt.
Bei der Öffnung der Pyrrolidindion-Ringstrukturen im PSI im Sinne einer Aminolyse mit Ammoniakwasser entsteht Poly-(α, β)-DL-asparagin, mit Hydrazin Poly-(α, β)-DL-aspartylhydrazid (PAHy) und mit funktionellen Aminen, z. B. Ethanolamin Poly-(α, β)-DL-2-hydroxyethylaspartat (PHEA),[10] das als Plasmaexpander mit guter Biokompatibilität und -abbaubarkeit, hoher Wasserlöslichkeit bei niedrigen Herstellkosten charakterisiert und intensiver als potentieller Wirkstoffträger (engl. drug carrier) in medizinischen Anwendungen untersucht wurde.[21][22]

Vernetztes Poly-(α, β)-DL-Asparaginsäure-Natriumsalz als kommerziell interessantestes PSI-Derivat wurde in umfangreichen Untersuchungen auf seine Eignung als bioabbaubarer Superabsorber im Vergleich zum nicht-bioabbaubaren Standard vernetztes Natriumpolyacrylat geprüft.[23][24][25]
Die erzielten Resultate haben bisher noch nicht zum Einsatz vernetzter Polyasparaginsäure in großvolumigen Anwendungen für Superabsorbern (z. B. Babywindeln) geführt.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Baypure® Lanxess AG, DSP, Technical Information
- ↑ a b c Baypure® General Product Information (PDF; 1,7 MB) Lanxess AG
- ↑ E. Jalalvandi, A. Shavandi: Polysuccinimide and its derivatives: Degradable and water soluble polymers (review). In: Eur. Polym. J. Band 109, 2018, S. 43–54, doi:10.1016/j.eurpolymj.2018.08.056.
- ↑ T. Klein, R.-J. Moritz, R. Graupner: Ullmann‘s Polymers and Plastics, Products and Processes, Volume 1, Part 2: Organic Polymers, Polyaspartates and Polysuccinimide. Wiley-VCH, Weinheim 2016, ISBN 978-3-527-33823-8, S. 742–743.
- ↑ M. Tomida, T. Nakato, M. Kuramochi, M. Shibata, S. Matsunami, T. Kakuchi: Novel method of synthesizig poly(succinimide) and its copolymeric derivatives by acid-catalysed polycondensation of L-aspartic acid. In: Polymer. Band 37, Nr. 16, 1996, S. 4435–4437, doi:10.1016/0032-3861(96)00267-4.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Hugo Schiff: Ueber Polyaspartsäuren. In: Berichte der deutschen chemischen Gesellschaft. Band 30, Nr. 3, 1. September 1897, S. 2449–2459, doi:10.1002/cber.18970300316.
- ↑ a b Kenneth Doll, Randal Shogren, Ronald Holser, J. Willett, Graham Swift: Polymerization of L-Aspartic Acid to Polysuccinimide and Copoly(Succinimide-Aspartate) in Supercritical Carbon Dioxide. In: Letters in Organic Chemistry. Band 2, Nr. 8, 1. Dezember 2005, S. 687–689, doi:10.2174/157017805774717553.
- ↑ Thomas Klein, Ralf-Johann Moritz, René Graupner: Polyaspartates and Polysuccinimide. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA, 2008, ISBN 978-3-527-30673-2, doi:10.1002/14356007.l21_l01.
- ↑ a b Paolo Neri, Guido Antoni, Franco Benvenuti, Francesco Cocola, Guido Gazzei: Synthesis of α, β-poly [(2-hydroxyethyl)-DL-aspartamide], a new plasma expander. In: Journal of Medicinal Chemistry. Band 16, Nr. 8, 1. August 1973, S. 893–897, doi:10.1021/jm00266a006.
- ↑ Patent US5142062: Method for increasing the molecular weight in the manufacture of polysuccinimide. Veröffentlicht am 25. August 1992, Anmelder: Röhm GmbH, Erfinder: J. Knebel, K. Lehmann.
- ↑ a b Patent EU0791616: Process for producing polysuccinimide and use of said compound. Veröffentlicht am 27. August 1997, Anmelder: Mitsubishi Chemical Corp., Erfinder: M. Uenaka et al..
- ↑ Patent US5756595: Catalytically polymerizing aspartic acid. Veröffentlicht am 26. Mai 1998, Anmelder: Donlar Corp., Erfinder: G.Y. Mazo et al..
- ↑ Patent US7053170: Preparation of high molecular weight polysuccinimides. Veröffentlicht am 30. Mai 2006, Anmelder: Aquero Co., Erfinder: C.S. Sikes.
- ↑ Patent EU0612784: Process for preparing polysuccinimide and polyaspartic acid. Veröffentlicht am 31. August 1994, Anmelder: Bayer AG, Erfinder: T. Groth et al..
- ↑ Patent US5296578: Production of polysuccinimide and polyaspartic acid acid from maleic anhydride and ammonia. Veröffentlicht am 22. März 1994, Anmelder: Donlar Corp., Erfinder: L.P. Koskan, A.R.Y. Meah.
- ↑ Patent US5393868: Production of polysuccinimide by thermal polymerization of maleamic acid. Veröffentlicht am 28. Februar 1995, Anmelder: Rohm and Haas Co., Erfinder: M. B. Freeman et al..
- ↑ K.C. Low et al.: 6. Commercial Poly(aspartic acid) and Its Uses. In: J.E. Glass: Hydrophilic Polymers, Advances in Chemistry. 248, 1996, ISBN 978-0-8412-3133-7, S. 99–111, doi:10.1021/ba-1996-0248.ch006.
- ↑ G. Swift: Degradable Polymers. 2nd ed. Springer Netherlands, 2002, S. 379–412, doi:10.1007/978-94-017-1217-0_11.
- ↑ a b T. Klein: Baypure®, An innovate product family for household and technical applications. 5th Green Chemistry Conference 2003, Barcelona.
- ↑ K. Seo, D. Kim: Design and synthesis of endosomolytic conjugated polyaspartamide for cytosolic drug delivery. In: E. Jabbari, A. Khademhosseini (Hrsg.): Biologically-responsive hybrid biomaterials: a reference for material scientists and bioengineers. World Scientific Publishing Co., Singapur 2010, ISBN 978-981-4295-67-3, S. 191–212, doi:10.1142/9789814295680_0009.
- ↑ Eberhard W. Neuse, Axel G. Perlwitz, Siegfried Schmitt: Water-soluble polyamides as potential drug carriers. III. Relative main-chain stabilities of side chain-functionalized aspartamide polymers on aqueous-phase dialysis. In: Die Angewandte Makromolekulare Chemie. Band 192, Nr. 1, 1. November 1991, S. 35–50, doi:10.1002/apmc.1991.051920103.
- ↑ Patent US5859179: Forming superabsorbent polymer. Veröffentlicht am 19. Januar 1999, Anmelder: Solutia Inc., Erfinder: Y. Chou.
- ↑ Patent US6072024: Production process of cross-linked polyaspartic acid. Veröffentlicht am 6. Juni 2000, Anmelder: Mitsui Chemicals, Erfinder: Y. Irizato et al..
- ↑ Ajay Kumar: Polyaspartic Acid – A Versatile Green Chemical. In: Chemical Sci. Rev. Letters (CSRL). Band 1, Nr. 3, 2012, S. 162–167 (PDF).