Herz


Das Herz (lateinisch Cor, griechisch Καρδία Kardía, oder latinisiert Cardia) ist ein bei verschiedenen Tiergruppen vorkommendes muskuläres Hohlorgan (Hohlmuskel), das mit Kontraktionen Blut oder Hämolymphe in den Kreislauf und somit durch den Körper pumpt und so die Versorgung aller Organe sichert. Höherentwickelte Herzen, beispielsweise bei den Wirbeltieren, arbeiten wie eine Verdrängerpumpe, indem Flüssigkeit (Blut) ventilgesteuert aus Blutgefäßen angesaugt wird (bei Säugern Hohl- bzw. Lungenvenen) und durch andere Blutgefäße ausgestoßen wird (bei Säugern Truncus pulmonalis bzw. Aorta).
Die Lehre von Struktur, Funktion und Erkrankungen des Herzens ist die Kardiologie. Ein Leben ohne Herz ist für höhere Tiere und den Menschen nicht möglich, jedoch können künstliche Herzen den Verlust der natürlichen Funktionen mittlerweile in gewissen Grenzen ausgleichen. Das Herz gehört zu den ersten während der Embryonalentwicklung angelegten Organen. Historisch wurzelt die Formulierung des springenden Punktes in dem zu schlagen beginnenden Herz des Hühnerembryos.
Etymologie
Der neuhochdeutsche Begriff Herz – gemeingermanisch und mittelhochdeutsch hërz[e], althochdeutsch herza – geht auf das indogermanische kē̌rd zurück. Es hat somit denselben etymologischen Ursprung wie die lateinischen und griechischen Formen. Die im Deutschen am Anfang und am Ende des Wortes befindlichen zwei Konsonanten beruhen auf einem Wandel, der im Laufe der Generationen auftritt und als Lautverschiebung bezeichnet wird.[1]
Die Herzen von Mensch und Säugetier haben vier Herzhöhlen: zwei Vorhöfe (Atrium) und zwei Kammern (Ventrikel). Das Atrium war in der römischen Architektur der Innenhof oder Vorraum eines Wohnhauses. Ein Ventrikel ist im Lateinischen (ventriculus) ein „kleiner Bauch“; venter ist der Magen oder das Abdomen. Es ist sprachlich falsch, wenn die Kardiologen vom Vierkammerblick, von der Vierkammerebene und dem Dreikammerblick[2] oder vom Dreikammerschrittmacher sprechen. Im Englischen dagegen hat ein four-chambered heart zwei Ventrikel; ein Ventrikel is one of two large chambers. Beim Übersetzen ist chamber (= Kammer, lateinisch camera) also entweder eine Herzkammer oder eine Herzhöhle (lateinisch cavum cordis). Ein Zweikammer-Herzschrittmacher stimuliert einen Vorhof und die dazugehörige Kammer, nicht aber beide Ventrikel.
Forschungsgeschichte
Denker der Antike wie Empedokles (5. Jahrhundert v. Chr.), Aristoteles (4. Jahrhundert v. Chr.), Diokles von Karystos (4. oder 3. Jahrhundert v. Chr.), Vertreter der westgriechischen Medizin und die meisten Stoiker sahen das Herz als Zentralorgan des Körpers und Ausgangspunkt für Blutgefäße und Nerven an. Als Aufgabe des Gehirns nahmen sie hingegen nur die Abkühlung der im Herzen lokalisierten Wärme an.[3]
Der griechische Philosoph Alkmaion erkannte, dass nicht das Herz die ihm in der Antike noch zugesprochene Rolle als Zentralorgan der Wahrnehmung und der Erkenntnis hat, sondern das Gehirn, welches er auch für die Bewegungsabläufe im Körper verantwortlich machte. Alkmaions Theorie folgten auch Platon und Verfasser des Corpus Hippocraticum. Auch wenn diese Lehre durch die alexandrinischen Ärzte Herophilos von Chalkedon und Erasistratos bestätigt wurde, hielten sich noch lange die älteren Vorstellungen vom Herz als Zentralorgan.[4]
Die linke Herzkammer galt, so bei Galen in De usu partium, als Ort der „eingepflanzten Wärme“ (calor innatus), dem eigentlichen Lebensprinzip, und damit als Speicher des „Lebenspneumas“ (während das „Seelenpneuma“ im Gehirn vermutet wurde). Der linke Herzvorhof wurde von Galen als Teil der Lungenvene aufgefasst.[5]

Der arabische Arzt Ibn an-Nafīs (1213–1288) war der Erste, der das Herz anatomisch richtig beschrieb. Der englische Arzt William Harvey (1578–1657) zeigte, dass die Kontraktionen des Herzens die Bewegung des Bluts durch den Kreislauf antreiben.[6]
Anatomisch bedeutende Darstellungen des Herzens publizierten unter anderem auch Berengario da Carpi, Leonardo da Vinci, Andreas Vesalius und Godefridus Bidloo. Zu den bekanntesten Abhandlungen über die Anatomie und Pathologie des Herzens im 18. Jahrhundert gehört die 1749 erschienene Schrift Traité de la structure du coer, de son action et de ses maladies von Jean-Baptiste Sénac, dem Leibarzt von Ludwig XV.[7]
Herztypen und deren Verbreitung im Tierreich
Röhrenherzen und Kammerherzen
Die Herzen der verschiedenen Tiergruppen lassen sich bezüglich ihres Aufbaus in röhrenförmige und gekammerte Typen einteilen.
Röhrenförmige Herzen setzen das Blut oder die Hämolymphe in Bewegung, indem Kontraktionswellen durch ihre Wände laufen (Peristaltik). So kann ein gerichteter Fluss erzeugt werden, auch wenn keine Ventile vorhanden sind. Gliederfüßer haben röhrenförmige Herzen, die nahe am Rücken liegen. Bei Insekten und manchen Krebsen wie Artemia können sie sich über längere Körperabschnitte erstrecken, bei anderen Krebsen handelt es sich um kurze muskuläre Säcke. Das Blut beziehungsweise die Hämolymphe tritt meistens über seitliche Öffnungen ein, sogenannte Ostien. Diese können recht zahlreich werden, die Fangschreckenkrebse haben 13 Paare.[8] Manchmal geschieht der Zufluss aber auch von hinten über Venen. Bei der Herzkontraktion wird die Flüssigkeit nach vorne in eine mit Klappen versehene Arterie gepresst. Das Herz ist an Bändern oder Muskeln aufgehängt, die durch die Herzkontraktion unter Spannung gesetzt werden. Beim Erschlaffen des Herzens öffnen sich die Ostien und das Herz erweitert sich, so dass Flüssigkeit nachströmen kann. Das Arthropodenherz lässt sich daher mit einer Saugpumpe vergleichen.
Röhrenförmige Herzen kommen auch bei den Urochordata und bei Embryonen der Wirbeltiere vor. Beim Manteltier Ciona ändert sich die Richtung der Kontraktionswellen rhythmisch, so dass die Flussrichtung des Blutes abwechselt.[9][10] Dies ist auch bei Insekten so. So zeigt die visuelle Beobachtung vom Herz von ruhenden Mücken der Art Anopheles gambiae, dass sich dieses mit einer Rate von 1,37 Hz (82 Schläge pro Minute) zusammenzieht und die Kontraktionsrichtung wechselt, wobei 72 % der Kontraktionen in anterograder Richtung (zum Kopf hin) und 28 % der Kontraktionen in retrograder Richtung (zur Bauchspitze hin) erfolgen.[11]
Bei Herzen mit Kammern zieht sich eine Kammer komplett zusammen. Das Fließen in die falsche Richtung wird durch Klappen verhindert, die sich nur in eine Richtung öffnen. Dieser Herztyp kommt besonders bei Weichtieren und Wirbeltieren vor. Aufgrund der sehr starken Wandmuskulatur wirken diese Herzen zusätzlich als Druckpumpe, die einen hohen Blutdruck erzeugen kann. Bei vielen Weichtieren, speziell bei den Schnecken, aber auch bei niederen Wirbeltieren funktioniert die Füllung des Herzens durch Unterdruck in der Perikardhöhle, die das Herz umgibt. Die Wand dieser Höhle kann sehr fest sein, so dass hier bei der Herzkontraktion ein Unterdruck entsteht, der nach Ende der Kontraktion Blut in das Herz saugt. Bei Haien entstehen so −5 mmWS. Die Kammer (auch: Ventrikel) hat eine dicke, muskuläre Wand. Ihr vorgeschaltet ist der Vorhof (auch: Atrium), der eine schwächere Wandmuskulatur hat und der durch seine Kontraktion die Kammer befüllt.[9]
Myogene und neurogene Herzen
Die Herzkontraktion wird durch einen elektrischen Impuls ausgelöst. Bei myogenen Herzen wird dieser Impuls spontan und rhythmisch in spezialisierten Herzmuskelzellen ausgelöst, den Schrittmacherzellen. Dies kommt bei Wirbeltieren, Manteltieren, Weichtieren sowie bei manchen Ringelwürmern und Gliederfüßern (darunter die Insekten) vor. Bei Säugern und Vögeln wurden die verantwortlichen Zellen im Sinusknoten lokalisiert. Die elektrische Gesamtaktivität eines myogenen Herzens lässt sich in einem Elektrokardiogramm (EKG) darstellen. Das EKG ist für jede Tierart typisch.[8][9]
Bei neurogenen Herzen wird der Impuls zur Kontraktion durch Nervenzellen (genauer: Ganglienzellen) ausgelöst, die am Herzen anliegen. Eine solche neurogene Automatie kommt bei manchen Ringelwürmern und manchen Gliederfüßern vor, zum Beispiel bei den Zehnfußkrebsen, zu denen Hummer, Krabben und andere Gruppen gehören. Das verantwortliche Herzganglion kann je nach Art zum Beispiel neun oder 16 Zellen haben. Auch der Pfeilschwanzkrebs Limulus und die Vogelspinne Erypelma californicum haben ein neurogenes Herz. Während sich bei myogenen Herzen die Erregung von den Schrittmacherzellen über jeweils benachbarte Muskelzellen schließlich im gesamten Herzen ausbreitet, findet eine solche muskuläre Erregungsweiterleitung in neurogenen Herzen soweit bekannt nicht statt. Stattdessen sind die Muskelzellen vielfach innerviert. Bei Limulus wird jede Muskelzelle von sechs oder mehr Nervenzellen innerviert, die Ganglien entspringen, die rückenwärts am Herzen anliegen und die Erregung steuern.[8][9][12]
Auch myogene Herzen sind oft innerviert, etwa bei Weichtieren und Wirbeltieren. So können sowohl myogene als auch neurogene Herzen durch das Nervensystem gesteuert werden. Durch entsprechende Nervenimpulse können beispielsweise die Schrittmacherzellen stimuliert oder inhibiert werden, so dass die Herzfrequenz gesteigert oder herabgesetzt wird, je nach den körperlichen Erfordernissen.[8]
Bei den Gliederfüßern sind lange Herzen häufiger neurogen und kurze Herzen eher myogen. Generell schlagen beide Herztypen selbstständig, ohne Signalgeber aus dem zentralen Nervensystem. Dies wird als Autonomie oder Autorhythmie bezeichnet.[9][12]
Nebenherzen
Die meisten Weichtiere haben ein offenes Gefäßsystem mit einem Herzen mit Vorhof und Kammer. Bei den Kopffüßern, die ein weitgehend geschlossenes Gefäßsystem haben, finden sich jedoch neben dem Hauptherzen noch zwei Kiemenherzen, die das Blut durch die Kapillaren der Kiemen pressen. Sie haben also eine ähnliche Funktion wie die rechte Herzhälfte der Säuger, die den Lungenkreislauf antreibt.
Bei Myxinen, einer Gattung der Schleimaale, finden sich neben dem Hauptherzen noch Portalherz, Cardinalherzen und Caudalherz. Nebenherzen gibt es auch in den Flügelvenen von Fledermäusen. Im Lymphgefäßsystem von Froschlurchen treten sogenannte Lymphherzen auf. Sie sind paarig in der Nähe des Steißbeins angelegt und haben eine neurogene Automatie. Ein eigener Schrittmacher ist jedoch nicht vorhanden. Stattdessen werden sie vom vegetativen Nervensystem gesteuert. Lymphherzen kommen auch bei manchen Reptilien und Vögeln vor, etwa beim Strauß, bei den meisten Vögeln und den Säugern aber nicht.[8][9]
Bei vielen Insekten kommen zusätzliche Herzen in Flügeln, Beinen und Antennen vor, die helfen, die Hämolymphe durch diese schmalen Körperanhänge zu pressen. Bis zu einigen Dutzend dieser akzessorischen Herzen können auftreten.[10]
Andere blutfördernde Organe
Neben Herzen tragen bei manchen Arten auch andere Organe zum Fluss des Blutes bei. In den Beinen der Landwirbeltiere führt die Kontraktion der Muskeln zu einem verbesserten Rückstrom des venösen Blutes zum Herzen. Die Körperbewegung der Gliederfüßer setzt die Hämolymphe in Bewegung. Bei manchen Arten kommen Blutgefäße vor, die sich zusammenziehen können, zum Beispiel beim Perlboot Nautilus, wo sie das Blut durch die Kiemen zum Herzen pumpen.[10]
Herzfrequenz
Generell gilt, dass innerhalb einer Tiergruppe die Herzfrequenz großer Arten niedriger ist als jene von kleineren Arten. Dies wurde beispielsweise für Säuger, Krebstiere oder Spinnentiere gezeigt. Bei Säugern liegen die Werte für ausgewachsene Tiere in Ruhe zwischen 6 Schlägen pro Minute beim Blauwal und 1000 Schlägen pro Minute bei der Etruskerspitzmaus.[13] Eine Ausnahme von der Regel ist die Giraffe, die mit 170 Schlägen pro Minute eine deutlich höhere Frequenz hat als Tiere vergleichbarer Größe.[10]
Bei gleichwarmen Tieren ist die Frequenz höher als bei gleich großen wechselwarmen Tieren. Wie auch die Atemfrequenz steht die Herzfrequenz in Relation zur Stoffwechselrate. Bei gleich großen verwandten Arten mit unterschiedlicher Aktivität haben die trägeren eine langsamere Herzfrequenz als die lebhafteren. Bei Vögeln, Krebsen und Lungenschnecken lässt sich der Zusammenhang zwischen steigender Körpermasse () und abnehmender Herzfrequenz () mit folgender allometrischer Gleichung beschreiben:
wobei eine für die Tiergruppe spezifische Konstante ist und bei den Vögeln −0,27, bei den Krebsen −0,12 und bei den Lungenschnecken −0,11 beträgt. Grundsätzlich beziehen sich derartige Vergleiche auf erwachsene Tiere.[8][12]
Die Häufigkeit des Herzschlags (Herzfrequenz) ist nicht allein entscheidend für die Blutmenge, die durch das Herz hindurchgepumpt wird, sondern auch die Amplitude zwischen der Dehnung und Kontraktion der Herzmuskeln, also das Herzschlagvolumen. Aus dem Zusammenwirken beider ergibt sich (als Produkt) das Herzzeitvolumen.
Blutdruck
Der Blutdruck ist der Druck, gegen den das Herz seinen Inhalt auswerfen muss. Er ist damit entscheidend für die Arbeit, die das Herz verrichten muss. Bei Tieren mit einem geschlossenen Blutkreislauf hängt die Höhe des Blutdrucks unmittelbar mit der Auswurfleistung des Herzens zusammen. Das Herzzeitvolumen ist hier der Quotient aus Blutdruck und peripherem Widerstand. Dies ist bei Tieren mit offenem Kreislaufsystem nicht der Fall. Da die Hämolymphe auch die Leibeshöhle durchströmt, ist der Blutdruck hier einerseits vergleichsweise niedrig und andererseits abhängig von der Körperbewegung und -haltung und dadurch sehr variabel.[8]
Bei den Weichtieren wurde gezeigt, dass der Druck, der vom Ventrikel aufgebaut werden kann, bei den Tiergruppen mit aktiverer Lebensweise größer ist. Bei den Kopffüßern sind bei Octopus bis zu 600 mmWS gemessen worden (entspricht 44 mm Hg), bei der Schnecke Patella 50 mmWS (3,7 mm Hg) und bei Muscheln in der Regel unter 20 mmWS (1,5 mm Hg).[8]
Bei den Wirbeltieren ist der Blutdruck am höchsten im Körperkreislauf der Vögel, dicht gefolgt vom Körperkreislauf der Säuger. Die anderen Wirbeltiergruppen, die keine vollständige Trennung zwischen Lungenkreislauf und Körperkreislauf haben (siehe unten), haben deutlich niedrigere Blutdrücke (siehe Tabelle). Bei Vögeln und Säugern nimmt der Blutdruck mit dem Alter zu und ist bei Männchen etwas höher als bei Weibchen. Bei Säugetieren, die Winterschlaf halten, sinkt der Blutdruck stark.[14] Wenn nicht anders angegeben, beruhen die Zahlenangaben der Tabelle auf dem zitierten Lehrbuch.[14] Angegeben werden zuerst der Ruheblutdruck am Ende der Herzkontraktion (systolischer Blutdruck), der dem Druck im (linken) Ventrikel entspricht, und gefolgt von einem Schrägstrich der Druck in der Aorta am Beginn der nächsten Kontraktion, gegen den das Herz das Blut auswerfen muss (diastolischer Blutdruck). Alle Werte in mm Hg.
Säugetiere
|
Vögel
|
Wechselwarme Wirbeltiere
|
Herzen der Wirbeltiere
Alle Wirbeltierherzen sind myogen, ein Schrittmacher sorgt für eine herzeigene Reizgenerierung. In vielen Fällen schlagen Herzen unter kontrollierten Bedingungen noch weiter, nachdem sie aus einem Tier herauspräpariert wurden. Diese Eigenschaft wird als Autorhythmie oder Autonomie bezeichnet.[12]
Wandstruktur
Die Wände der Wirbeltierherzen sind aus mehreren Schichten aufgebaut. Das Herz ist umgeben vom Herzbeutel (Perikard). Die äußerste Schicht des Herzens ist das Epikard und nach innen folgt das äußere Bindegewebe des Herzens. Wenn Koronargefäße (Herzkranzgefäße) vorhanden sind, liegen sie hier. Sie erstrecken sich dann von hier in die darunter liegende Muskelschicht, das Myokard. Hier liegen die Herzmuskelzellen, die Kardiomyozyten. Die innerste Schicht ist das Endokard, eine Bindegewebsschicht, die zum Herzinnenraum hin von einer Schicht Epithelzellen abgeschlossen wird.[10]
Die Muskelschicht kommt in zwei Formen vor, als kompaktes oder spongiöses (schwammiges) Myokard. Der jeweilige Anteil beider Typen ist artspezifisch. Bei Fischen und Amphibien liegt hauptsächlich spongiöses Myokard vor, während Säuger fast nur kompaktes Myokard haben. Im Gegensatz zu kompaktem hat spongiöses Myokard häufig keine Blutgefäße, es wird vom Blut im Herzen versorgt. Das spongiöse Myokard kann in Trabekeln oder Bälkchen in die Herzkammer hineingezogen sein.[10]
Fische

Das Herz der Fische sammelt das Blut aus dem Körper und treibt es mit starkem Druck in die Kiemen. Diese Funktionen lassen sich im Aufbau wiederfinden. Von den vier hintereinander liegenden Kammern sammeln die hinteren beiden, der Sinus venosus und der Vorhof (Atrium), das Blut. Aus diesen beiden dünnwandigen Räumen wird das Blut zunächst in den muskulösen Ventrikel geleitet. Bei den Plattenkiemern (Elasmobranchii, Haie und Rochen) folgt der muskulöse Conus arteriosus (auch Bulbus cordis). Ihr Herzbeutel (Perikard) ist steif, so dass durch das Auspressen des Blutes ein Unterdruck entsteht. Dieser hilft bei der Füllung für den nächsten Zyklus.[9][10][12]
Bei den Echten Knochenfischen (Teleostei) ist der Conus arteriosus weitgehend zurückgebildet. Stattdessen haben sie aus dem Anfang der Aorta den Bulbus arteriosus entwickelt, eine Struktur, die viele elastische Fasern sowie glatte Muskelzellen enthält. Er ruft einen starken Windkesseleffekt zur Aufrechterhaltung des Blutdrucks hervor.
Die Kontraktionswelle entsteht myogen im Sinus venosus und läuft dann nach vorne. Klappen zwischen den Kammern verhindern das Zurückfließen[9][10][12] (siehe auch Blutkreislauf der Fische).
Eine Abwandlung dieses Bauplans liegt bei den Lungenfischen (Dipnoi) vor. Der Vorhof ist hier geteilt. Während der rechte Vorhof wie der Vorhof der anderen Fische das sauerstoffarme Blut aus dem Körper aufnimmt, wird der linke Vorhof vom neu entwickelten Lungenkreislauf mit sauerstoffreichem Blut gespeist. Eine lange Spiralfalte im Bulbus cordis hilft, das sauerstoffreiche Blut über die Aorta dorsalis in den Körper zu leiten. Wie die Elasmobranchii haben auch die Lungenfische einen steifen Herzbeutel.[12]
Amphibien
Das Herz der Amphibien ähnelt dem der Lungenfische: Es besitzt zwei separate Vorhöfe und eine Hauptkammer (Ventrikel). Der Sinus venosus ist bei den Amphibien verkleinert. Sauerstoffreiches Blut aus der Lunge kommt im linken Vorhof an, das Blut des Körperkreislaufs im rechten. Von dort gelangt das Blut in die Kammer und danach durch den Conus arteriosus in den Lungen- und den Körperkreislauf. Trabekel in der Kammer erlauben es, sauerstoffreiches und -armes Blut weitgehend getrennt zu halten. Eine Spiralfalte im Conus arteriosus leitet bevorzugt sauerstoffarmes Blut zur Arteria pulmocutanea, deren weitere Verzweigungen zur Lunge und zur Haut führen. Hautatmung kann bei Amphibien einen wichtigen Anteil der Sauerstoffversorgung stellen. Der Körperkreislauf wird dagegen mit sauerstoffreichem Blut beschickt.[9][10]
Sauerstoffreiches Blut von der Haut kommt im Gegensatz zu dem Blut aus der Lunge im rechten Vorhof an, zusammen mit dem sauerstoffarmen Blut aus dem Körperkreislauf. Taucht ein Frosch in sauerstoffreichem Wasser, fließt weniger Blut durch die Lungen, dafür mehr durch die Haut. Der gemeinsame Ventrikel beider Kreisläufe erlaubt es auch in dieser Situation, dass Sauerstoff in die Gewebe geleitet wird[10] (siehe auch Blutkreislauf der Amphibien).
Reptilien
Bei den Reptilien kommen zwei unterschiedliche Herztypen vor. Der Herztyp der Crocodylia einerseits und der aller anderen Reptilien andererseits.
Die anderen Reptilien haben wie die Amphibien ein Herz mit zwei getrennten Vorhöfen (Atrien) und einem gemeinsamen Ventrikel. Der Ventrikel ist aber hier durch Muskelleisten in drei miteinander in Verbindung stehende Räume (Cavum arteriosum, Cavum venosum und Cavum pulmonale[15]) unterteilt, so dass von insgesamt fünf Kammern (besser: Herzhöhlen) gesprochen wird. Der Sinus venosus, bei den Amphibien und Fischen noch dem Vorhof vorgeschaltet, ist weiter reduziert und fehlt manchmal ganz. Entsprechend ist das erregungsbildende Gewebe (Sinusknoten) in die Wand des Atriums verschoben, nahe der Veneneinmündung.[9][10]
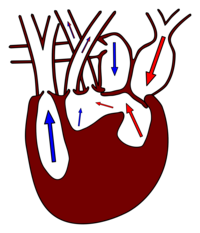
Während das Blut aus dem Ventrikel bei den Amphibien noch in einen gemeinsamen Conus arteriosus fließt, ist dieser bei den Reptilien dreigeteilt, in die Lungenarterie und in die rechte und die linke Aorta. Im Gegensatz zu den Amphibien spielt Hautatmung keine Rolle mehr, so dass eine Sauerstoffanreicherung nur in der Lunge stattfindet. Trotz einer gemeinsamen Kammer bleiben sauerstoffreiches und -armes Blut in der Regel getrennt. Sauerstoffarmes Blut kommt vom Körperkreislauf in den rechten Vorhof, von dort ins Cavum venosum und weiter ins Cavum pulmonale (blaue Pfeile in der rechten Abbildung).[10] Das sauerstoffreiche Blut fließt über Cavum arteriosum und Cavum venosum in die beiden Aorten und damit in den Körperkreislauf.[15]
Durch den gemeinsamen Ventrikel ist es den Reptilien möglich, mit einem Shunt (deutsch: Abzweig, Nebenanschluss) bei Bedarf den Lungen- oder Körperkreislauf zu umgehen. Die Regulation dieser Vorgänge ist noch nicht völlig verstanden, vermutlich unterscheidet sie sich von Art zu Art. Ein Rechts-links-Shunt bewirkt, dass der Lungenkreislauf umgangen wird und Blut vom Körperkreislauf im Herzen wieder in den Körperkreislauf geleitet wird. Dies geschieht in bei Reptilien häufig vorkommenden Atempausen. Auch bei Reptilien, die unter Wasser ruhen, treten sie auf.[10]
Bei den Crocodilia ist der Ventrikel vollständig geteilt, dass wie bei Säugern und Vögeln ein vierkammeriges Herz (besser: ein Herz mit vier Höhlen, ein vierkavitäres Herz, von lateinisch cavum = Höhle, als Oberbegriff von Vorhof und Kammer) vorliegt. Im Gegensatz zu diesen sind jedoch der Lungenkreislauf und der Körperkreislauf nicht vollständig getrennt, so dass Blut zwischen den beiden verschoben werden kann. Sauerstoffreiches Blut kommt von der Lunge in den linken Vorhof und in den linken Ventrikel. Hier entspringt die rechte Aorta, die den vorderen Körper mit dem Gehirn versorgt. Sauerstoffarmes Blut kommt über die Körpervene in den rechten Vorhof und weiter in den rechten Ventrikel. Hier entspringt sowohl die linke Aorta, die den Hinterleib versorgt, als auch die Lungenarterie. Bei Luftatmung und körperlicher Aktivität ist der Druck im linken Ventrikel höher als im rechten. Dadurch ist auch der Druck in der linken Aorta höher als in der rechten. Durch zwei Verbindungen zwischen linker und rechter Aorta strömt dadurch sauerstoffreiches Blut auch in die hintere Körperhälfte. Das sauerstoffarme Blut landet dagegen weitgehend in der Lunge.[10]
Jene Reptilien, bei denen die Trennung des Ventrikels in zwei Hälften besonders ausgeprägt ist, erreichen höhere Stoffwechselraten als andere. Bei Waranen mit ihrer zusätzlichen Muskelleiste (siehe Abbildung) kann sie 20 Milliliter Sauerstoff pro Minute pro Kilogramm Körpergewicht betragen, während Schildkröten nur 10 Milliliter erreichen. Daraus wird geschlossen, dass die Entwicklung vollständig getrennter Kammern wichtig für die hohen Stoffwechselraten der Säuger und Vögel war.[12]
Säugetiere und Vögel
Bei Säugetieren und Vögeln sind linke und rechte Herzhälfte vollständig voneinander getrennt. Im Gegensatz zu den Crocodilia sind bei ihnen aber auch Lungen- und Körperkreislauf vollständig getrennt, so dass in beiden unterschiedlich hohe Drücke aufgebaut werden können. Auch eine Vermischung von sauerstoffarmem und sauerstoffreichem Blut ist ausgeschlossen. Beide Herzhälften haben einen dünnwandigen Vorhof und einen dickwandigen Ventrikel, so dass insgesamt vier Herzhöhlen vorhanden sind. Diese haben verglichen mit anderen Wirbeltieren recht glatte innere Wände.[10]
Die rechte Herzhälfte pumpt das Blut durch den Lungenkreislauf („kleiner Kreislauf“), wonach es sauerstoffreich im linken Vorhof ankommt. Die linke Herzhälfte befördert das Blut durch den Körperkreislauf („großer Kreislauf“), an dessen Ende es wieder im rechten Vorhof landet.
Da der Gesamtgefäßwiderstand sowie der Blutdruck im Körperkreislauf erheblich größer sind als im Lungenkreislauf, muss die linke Herzkammer eine entsprechend größere Arbeit (Herzarbeit) gegen diesen Widerstand verrichten und weist daher eine deutlich stärkere Wanddicke auf als die rechte. Auch bei unterschiedlichen Füllungsvolumina der vier Herzhöhlen müssen die Schlagvolumina in beiden Herzkammern und in beiden Vorhöfen bei jedem Herzschlag gleich sein. Diese Gleichheit wird gegebenenfalls durch verschiedene Ejektionsfraktionen gewährleistet. Herzklappen zwischen den Vorhöfen und den Ventrikeln sowie am Ausgang der Ventrikel verhindern einen Rückfluss von Blut[10] (siehe auch Blutkreislauf der Vögel und Säugetiere).
Das Herz der Säugetiere unterscheidet sich bei den verschiedenen Arten nur wenig, abgesehen von einer Größenanpassung. Dabei haben einzelne Herzmuskelzellen der verschiedenen Arten wiederum kaum Unterschiede in Morphologie und Größe. Die Herzmasse steigt bei den Säugern linear mit der Körpermasse an, sie beträgt in der Regel 0,6 % der Körpermasse. Entsprechend steigt auch das Schlagvolumen linear. Das größte Herz hat der Blauwal, der bei einem Körpergewicht von 100 Tonnen ein Herzgewicht von 600 kg und ein Schlagvolumen von 350 Litern erreicht. Seine Herzfrequenz liegt in Ruhe bei 6 Schlägen pro Minute und kann bei einem Tauchgang auf 2 bis 3 Schläge pro Minute abfallen. Das wohl kleinste Säugerherz hat die Etruskerspitzmaus. Bei einem Körpergewicht von 2 g betragen das Herzgewicht 12 mg und das Schlagvolumen 1,2 µl. Die Ruheherzfrequenz von 800 bis 1200 Schlägen pro Minute (= 13 bis 20 Schläge pro Sekunde) kann bei körperlicher Anstrengung bis auf 1500 Schläge pro Minute (25 Schläge pro Sekunde) gesteigert werden.
Der vom linken Ventrikel aufgebaute Blutdruck im Körperkreislauf ändert sich dagegen nur wenig, er liegt unabhängig von der Körpergröße zwischen 100 und 150 mmHg systolisch und zwischen 70 und 105 mmHg diastolisch (siehe Tabelle).[13][16]
Auch bei den Säugetieren besteht ein allometrischer Zusammenhang zwischen Herzfrequenz und Körpermasse. Der Exponent b beträgt hier −0,25, ähnlich dem der Vögel, die Herzfrequenz nimmt also mit zunehmender Körpermasse ab. Dies wird mit der Stoffwechselrate erklärt, die mit zunehmender Körpermasse ebenfalls allometrisch abnimmt (b= 3/4). Der zeitliche Abstand von der Erregung der Vorhöfe bis zur Erregung der Ventrikel (PQ-Intervall, siehe unten) steigt ebenfalls allometrisch mit b=1/4.[17][18]
Eine Ausnahme in mehrerlei Hinsicht ist die Giraffe, die auf Grund des Höhenunterschieds von etwa zwei Metern zwischen Herz und Gehirn einen höheren Blutdruck benötigt. Je nach Quelle liegt dieser bei 300/230 oder 280/180 mmHg und ist damit der höchste aller Säugetiere. Um den hohen Druck aufzubauen, liegt die Herzfrequenz bei für Tiere dieser Größe ebenfalls sehr ungewöhnlichen 170 Schlägen pro Minute (siehe auch: Giraffe#Herz-Kreislauf-System.)[10][14]
Auf Grund der Ähnlichkeit der Herzen der verschiedenen Säugetierarten kann das unten dargestellte menschliche Herz als Modell für alle Säugerherzen gelten.
Lage und Aufbau des menschlichen Herzens
| Einige Kennzahlen des menschlichen Herzens (Durchschnittswerte) | |
|---|---|
| Länge | 15 cm |
| Gewicht | 300 g |
| Schlagvolumen | 70 cm³ pro Schlag |
| Herzzeitvolumen (HZV) in Ruhe | 4,9 Liter/Minute |
| HZV bei großer Anstrengung | 20–25 Liter/Minute |
| Arbeit (Herzarbeit) | 0,8 Joule pro Schlag (linke Kammer) 0,16 Joule pro Schlag (rechte Kammer) 100.000 Joule pro Tag (gesamt) |
Lage
Das Herz liegt innerhalb des Herzbeutels (Perikard) im Mediastinum: Seitlich grenzen, getrennt durch parietale und viszerale Pleura (Brustfell), die linke und rechte Lunge an das Herz. Unten sitzt das Herz dem Zwerchfell auf, das mit dem Herzbeutel verwachsen ist. Oberhalb teilt sich die Luftröhre (Trachea) in die beiden Hauptbronchien (Bifurcatio tracheae), von denen der linke vom Aortenbogen überquert wird. Unterhalb dieser Aufteilung befindet sich der linke Herzvorhof. Wenn dieser krankhaft vergrößert ist, kann das zu einer Spreizung der Hauptbronchien führen, was sich im Röntgenbild als vergrößerter Winkel zwischen den Bronchien darstellt. Der linke Vorhof steht außerdem nach hinten in direktem Kontakt mit der Speiseröhre. Vor dem Herzen befindet sich das Brustbein (Sternum), im oberen Bereich liegt es vor den abgehenden großen Gefäßen. Zwischen Brustbein und Herz liegt der Thymus.
Das Herz liegt also praktisch direkt hinter der vorderen Leibeswand in Höhe der zweiten bis fünften Rippe. Die Herzbasis oben reicht nach rechts etwa zwei Zentimeter über den rechten Brustbeinrand hinaus. Unten kommt die Herzspitze knapp an eine gedachte senkrechte Linie heran, die durch die Mitte des linken Schlüsselbeins verläuft (linke Medioklavikularlinie).
Anatomie

Die Gestalt des Herzens gleicht einem abgerundeten Kegel, dessen Spitze nach unten und etwas nach links vorne weist. Das Herzvolumen entspricht ungefähr dem Volumen der geschlossenen Faust[19] des betreffenden Menschen. Das Herz sitzt beim Menschen in der Regel leicht nach links versetzt hinter dem Brustbein. In seltenen Fällen ist es nach rechts versetzt (die sogenannte Dextrokardie – „Rechtsherzigkeit“), meist bei Situs inversus (also bei spiegelverkehrter Organanordnung).
Das gesunde Herz wiegt etwa 0,5 % des Körpergewichts, beim Mann zwischen 280 und 340 Gramm, bei der Frau zwischen 230 und 280 Gramm. Über den größten Teil des Lebens nimmt die Herzmasse kontinuierlich zu, wobei es bei dauerhafter Belastung eher mit der (risikoarmen) Vergrößerung schon bestehender Herzmuskelzellen reagiert: ab etwa 500 g, dem so genannten kritischen Herzgewicht, erhöht sich das Risiko einer Mangelversorgung des nunmehr vergrößerten Herzens mit Sauerstoff, da die versorgenden Herzkranzgefäße nicht in gleichem Maße mitwachsen.[20]
Entgegen früheren Annahmen bildet der Mensch im Lauf seines Lebens neue Herzmuskelzellen, allerdings nur in begrenztem Ausmaß. Im Alter von 25 Jahren beträgt die jährliche Regeneration etwa ein Prozent, bis zum 75. Lebensjahr fällt sie auf unter 0,5 Prozent. Während einer durchschnittlichen Lebensspanne werden damit weniger als 50 % der Herzmuskelzellen ersetzt.[21]
Wandschichten
Das Herz wird vollständig vom bindegewebigen Herzbeutel (Perikard, Pericardium fibrosum) umschlossen. Die untere Seite des Herzbeutels ist mit dem Zwerchfell (Diaphragma) verwachsen, so dass die Bewegungen des Zwerchfells bei der Atmung auf das Herz übertragen werden. Die innerste Schicht des Herzbeutels (Pericardium serosum) schlägt am Abgang der großen Blutgefäße (s. u.) in das Epikard um, das dem Herzen direkt aufliegt. Zwischen Perikard und Epikard liegt ein mit 10–20 ml Flüssigkeit gefüllter kapillärer Spaltraum, der reibungsarme Verschiebungen des Herzens im Herzbeutel ermöglicht.
Diese komplizierten Verhältnisse werden anschaulicher, wenn man sich den Herzbeutel als einen mit Luft gefüllten und verschlossenen Luftballon vorstellt. Die eigene zur Faust geschlossene Hand stellt das Herz dar. Drückt man den Luftballon mit der Faust so weit ein, dass sie vom Ballon vollständig umschlossen wird, so liegt eine Schicht des Luftballons der Faust (dem „Herzen“) direkt an. Diese Schicht, die dem Epikard entspricht, schlägt am Übergang zum Arm in eine äußere Schicht um. Diese äußere Schicht entspricht dem Perikard. Zwischen beiden befindet sich ein mit Luft gefüllter Raum, der dem flüssigkeitsgefüllten Spaltraum des Herzbeutels vergleichbar ist.
Unter dem Epikard befindet sich eine Fettschicht (Tela subepicardiaca), in der die Herzkranzgefäße verlaufen. Nach innen hin folgt die dicke Muskelschicht (Myokard) aus spezialisiertem Muskelgewebe, das nur im Herzen vorkommt. Die Herzinnenräume werden vom Endokard ausgekleidet, das auch die Herzklappen bildet.
Die Wanddicke der linken Hauptkammer wird im Rahmen der Herzultraschall-Untersuchung üblicherweise im Bereich von Septum und Hinterwand bestimmt. Normal sind hierbei Messwerte zwischen 6 und 11 mm, im Mittel 9 mm. Beim Ausdauersportler wird eine Wanddicke von unter 15 mm noch als normal angesehen, bei Sportlern mit Widerstandstraining (Gewichtheben) können auch höhere Werte vorkommen. Die Wandstärke der anderen Herzhöhlen ist deutlich geringer und wird standardisiert nicht bestimmt.[22]
Räume und Gefäße des Herzens

Rechte und linke Herzhälfte bestehen jeweils aus einer Kammer (lat. Ventriculus cordis, (Herz-)Ventrikel, kurz RV und LV) und einem Vorhof (Atrium, RA und LA). Getrennt werden diese Räume durch die Herzscheidewand (Septum). Diese wird in die Vorhofscheidewand (Septum interatriale, Vorhofseptum) und die Kammerscheidewand (Septum interventriculare, Ventrikelseptum) unterteilt. Außen ist die Grenze zwischen Herzkammern und Vorhöfen durch die Herzkranzfurche (Sulcus coronarius) ersichtlich, in welcher die Herzkranzgefäße verlaufen. Die Grenze zwischen beiden Herzkammern ist von außen durch zwei Furchen – Sulcus interventricularis subsinuosus und Sulcus interventricularis paracoronalis sichtbar. In den Herzkammern bildet die Herzmuskulatur netzartige kleine, in das Innere hineinragende Bälkchen, die als Fleischbalken (Trabeculae carneae, Singular Trabecula carnea) bezeichnet werden.
Das Blut kann zwischen den Herzräumen nur in eine Richtung fließen, da sich zwischen den Vorhöfen und den Kammern sowie zwischen den Kammern und den sich anschließenden Gefäßen Herzklappen befinden, die wie Rückschlagventile arbeiten. Alle vier Klappen des Herzens befinden sich ungefähr in einer Ebene, der Ventilebene, und sind gemeinsam an einer Bindegewebsplatte, dem Herzskelett, aufgehängt. Innerhalb der Kammern und Vorhöfe finden sich Muskelzüge, die in die Hohlräume hervorragen – die Papillarmuskeln und die Musculi pectinati.
Arterien transportieren das Blut vom Herzen zu den Organen, Venen von den Organen zum Herzen. Arterien des Körperkreislaufs führen sauerstoffreiches (arterielles) Blut, während Arterien des Lungenkreislaufs sauerstoffarmes (venöses) Blut führen. Umgekehrt ist das Blut in den Venen des Körperkreislaufs sauerstoffarm (venös) und das der Lungenvenen sauerstoffreich (arteriell).
In den rechten Vorhof münden die obere und untere Hohlvene (Vena cava superior und inferior). Sie führen das sauerstoffarme Blut aus dem großen Kreislauf (Körperkreislauf) dem Herzen zu. Zwischen rechtem Vorhof und rechter Kammer befindet sich die Trikuspidalklappe, die bei der Kammerkontraktion einen Rückstrom des Blutes in den Vorhof verhindert. Von der rechten Herzkammer aus fließt das Blut über einen gemeinsamen Stamm (Truncus pulmonalis) in die beiden Lungenarterien. Der Rückfluss in die rechte Kammer wird durch die taschenförmige Pulmonalklappe verhindert. Die Lungenarterien führen das sauerstoffarme Blut dem Lungenkreislauf (kleiner Kreislauf) zu.
Durch meist vier Lungenvenen fließt das in der Lunge mit Sauerstoff angereicherte Blut in den linken Vorhof. Von hier aus gelangt es über eine weitere Segelklappe, die Mitralklappe, zur linken Kammer. Der Ausstrom erfolgt durch den sogenannten linksventrikulären Ausflusstrakt (LVOT) über eine weitere Taschenklappe (Aortenklappe) und die Hauptschlagader (Aorta) in den Körperkreislauf.
Herzkranzgefäße

Aus dem Anfangsteil der Aorta entspringen die rechte und linke Herzkranzarterie (Koronararterien). Sie versorgen den Herzmuskel selbst mit Blut. Die Herzkranzarterien sind so genannte „funktionelle Endarterien“. Dies bedeutet, dass eine einzelne Arterie zwar mit anderen Arterien verbunden ist (Anastomosen), dass diese Verbindungen jedoch zu schwach sind, um bei Mangelversorgung eine Durchblutung des Gewebes auf einem anderen Weg zu gewährleisten. Fällt also eine Arterie aufgrund einer Blockade oder einer anderen Störung aus, kommt es in dem von dieser Arterie versorgten Gebiet zu einem Absterben von Gewebe.
Die linke Koronararterie (Arteria coronaria sinistra, left coronary artery, LCA) versorgt die Herzvorderseite. Sie teilt sich in einen Ramus interventricularis anterior (RIVA, left anterior descending, LAD) und einen Ramus circumflexus (RCX).
Die rechte Koronararterie (Arteria coronaria dextra, right coronary artery, RCA) gibt die A. marginalis dextra ab, welche die freie Wand der rechten Herzkammer versorgt. Am „Herzkreuz“ (Crux cordis) teilt sie sich in den Ramus interventricularis posterior und den Ramus posterolateralis dexter. Die rechte Koronararterie versorgt auch einen wichtigen Teil des Erregungssystems (Sinusknoten, Atrioventrikularknoten).
Es gibt drei große Koronarvenen, die in den Sinus coronarius des rechten Vorhofs münden und das sauerstoffarme Blut aus dem Herzmuskel abführen. Die große Herzvene (V. cordis magna) verläuft auf der Vorderseite, die mittlere Herzvene (V. cordis media) auf der Hinterseite und die V. cordis parva am rechten Herzrand. Ein kleiner Teil des sauerstoffarmen Blutes wird über die Thebesius-Venen direkt in die Ventrikel entleert.
Entwicklung
Das Herz beginnt sich beim Menschen schon in der 3. Woche der Embryonalentwicklung zu bilden. Dazu lagern sich Angioblasten (Blutgefäßbildungszellen) vor und seitlich der Prächordalplatte an – der Beginn der Gefäßentwicklung (Vaskulogenese). Sie bilden zunächst mehrere kleinere Hohlräume (Sinus), die schließlich zum hufeisenförmigen Herzschlauch verschmelzen. Die Anlage wandert dann kaudoventral (nach unten und in Richtung Bauch). Um den Herzschlauch herum liegt embryonales Bindegewebe (Mesenchym) aus der Splanchopleura (Seitenplattenmesoderm), welches die Herzmuskulatur (Myokard) bildet. Das Epikard – der dünne Überzug des Herzens – entsteht aus Mesothelzellen.
Der primitive Herzschlauch besteht aus folgenden Anteilen:
- Truncus arteriosus
- Bulbus cordis primitivus
- Ventriculus primitivus
- Atrium primitivum
- Sinus venosus
Am 23. oder am 24. Tag beginnt das Herz mit peristaltischen Kontraktionen und damit mit Pumpbewegungen.
Man unterscheidet am fetalen Herzen eine Einstrom- von einer Ausstrombahn. In den Sinus venosus fließen die Dottersackvenen (Vv. vitellinae), die das Blut vom Dottersack in den Embryonalkreislauf leiten, die Nabelvene (V. umbilicalis), die sauerstoffreiches Blut aus den Chorionzotten führt, und die Kardinalvenen (Vv. cardinales anteriores et posteriores), welche das Blut aus dem eigentlichen Embryonalkreislauf enthalten und es wieder zurückführen, ein. Die Ausstrombahn erhält erst Anschluss an die Kiemenbogenarterien, später an den Aortenbogen bzw. den Truncus pulmonalis.
Wichtige Prozesse im Rahmen der Entwicklung sind die Bildung des Cor sigmoideum (vom Schlauch zur Schleife) und die Trennung in zwei getrennte Kreisläufe (Körper- und Lungenkreislauf). Weiter werden das Atrium primitivum in einen rechten und einen linken Vorhof (durch Auswachsen von Endokardkissen) und der Ventriculus primitivus in eine rechte und eine linke Herzkammer (durch Bildung des muskulösen und membranösen Septums) unterteilt.
Die Segelklappen (zwischen Vorhöfen und Kammern) bilden sich ebenfalls aus auswachsenden Endokardkissen, die Taschenklappen durch Bildung von Endothelwülsten.
Funktionsweise des menschlichen Herzens

Erregungsbildungs- und Erregungsleitungssystem
Die Kontraktion von Herzmuskelfasern wird durch elektrische Signale ausgelöst. Bei einem myogenen Herzen wie dem menschlichen werden die für die Herzaktion nötigen Impulse spontan und rhythmisch in spezialisierten Herzmuskelzellen erzeugt, den Schrittmacherzellen. Damit sich die elektrische Erregung über das Herz ausbreiten kann, sind die einzelnen Herzmuskelzellen über kleine Poren in ihren Zellmembranen miteinander verbunden. Über diese Gap Junctions fließen Ionen von Zelle zu Zelle. Dabei nimmt die Erregung im Sinusknoten zwischen oberer Hohlvene und rechtem Herzohr ihren Ursprung, breitet sich erst über beide Vorhöfe aus und erreicht dann über den Atrioventrikularknoten (AV-Knoten) in der Ventilebene die Kammern.
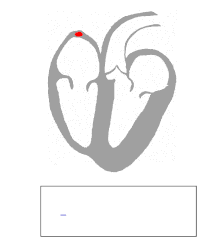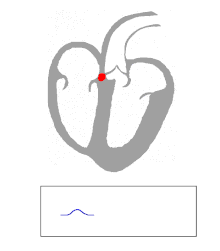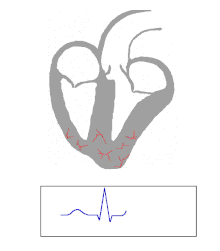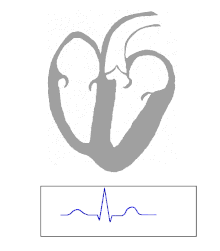
In den beiden Herzkammern gibt es ein Erregungsleitungssystem zur schnelleren Fortleitung, das aus spezialisierten Herzmuskelzellen besteht. Diese Zellen bilden vom AV-Knoten ausgehend das His-Bündel, das das Herzskelett durchbohrt und sich in einen rechten und einen linken Tawara-Schenkel für die rechte und die linke Kammer aufteilt. Der linke Tawara-Schenkel teilt sich in ein linkes vorderes und ein linkes hinteres Bündel. Die Endstrecke des Erregungsleitungssystems wird durch Purkinje-Fasern gebildet, die bis zur Herzspitze verlaufen, dort umkehren und direkt unter dem Endokard in der Arbeitsmuskulatur enden. Zum Teil können sie auch als „falsche Sehnenfäden“ (Chordae tendineae spuriae) oder innerhalb der Moderatorbänder (Trabeculae septomarginales) durch die Lichtung der Kammer ziehen. Dieses System ermöglicht den Kammern, sich trotz ihrer Größe koordiniert zu kontrahieren.
Erreichen den AV-Knoten aus irgendeinem Grunde keine Vorhoferregungen, so geht von ihm selbst eine langsamere Kammererregung aus (ca. 40/min). Der AV-Knoten bildet auch einen Frequenzfilter, der zu schnelle Vorhoferregungen (z. B. bei Vorhofflattern oder -flimmern) abblockt (→ AV-Block).
Mechanik der Herzaktion

Das menschliche Herz pumpt in Ruhe etwa das gesamte Blutvolumen des Körpers einmal pro Minute durch den Kreislauf, das sind bei Erwachsenen etwa fünf Liter pro Minute. Bei körperlicher Belastung kann die Pumpleistung etwa auf das Fünffache gesteigert werden, wobei sich der Sauerstoffbedarf entsprechend erhöht. Diese Steigerung wird durch eine Verdoppelung des Schlagvolumens und eine Steigerung der Herzfrequenz um den Faktor 2,5 erreicht.
Bei jeder Pumpaktion fördert jede Kammer und jeder Vorhof etwas mehr als die Hälfte des maximalen Füllungsvolumens, also etwa 50–100 ml Blut. Das ist die Ejektionsfraktion, also der prozentuale Anteil am enddiastolischen Füllungsvolumen, welcher aus der Herzhöhle herausgeworfen wird. Die Herzfrequenz (Schläge/Minute) beträgt in Ruhe 50–80/min (bei Neugeborenen über 120–160) und kann unter Belastung auf über 200/min ansteigen. Liegt ein zu langsamer Herzschlag vor (unter 60/min im Ruhezustand), wird von einer Bradykardie gesprochen. Schlägt das Herz zu schnell (bei Erwachsenen über 100/min im Ruhezustand), spricht man von einer Tachykardie.
Während eines Herzzyklus füllen sich zunächst die Vorhöfe, während gleichzeitig die Kammern das Blut in die Arterien auswerfen. Wenn sich die Kammermuskulatur entspannt, öffnen sich die Segelklappen und das Blut fließt, gesaugt durch den Druckabfall in den Kammern, aus den Vorhöfen in die Kammern. Unterstützt wird dies durch ein Zusammenziehen der Vorhöfe (Vorhofsystole). Es folgt die Kammersystole. Hierbei zieht sich die Kammermuskulatur zusammen, der Druck steigt an, die Segelklappen schließen sich und das Blut kann nur durch die nun geöffneten Taschenklappen in die Arterien ausströmen. Ein Rückfluss des Blutes aus den Arterien während der Entspannungsphase (Diastole) wird durch den Schluss der Taschenklappen verhindert. Die Strömungsrichtung wird also allein durch die Klappen bestimmt.


Neben der Muskulatur, dem weitaus größten Teil der Gewebemasse des Herzens, besitzt das Herz ein sogenanntes Herzskelett. Es handelt sich hier um eine bindegewebige Struktur, die hauptsächlich aus den „Einfassungen“ der Ventile besteht. Das Herzskelett hat drei wichtige Funktionen: Es dient als Ansatz für die Muskulatur, als Ansatz für die Herzklappen (daher auch als Ventilebene bezeichnet) und zur elektrischen Trennung von Vorhof- und Kammermuskulatur, um eine gleichzeitige Kontraktion zu verhindern.
Das Herzskelett ist ausschlaggebend für die Mechanik der Herzaktion: Aufgrund des Rückstoßes bei der Blutaustreibung ist die Herzspitze im Laufe des gesamten Herzzyklus relativ fixiert und bewegt sich kaum. Somit wird folglich bei einer Kontraktion der Kammermuskulatur (Systole) die Ventilebene nach unten in Richtung der Herzspitze gezogen. In der Erschlaffungsphase der Kammermuskulatur (Diastole) bewegt sich die Ventilebene wieder in Richtung Herzbasis.
Bei der Senkung der Ventilebene wird somit zum einen das Blut aus der Kammer in den Kreislauf ausgeworfen und zum anderen vergrößert sich auch der zugehörige Vorhof. Es kommt zu einem Unterdruck, wodurch Blut aus den großen Venen in die Vorhöfe strömt. Bei der Erschlaffung der Kammermuskulatur hebt sich nun die Ventilebene, wodurch die Kammern passiv über die Blutsäulen der Vorhöfe ausgedehnt werden und sich dadurch zu etwa 70–80 % füllen. Die anschließende Kontraktion der Vorhöfe pumpt nun das restliche Blut in die Kammern und leitet somit einen neuen Herzzyklus ein. Die Vorhofkontraktion ist daher nicht zwingend für das Funktionieren des Herzens nötig, was sich auch daran zeigt, dass (im Gegensatz zum Kammerflimmern) Patienten mit Vorhofflimmern durchaus lebensfähig sind.
Ein etwa mit einem Pulmonaliskatheter gemessener erniedrigter Druck im rechten Vorhof kann auf ein unzureichendes Blutvolumen oder eine Sepsis, ein erhöhter auf einen kardiogenen Schock, einen rechtsventrikulären Herzinfarkt, eine Lungenembolie oder eine Herzbeuteltamponade hinweisen.[23]
Regulation
Bei körperlicher Belastung wird die Herzleistung durch die Einwirkung sympathischer Nervenfasern gesteigert, die an den Zellen der Arbeitsmuskulatur und auch des Erregungsleitungssystems den Transmitter Noradrenalin freisetzen. Zusätzlich erreicht Noradrenalin zusammen mit Adrenalin das Herz als Hormon über die Blutbahn. Die Wirkung von Noradrenalin und Adrenalin wird überwiegend über β1-Adrenozeptoren vermittelt. Dieser ist G-Protein-gekoppelt und aktiviert eine Adenylatcyclase (AC), welche die Synthese von cAMP aus ATP katalysiert. Daraufhin phosphoryliert eine cAMP-abhängige Proteinkinase (PKA) Calciumkanäle und erhöht dadurch den langsamen Einstrom von Calcium in die Muskelzelle. Dies führt zur Ausschüttung von weiterem Calcium aus dem Sarkoplasmatischen Retikulum (SR) und damit zur gesteigerten Muskelkontraktion des Herzens während der Systole (positiv inotroper Effekt). Außerdem phosphoryliert die PKA das Phospholamban des SR, wodurch die Calciumaufnahme ins SR erhöht wird und die Relaxationszeit des Herzens in der Diastole verkürzt wird (positiv lusitroper Effekt).[24] Zudem steigen die Herzfrequenz (positiv chronotrop) und die Überleitungsgeschwindigkeit im AV-Knoten (positiv dromotrop) an.
Der Gegenspieler des Sympathikus ist auch am Herzen der Parasympathikus, welcher über den Nervus vagus (X. Hirnnerv) wirkt, der mit dem Transmitter Acetylcholin die Herzfrequenz, die Kontraktionskraft des Herzens, die Überleitungsgeschwindigkeit des AV-Knotens und die Erregbarkeit des Herzens herabsetzt (negativ chronotrop, negativ inotrop, negetiv dromotrop und negativ bathmotrop), wobei die Wirkung des Parasympathikus auf die Ino- und Bathmotropie eher gering ist.
Gleichzeitig passt sich die Kontraktionskraft (Herzkraft) automatisch den Erfordernissen an: Wird der Herzmuskel durch zusätzliches Blutvolumen stärker gedehnt, so verbessert sich dadurch die Funktion der kontraktilen Elemente in den Muskelzellen (Frank-Starling-Mechanismus). Dieser Mechanismus trägt wesentlich dazu bei, dass sich die gleichzeitigen Schlagvolumina von rechter und linker Kammer nicht unterscheiden: Erhöht sich aus irgendeinem Grund kurzfristig das Schlagvolumen einer Herzhälfte, so führt dies zu einer Vergrößerung des Füllungsvolumens der anderen Herzhälfte bei der folgenden Herzaktion. Dadurch wird die Wand stärker gedehnt und die Kammer kann mit verbesserter Kontraktionskraft ebenfalls ein größeres Blutvolumen auswerfen. Bei jeder Herzaktion ist in allen vier Herzhöhlen das Produkt aus enddiastolischem Füllungsvolumen und zugehöriger Netto-Ejektionsfraktion notwendigerweise konstant. Gäbe es diese Gleichheit der vier Schlagvolumina nicht, käme es sofort zum Blutstau.
Das Herz produziert in seinen Vorhöfen (vor allem im rechten Vorhof) auch dehnungsabhängig ein harntreibendes Hormon, das atriale natriuretische Peptid (ANP), um Einfluss auf das zirkulierende Blutvolumen zu nehmen.
Erkrankungen
In der Medizin beschäftigt sich die Kardiologie als Spezialgebiet der Inneren Medizin mit dem Herzen und der konservativen Behandlung der Herzerkrankungen bei Erwachsenen; Operationen am Herzen werden von Herzchirurgen durchgeführt. Herzerkrankungen von Kindern sind, soweit konservativ therapierbar, Gegenstand der Kinderkardiologie, welche sich als Teilgebiet der Pädiatrie seit etwa 1975 entwickelt hat. Die operative Therapie bei Kindern wird, zumindest in Deutschland, von der als Spezialisierung etablierten Kinderherzchirurgie übernommen. Da seit etwa 1995 zunehmend Kinder mit komplexen angeborenen Herzfehlern das Erwachsenenalter erreichen, stellt sich heute die Frage der medizinischen Versorgung für diesen Patientenkreis, der lebenslang auf kardiologische Kontrolluntersuchungen angewiesen ist und bei dem eventuell auch Re-Operationen anstehen. Erst vereinzelt haben sich bisher Erwachsenenkardiologen intensiv auf dem Gebiet der angeborenen Herzfehler fortgebildet. Kinderkardiologen sind zwar sehr kompetent im Bereich der verschiedenen Krankheitsbilder, jedoch als Pädiater nicht im Bereich der Erwachsenkardiologie ausgebildet. Deshalb werden heute zunehmend interdisziplinäre Sprechstunden in verschiedenen Herzzentren angeboten.
Siehe auch
Literatur
- Ole Martin Høystad: Kulturgeschichte des Herzens. Von der Antike bis zur Gegenwart. Aus dem Norwegischen von Frank Zuber. Böhlau, Köln / Weimar / Wien 2006, ISBN 3-412-28705-9
- Susanne Hahn: Herz. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/New York 2005, ISBN 3-11-015714-4, S. 581 ff.
- Charles Reginald Schiller Harris: The heart and the vascular system in ancient Greek medicine from Alcmaeon to Galen. Oxford 1973.
- Friedrich Wilhelm Hehrlein: Herz und große Gefäße. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen: Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 164–185.
- Das Herz (Gedächtnisschrift für Ernst Boehringer). 3 Bände. Dr. Karl Thomae GmbH, Biberach an der Riß 1965–1969.
- Wolfgang Bargmann, Wilhelm Doerr: Das Herz des Menschen. Thieme, Stuttgart 1963.
- Herbert Reindell, Helmut Klepzig: Krankheiten des Herzens und der Gefäße. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 450–598.
- T. East: The Story of Heart Disease. Dawson, London 1958.
- Allan Burns: Observations on some of the most frequent and important diseases of the heart. Edinburgh 1809.
Weblinks
- Literatur von und über Herz im Katalog der Deutschen Nationalbibliothek
- Introduction to Cardiothoracic Imaging
- HM Sommer: Herz ( vom 11. Juni 2007 im Internet Archive; PDF; 2,7 MB)
Animationen
- 3-dim. Animation des schlagendes Herzens mit vielen Infos
- 2-dim. Animation des schlagenden Herzens mit Diagrammen (englisch)
Institutionen
- dgk-herzfuehrer.de – Deutsche Gesellschaft für Kardiologie
- Deutschen Gesellschaft für Thorax-, Herz- und Gefäßchirurgie
Einzelnachweise
- ↑ Das Herkunftswörterbuch (= Der Duden in zwölf Bänden. Band 7). Nachdruck der 2. Auflage. Dudenverlag, Mannheim 1997 (S. 283). Siehe auch Herz. In: Digitales Wörterbuch der deutschen Sprache. Abgerufen am 30. August 2019 und Friedrich Kluge: Etymologisches Wörterbuch der deutschen Sprache. 7. Auflage. Trübner, Straßburg 1910 (S. 206).
- ↑ Wolfgang Piper: Innere Medizin. Springer-Verlag, Heidelberg 2007, ISBN 978-3-540-33725-6, S. 77.
- ↑ Jutta Kollesch, Diethard Nickel: Antike Heilkunst. Ausgewählte Texte aus dem medizinischen Schrifttum der Griechen und Römer. Philipp Reclam jun., Leipzig 1979 (= Reclams Universal-Bibliothek. Band 771); 6. Auflage ebenda 1989, ISBN 3-379-00411-1, S. 23 und 184, Anm. 14.
- ↑ Jutta Kollesch, Diethard Nickel: Antike Heilkunst. […]. 1989, S. 23.
- ↑ Jutta Kollesch, Diethard Nickel: Antike Heilkunst. […]. 1989, S. 183 f.
- ↑ Christopher D. Moyes, Patricia M. Schulte: Tierphysiologie. Pearson Studium, München 2008, ISBN 978-3-8273-7270-3, S. 6–7 (eingeschränkte Vorschau in der Google-Buchsuche – englisch: Principles of Animal Physiology. Übersetzt von Monika Niehaus, Sebastian Vogel).
- ↑ Hans H. Lauer: Geschichtliches zur Koronarsklerose. BYK Gulden, Konstanz 1971 (Aus dem Institut für Geschichte der Medizin der Universität Heidelberg), S. 4–9.
- ↑ a b c d e f g h Heinz Penzlin: Lehrbuch der Tierphysiologie. 7. Auflage. Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-2114-2, S. 339–351.
- ↑ a b c d e f g h i j Adolf Remane, Volker Storch, Ulrich Welsch: Kurzes Lehrbuch der Zoologie. 5. Auflage. Gustav Fischer Verlag, Stuttgart 1985, ISBN 3-437-20337-1, S. 188 f.
- ↑ a b c d e f g h i j k l m n o p q Christopher D. Moyes, Patricia M. Schulte: Tierphysiologie. Pearson Studium, München 2008, ISBN 978-3-8273-7270-3, S. 379–394 (eingeschränkte Vorschau in der Google-Buchsuche – englisch: Principles of Animal Physiology. Übersetzt von Monika Niehaus, Sebastian Vogel).
- ↑ J. D. Glenn, J. G. King, J. F. Hillyer: Structural mechanics of the mosquito heart and its function in bidirectional hemolymph transport. In: Journal of Experimental Biology. 213, 2010, S. 541, doi:10.1242/jeb.035014.
- ↑ a b c d e f g h Heinz Penzlin: Lehrbuch der Tierphysiologie. 7. Auflage. Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-2114-2, S. 314–326.
- ↑ a b G. P. Dobson: On being the right size: heart design, mitochondrial efficiency and lifespan potential. In: Clinical and experimental pharmacology & physiology. Band 30, Nummer 8, August 2003, S. 590–597, ISSN 0305-1870. PMID 12890185.
- ↑ a b c Heinz Penzlin: Lehrbuch der Tierphysiologie. 7. Auflage. Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-2114-2, S. 331.
- ↑ a b Maike Prütz et al.: Die Anatomie des Herzens der Landschildkröte (Testudinidae). In: Kleintierpraxis. Band 61, Heft 4, 2016, S. 185–194.
- ↑ F. L. Meijler, T. D. Meijler: Archetype, adaptation and the mammalian heart. In: Netherlands heart journal: monthly journal of the Netherlands Society of Cardiology and the Netherlands Heart Foundation. Band 19, Nummer 3, März 2011, S. 142–148, ISSN 1876-6250. doi:10.1007/s12471-011-0086-4. PMID 21475406. PMC 3047700 (freier Volltext).
- ↑ G. B. West, J. H. Brown: The origin of allometric scaling laws in biology from genomes to ecosystems: towards a quantitative unifying theory of biological structure and organization. In: The Journal of experimental biology. Band 208, Pt 9, Mai 2005, S. 1575–1592, ISSN 0022-0949. doi:10.1242/jeb.01589. PMID 15855389. (Review).
- ↑ S. F. Noujaim, E. Lucca, V. Muñoz, D. Persaud, O. Berenfeld, F. L. Meijler, J. Jalife: From mouse to whale: a universal scaling relation for the PR Interval of the electrocardiogram of mammals. In: Circulation. Band 110, Nummer 18, November 2004, S. 2802–2808, ISSN 1524-4539. doi:10.1161/01.CIR.0000146785.15995.67. PMID 15505092.
- ↑ Theodor Heinrich Schiebler, Walter Schmidt: Lehrbuch der gesamten Anatomie des Menschen. Cytologie, Histologie, Entwicklungsgeschichte, Makroskopische und Mikroskopische Anatomie. 3., korrigierte Auflage. Springer, Berlin u. a., ISBN 3-540-12400-4, S. 440.
- ↑ E. Strauzenberg: Short outline of the problem of competition at altitude above 2000 m. In: The Journal of sports medicine and physical fitness. Band 16, Nummer 4, Dezember 1976, S. 346–347, ISSN 0022-4707. PMID 1011819.
- ↑ O. Bergmann, R. D. Bhardwaj, S. Bernard, S. Zdunek, F. Barnabé-Heider, S. Walsh, J. Zupicich, K. Alkass, B. A. Buchholz, H. Druid, S. Jovinge, J. Frisén: Evidence for cardiomyocyte renewal in humans. In: Science. Band 324, Nummer 5923, April 2009, S. 98–102, ISSN 1095-9203. doi:10.1126/science.1164680. PMID 19342590. PMC 2991140 (freier Volltext).
- ↑ Wilkenshoff, Kruck: Handbuch der Echokardiographie. 6. aktualisierte und erweiterte Auflage. Thieme, Stuttgart / New York 2017, ISBN 978-3-13-159666-6.
- ↑ Amitava Majumder, Anne Paschen: Ärztliche Arbeitstechniken. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 29–93, hier: S. 39 f. (Pulmonaliskatheter).
- ↑ Erland Erdmann: Klinische Kardiologie. 7. Auflage. Springer-Verlag