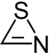Thiocyansäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Thiocyansäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | HSCN | ||||||||||||||||||
| Kurzbeschreibung |
ölige, farblose Flüssigkeit mit stechendem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 59,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Thiocyansäure (veraltet: Rhodanwasserstoffsäure) ist eine instabile chemische Verbindung mit der Summenformel HSCN. Sie ist das Schwefelanalogon der Cyansäure HOCN. Ihre Salze und Ester werden Thiocyanate genannt.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Darstellung von Thiocyansäure kann durch Reaktion von Schwefelwasserstoff mit Quecksilber(II)-cyanid erfolgen. Die Herstellung wässriger Lösungen der Säure erfolgt praktischerweise durch Zersetzung einer wässrigen Lösung von Ammoniumthiocyanat mit verdünnter Schwefelsäure.[1] Noch besser ist die Reaktion von Bariumthiocyanat mit verdünnter Schwefelsäure geeignet, da hierbei das schwerlösliche Bariumsulfat aus dem Gleichgewicht entfernt wird und nur die Thiocyansäure in Lösung verbleibt.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Thiocyansäure ist eine farblose flüchtige Verbindung, welche einen Schmelzpunkt von 5 °C besitzt. Sie ist gut in Wasser und wenigen organischen Lösungsmitteln löslich. Thiocyansäure ist instabil und nur bei niedrigen Temperaturen beständig. Wässrige Lösungen sind bis zu 5 % HSCN-Gehalt beständig und bilden eine sehr starke Säure.[6] Höhere Konzentrationen ergeben als Zersetzungsprodukte Cyanwasserstoff und Perthiocyansäure.[2][S 1] Thiocyansäure (links) liegt in einem tautomeren Gleichgewicht mit der Isothiocyansäure (rechts) vor, wobei das Gleichgewicht auf der linken Seite, also bei der Thiocyansäure liegt:[1]
Des Weiteren existiert mit dem Thiazirin[S 2] (einem Schwefelderivat des Azirins) ein heterocyclisches Thiocyansäureisomer, welches intermediär auftreten kann:[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Eintrag zu Thiocyansäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ a b c d Eintrag zu Rhodanwasserstoffsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Februar 2017. (JavaScript erforderlich)
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 1413.
- ↑ Eintrag zu Thiocyanic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Henry Enfield Roscoe, Carl Schorlemmer: The non-metallic elements. New ed. completely rev. by Sir H. E. Roscoe assisted by Drs. H. G. Colman and A. Harden. D. Appleton & Company, 1895, S. 763–764 (google.com [abgerufen am 26. April 2024]).
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 637.