Melatonin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
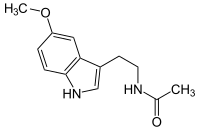
| Name | Melatonin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C13H16N2O2 | |||||||||||||||||||||
| Kurzbeschreibung |
beigefarbener Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Ersatz des auf natürlichem Wege zu wenig produzierten Hormons | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 232,28 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Melatonin ist ein Hormon, das vorwiegend von den Pinealozyten in der Zirbeldrüse (Epiphyse) – einem Teil des Zwischenhirns – aus Serotonin produziert wird und den Tag-Nacht-Rhythmus des menschlichen Körpers steuert und schlaffördernd wirkt. Es handelt sich um eine chemische Verbindung aus der Stoffgruppe der Tryptamine mit 5-Methoxyindol als Strukturelement.
Physiologie
[Bearbeiten | Quelltext bearbeiten]Allgemeines
[Bearbeiten | Quelltext bearbeiten]Melatonin ist ein Metabolit des Tryptophanstoffwechsels. Seine hauptsächliche Bildung im Gehirn, namentlich der Zirbeldrüse (Epiphyse), wird durch den circadianen Schrittmacher im suprachiasmatischen Kern tagesrhythmisch gesteuert und durch Licht gehemmt. Bei Dunkelheit in der biologischen Nacht wird diese Hemmung aufgehoben, die Produktion steigt an und mit ihr auch die Sekretion des Melatonins. Andere Produktionsorte im Körper sind der Darm und die Netzhaut des Auges. Die Melatoninkonzentration steigt im Laufe der Nacht um den Faktor drei (bei älteren Menschen) bis zwölf (bei jungen Menschen) an, das Maximum wird gegen drei Uhr morgens erreicht – mit einer jahreszeitlich wechselnden Rhythmik. Die Sekretion wird durch Tageslicht gebremst. Die Bedeutung des Melatonins bei Jetlag und Schichtarbeit ist allgemein anerkannt, doch ist eine Anwendung von Melatonin in diesem Zusammenhang umstritten. Durch Koordinierung der circadian-rhythmischen Vorgänge im Körper entfaltet es seine Wirkung als Zeitgeber. Zusammen mit Adenosin, einem weiteren körpereigenen Müdemacher, steuert Melatonin nach dem Schlafmodell von Borbély den Schlaf.[5][6] Die melatonininduzierte Tiefschlafphase stimuliert die Ausschüttung des Wachstumshormons Somatropin. Entsprechende chronische Störungen führen zur vorzeitigen Somatopause. Weitere wichtige Melatonineffekte liegen in seiner Wirkung als Antioxidans. Wichtig ist auch die antigonadotrope Wirkung (Verkleinerung der Geschlechtsdrüsen) sowie das Herunterregeln vieler biologischer und oxidativer Prozesse, worauf insbesondere bei der Einnahme von Melatonin zu achten ist. Eine Verringerung (aber auch eine Erhöhung) des Melatoninspiegels im Blut bewirkt Schlafstörungen bzw. Störungen des Schlaf-Wach-Rhythmus.[7]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Die Biosynthese erfolgt aus Serotonin, das aus der Aminosäure Tryptophan erhalten wird, in zwei Schritten: zunächst wird Serotonin mit Acetyl-Coenzym A N-acetyliert, als Katalysator wirkt das Enzym Serotonin-N-Acetyltransferase (AANAT). Dann wird das Produkt N-Acetylserotonin mit S-Adenosylmethionin mittels der Acetylserotonin-O-Methyltransferase methyliert. Der erste Schritt ist geschwindigkeitsbestimmend, und die Aktivität seines Enzyms wird indirekt vom Tageslicht reguliert.
Abbau
[Bearbeiten | Quelltext bearbeiten]90 % des Melatonins werden nach der Leberpassage durch Biotransformation mittels Cytochrom P450-Monooxygenasen zu 6-OH-Melatonin metabolisiert und in Form von sulfatierten (60–70 %) oder glucuronidierten (20–30 %) Derivaten über den Urin ausgeschieden.
Mitochondrien
[Bearbeiten | Quelltext bearbeiten]Melatonin wird aus dem Zytoplasma durch PEPT1/2-Oligopeptid- und Glut/SLC2A-Transporter ins Innere von Mitochondrien transportiert.[8] Zum Teil wird es auch in Mitochondrien synthetisiert. Es vermindert die Bildung freier Sauerstoffradikale (ROS) und freier Stickstoffradikale (RNS). Es schützt die ATP-Synthese der Mitochondrien. Melatonin bindet an die Melatoninrezeptoren MT1 und MT2. Durch die Rezeptorbindung wird eine pro-apoptotische Proteinbiosynthese gehemmt, also die Apoptose verhindert. Ferner schützt es die Mitochondrien-DNA und verhindert die Öffnung der mitochondrialen Permeabilitätsporen (Englisch: mitochondrial permeability transition pore, mPTP).[9][10]
Melatoninmangel
[Bearbeiten | Quelltext bearbeiten]Für Melatonin ist bisher nicht geklärt, wann ein Mangel vorliegt. Dennoch wird es in großem Umfang therapeutisch verwendet (s. u.). Bei anderen Hormonen gibt es Richtwerte, anhand derer man feststellen kann, ob eine Gabe von Hormonen notwendig ist oder nicht (vgl. Morbus Addison). Bei Melatonin fehlen diese Richtwerte.
Aufgrund der Verschiedenheit von Menschen erschwert gerade auch die von der circadianen Rhythmik und vom Grad der Dunkelheit abhängige Synthese des Melatonins eine Festlegung von genormten Laborwerten.
Ein hoher Grad an Verkalkung der Zirbeldrüse kann als Hinweis für einen Melatoninmangel gesehen werden. Erste Belege hierfür finden sich bei beobachteten Zusammenhängen zwischen einem erhöhten Anteil an verkalktem Gewebe und Symptomen wie verminderter Schlafqualität oder mangelnder Stabilität des circadianen Rhythmus.[11]
Als erwiesen gilt ein Mangel an Melatonin bei Kindern mit bestimmten neurologischen Entwicklungsstörungen. Einige Kinder mit Angelman-Syndrom haben beispielsweise einen abnormal niedrigen Melatoninspiegel während der Nacht. Beim Smith-Magenis-Syndrom (SMS) ist der Melatoninspiegel tagsüber erhöht, während er nachts verringert ist. Für Kinder mit Autismus-Spektrum-Störung (ASS) wurde zum Teil eine verringerte Melatoninproduktion sowie eine Korrelation mit Schlafstörungen und autistischem Verhalten gezeigt.[12]
Wirkungen und medizinische Anwendungen
[Bearbeiten | Quelltext bearbeiten]Winterdepressionen
[Bearbeiten | Quelltext bearbeiten]Im Winter, wenn das Tageslicht nur wenige Stunden dauert, kann sich die Tagesrhythmik der Melatoninproduktion verschieben und verlängern. Als Folge davon können Müdigkeit, Schlafstörungen und Winterdepressionen auftreten. Als Gegenmaßnahme wird empfohlen, die kurze Phase von Tageslicht für Spaziergänge zu nutzen. Alternativ kommt auch eine Lichttherapie in Frage.
Schlafprobleme und Gedächtnis
[Bearbeiten | Quelltext bearbeiten]Ein zu niedriger Melatoninspiegel kann mit Schlafstörungen einhergehen. Mit zunehmendem Alter produziert der Körper weniger Melatonin, die durchschnittliche Schlafdauer nimmt ab und Schlafprobleme treten gehäuft auf. Auch bei Schichtarbeit und bei Fernreisen (Jetlag) kann der Melatoninhaushalt durch die Zeitumstellung gestört werden.
Erholsamer Schlaf ist wichtig für ein funktionierendes Gedächtnis. Einer der Gründe dafür könnte der Einfluss von Melatonin auf den Hippocampus sein. Diese Region im Gehirn ist wichtig für das Lernen und Erinnern. Durch die Wirkung von Melatonin ist die neurophysiologische Grundlage von Lernen und Gedächtnis, die synaptische Plastizität, einem deutlichen Tag-Nacht-Rhythmus unterworfen. Eine ähnliche Wirkung wie Melatonin zeigt Hopfen. Es konnte nachgewiesen werden, dass Inhaltsstoffe aus Hopfen an die Melatonin-Rezeptoren binden und dort einen schlafinduzierenden Körpertemperatur-senkenden Effekt auslösen, ähnlich dem körpereigenen Melatonin.[13] Aufgrund seiner schlafeinleitenden Effekte wird Hopfen daher bereits seit langem in der Behandlung von Schlafstörungen angewendet.
Schlafprobleme bei neurologischen Entwicklungsstörungen
Schlafstörungen sind eine häufige Begleiterscheinung bei Kindern mit neurologischen Entwicklungsstörungen, z. B. beim Rett-Syndrom, beim Angelman-Syndrom, beim Smith-Magenis-Syndrom oder bei einer Autismus-Spektrum-Störung. Oftmals gehen die Erkrankungen mit einer unphysiologischen Melatoninsekretion einher. In Verbindung mit schlafhygienischen Maßnahmen sowie verhaltenstherapeutischer Begleitung kann Melatonin hier teilweise therapeutisch eingesetzt werden – bei Kindern im Autismus-Spektrum kann z. B. eine Verkürzung der Einschlafzeit und eine Verbesserung der Gesamtschlafzeit erreicht werden.[12][14]
Antioxidative Wirkung von Melatonin
[Bearbeiten | Quelltext bearbeiten]Neben seiner Funktion zur Synchronisierung der biologischen Uhr ist Melatonin ein leistungsfähiger Radikalfänger und ein Antioxidationsmittel mit breitem Wirkungsspektrum.[15] Bei vielen niedrig entwickelten Lebewesen ist dies die einzige bekannte Funktion von Melatonin.[16] Melatonin ist ein Antioxidans, welches leicht Zellmembranen und die Blut-Hirn-Schranke durchdringen kann.[17][18]
Als Antioxidans ist Melatonin ein direkter Radikalfänger für Sauerstoff- und Stickstoffverbindungen wie OH, O2 und NO.[19][20] Melatonin bewirkt zusammen mit anderen Antioxidantien auch eine Verbesserung der Wirksamkeit dieser anderen Antioxidantien.[20] Es ist belegt, dass die antioxidative Wirkung von Melatonin doppelt so hoch wie jene von Vitamin E ist, und es wird davon ausgegangen, dass Melatonin das wirksamste lipophile Antioxidans ist.[21] Ein wichtiges Merkmal von Melatonin, das es von anderen klassischen Radikalfängern unterscheidet, ist, dass seine Metaboliten ebenfalls Radikalfänger sind, was als Kaskadenreaktion bezeichnet wird.[16] Melatonin unterscheidet sich von anderen klassischen Antioxidantien wie Vitamin C und Vitamin E auch dadurch, dass es amphiphile Eigenschaften hat. Im Vergleich zu synthetischen Antioxidantien mit Wirkung auf das Mitochondrium (MitoQ und MitoE) erwies sich Melatonin als vergleichbarer Schutz gegen mitochondrialen oxidativen Stress.[22]
Studien zur Wirkung von Melatonin bei Krebs
[Bearbeiten | Quelltext bearbeiten]Der systematische Review mit einer Meta-Analyse von randomisiert kontrollierten Studien zur Behandlung solider Tumoren mit Melatonin, welcher im November 2005 im Journal of Pineal Research veröffentlicht wurde, hatte reduzierte Sterberaten als Ergebnis. Melatonin reduzierte das Todesrisiko innerhalb eines Jahres auf 66 % im Vergleich zur Behandlung ohne Melatonin. Die Wirkung von Melatonin war dabei bei verschiedenen Dosierungen und auch bei verschiedenen Krebsarten gleich. Es wurden dabei keine schwerwiegenden unerwünschten Nebenwirkungen festgestellt. Die deutliche Verringerung des Sterberisikos, die geringe Rate unerwünschter Nebenwirkungen und die geringen Kosten einer Krebsbehandlung mit Melatonin lassen ein großes Potenzial für den Einsatz von Melatonin bei Krebspatienten erwarten. Zur Absicherung der Wirksamkeit und Sicherheit von Melatonin bei der Krebsbehandlung ist jedoch die Bestätigung durch weitere unabhängige randomisiert kontrollierte Studien (RCT) erforderlich.[23]
Klinische Studien (Review vom National Cancer Institute vom Mai 2013) bei Nieren-, Brust-, Dickdarm-, Lungen- und Gehirnkrebs deuten darauf hin, dass Melatonin eine Anti-Krebs-Wirkung in Verbindung mit einer Chemotherapie und Strahlentherapie hat; die Studienergebnisse sind jedoch nicht ganz eindeutig.[24]
Melatonin bei Fibromyalgie
[Bearbeiten | Quelltext bearbeiten]Zu den Symptomen der Fibromyalgie gehören langfristige und weit verbreitete Schmerzen in Muskeln, Sehnen und Bindegewebe ohne spezifische Ursache. In einer Studie fand man, dass Patienten deutlich verringerte Symptome hatten, wenn sie Melatonin allein oder in Verbindung mit dem Antidepressivum Fluoxetin (Handelsname Prozac) einnahmen.[25]
Unerwünschte Wirkungen
[Bearbeiten | Quelltext bearbeiten]Kurzzeitig – über einen Zeitraum von maximal zwei bis drei Monaten – weist Melatonin kaum Nebenwirkungen auf. Gelegentlich traten folgende Nebenwirkungen auf:[26]
- Schläfrigkeit und Unkonzentriertheit
- Reizbarkeit, Nervosität
- Schmerzen in Brust, Bauch und Extremitäten, Kopfschmerzen
- Schwindel
- Übelkeit
- Hautausschläge, Juckreiz
Während der Schwangerschaft und der Stillzeit sowie bei schweren Allergien sollte aus Sicherheitsgründen auf die Einnahme von Melatonin verzichtet werden.
Wird Melatonin gemeinsam mit Antiepileptika, Antidepressiva (SSRIs) und Antithrombosemitteln eingenommen, kann es möglicherweise zu Wechselwirkungen zwischen den verschiedenen Medikamenten kommen.
Beobachtungen einer Langzeitanwendung von Melatonin bei Kindern zeigten auch nach drei bis vier Jahren eine größtenteils bleibende Effektivität sowie keine gravierenden Nebenwirkungen.[14][27]
Melatonin in Lebensmitteln
[Bearbeiten | Quelltext bearbeiten]Melatonin kommt in pflanzlichen und in sehr geringen Mengen auch in tierischen Lebensmitteln vor. Den höchsten Melatonin-Gehalt weisen Cranberries (bis zu 9.600 µg/100 g Trockengewicht) auf. Weitere Quellen für Melatonin sind einige Pilzarten (Edel-Reizker, Gemeiner Steinpilz, Zucht-Champignon, Echter Pfifferling), einige Getreidearten (Mais, Reis, Weizen, Hafer, Gerste), Senfsamen, getrocknete Tomaten und Paprika sowie einige Weinsorten.
Die Melatonin-Konzentration im Blut ist nach dem Verzehr melatoninhaltiger Lebensmittel signifikant höher. Der Verzehr melatoninreicher Lebensmittel wirkt sich positiv auf das Schlafverhalten aus.[28]
| Lebensmittel | Melatonin-Gehalt |
|---|---|
| Cranberry, getrocknet | 2.500–9.600 µg/100 g |
| Edel-Reizker, getrocknet | 1.290 µg/100 g |
| Gemeiner Steinpilz, getrocknet | 680 µg/100 g |
| Zucht-Champignon, getrocknet | 430–640 µg/100 g |
| Mais, getrocknet | 1–203 µg/100 g |
| Echter Pfifferling, getrocknet | 140 µg/100 g |
| Linsen-Keimlinge, getrocknet | 109 µg/100 g |
| Kidneybohnen-Keimlinge, getrocknet | 52,9 µg/100 g |
| Reis, getrocknet | 0–26,4 µg/100 g |
| Tomate, getrocknet | 25,0 µg/100 g |
| Senfsamen, getrocknet | 12,9–18,9 µg/100 g |
| Wein | 0–13,0 µg/100 ml |
| Weizen | 12,5 µg/100 g |
| Paprika, getrocknet | 9,3 µg/100 g |
| Hafer | 0–9,1 µg/100 g |
| Gerste | 0–8,2 µg/100 g |
| Lachs | 0,37 µg/100 g |
| Eier, roh | 0,15 µg/100 g |
| Kuhmilch | 0–0,4 ng/100 ml |
Melatonin wird nicht nur vom Menschen, sondern von allen Säugetieren bei Dunkelheit in der Nacht produziert, dementsprechend auch von Kühen nach oben geschildertem Mechanismus. Bei der Milchbildung gelangt Melatonin vom Blut in die Milch. Je nach Tages- oder Nachtzeit und Futtergrundlage der Kühe enthält die Milch unterschiedlich viel Melatonin. Insbesondere die Zurückführung der Milchviehhaltung unter ein spezielles Lichtregime, das den natürlichen Lichtverhältnissen im Tag/Nachtverlauf entspricht, sowie eine gras- und kräuterbasierte Fütterung führen zu einem hohen nächtlichen Melatoninspiegel der Kuh. Wird diese Milch separat erfasst, enthält sie bis zu 0,04 Mikrogramm Melatonin pro Liter. Mittels Gefriertrocknung kann die Konzentration 100fach erhöht werden.[29] Im Vergleich zu einigen pflanzlichen Lebensmitteln ist der Melatoningehalt dennoch extrem niedrig.[28] Der schlaffördernde Nutzen von aus solcher Milch gewonnenem Molkepulver (sogenannte „Nachtmilchkristalle“) ist wissenschaftlich unplausibel[30] und wird unterschiedlich bewertet.[31][32][33]
Präparate
[Bearbeiten | Quelltext bearbeiten]USA und Kanada
[Bearbeiten | Quelltext bearbeiten]Melatonin-Präparate sind in Kanada und den USA frei verkäuflich als Nahrungsergänzungsmittel. In den USA werden unterschiedliche Heilwirkungen beworben:
- Prophylaxe der Migräne[34]
- Anregung des Haarwuchses[35]
- Abfangen freier Radikale und als Folge der nachgewiesenen antioxidativen Fähigkeiten:[36]
- eine Verlangsamung des Alterns
- Bekämpfen oder Vorbeugen von Krebs;
- Vermeidung von Arteriosklerose, Schlaganfällen und Herzinfarkten
- Erhöhte Ausschüttung körpereigener Wachstumshormone[37]
Länder der Europäischen Union
[Bearbeiten | Quelltext bearbeiten]- Arzneimittel
Seit 2007 ist Melatonin durch die Europäische Kommission in der EU als Arzneimittel (Handelsname Circadin; Zulassungsinhaber Neurim Pharmaceuticals; Vertrieb z. B. in Deutschland Medice; diverse Generikaanbieter) zur kurzfristigen Behandlung der primären Insomnie (Einschlaf-, Durchschlafstörungen, schlechte Schlafqualität) bei Patienten ab 55 Jahren zugelassen. Circadin enthält zwei Milligramm Melatonin in retardierter Form. Die empfohlene Dosierung beträgt zwei Milligramm, ein bis zwei Stunden vor dem Zubettgehen und nach der letzten Mahlzeit und soll über drei Wochen aufrechterhalten werden.[38]
Seit 2018 ist außerdem ein Präparat (Handelsname Slenyto; Zulassungsinhaber Neurim Pharmaceuticals; Vertrieb z. B. in Deutschland Infectopharm) zur Behandlung von Schlafstörungen bei Autismus-Spektrum-Störung sowie Smith-Magenis-Syndrom für Kinder ab zwei Jahren und Jugendliche bis 18 Jahren zugelassen. Slenyto enthält ein oder fünf Milligramm Melatonin in retardierter Form und wird angewendet, wenn nicht-medikamentöse Maßnahmen zur Verbesserung des Schlafs (Schlafhygiene) nicht ausreichend wirken. Die anfängliche Dosis beträgt zwei Milligramm und kann bei unzureichendem Ansprechen auf bis zu zehn Milligramm gesteigert werden. Slenyto wird eine halbe bis eine Stunde vor dem Zubettgehen, mit oder nach der letzten Mahlzeit eingenommen.[39]
In Deutschland ist Melatonin, wenn es als Arzneistoff deklariert ist, gemäß der Arzneimittelverschreibungsverordnung ein verschreibungspflichtiger Stoff, melatoninhaltige Arzneimittel sind unabhängig von der Dosis verschreibungspflichtig.[40] Beim Vorliegen der entsprechenden Indikation sind Melatonin-Retardpräparate erstattungsfähig, sodass die Kosten von der Krankenkasse übernommen werden.
- Diätetische Lebensmittel und Nahrungsergänzungsmittel
Für die Verwendung in diätetischen Lebensmitteln oder Nahrungsergänzungsmitteln ist Melatonin gemäß dem Eintrag in die von der Europäischen Kommission erarbeitete Gemeinschaftsliste nach Artikel 13 der Verordnung (EG) Nr. 1924/2006 (Health Claims) mit den gesundheitsbezogenen Angaben „Melatonin trägt zur Linderung des subjektiven Jetlag-Gefühls bei.“ und „Melatonin trägt dazu bei, die Einschlafzeit zu verkürzen.“ statthaft. Die zulässige Einzeldosis sowie der Wortlaut für die Anwenderinformation sind ebenfalls vorgegeben.[41] Vorangegangen waren entsprechende wissenschaftliche Bewertungen durch die Europäische Behörde für Lebensmittelsicherheit (EFSA), die in den Jahren 2010 und 2011 veröffentlicht wurden.[42][43] Die Aufnahme in die Gemeinschaftsliste erlaubt bestimmte gesundheitsbezogene Angaben für Melatonin, ist jedoch nicht gleichbedeutend mit einer Zulassung von melatoninhaltigen Lebensmitteln. Die sogenannten „Health Claims“ sind ausschließlich für Lebensmittel und nicht für Arzneimittel vorgesehen.
In Deutschland wurden beim Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) 2010 melatoninhaltige Erzeugnisse als „ergänzende bilanzierte Diäten“ angezeigt. Ergänzende bilanzierte Diäten gehören zu den diätetischen Lebensmitteln. Bei dem Anzeigeverfahren beim BVL handelt es sich nicht um eine Zulassung melatoninhaltiger Erzeugnisse als diätetische Lebensmittel. Auch als Nahrungsergänzungsmittel werden Melatoninpräparate in Deutschland[44] und Österreich auf den Markt gebracht. Auf dem Markt gibt es bereits zugelassene Arzneimittel ab einer Konzentration von zwei Milligramm Melatonin pro Tagesdosis. Ob Produkte ab einer Melatoninkonzentration von zwei Milligramm pro Tagesdosis deshalb auch als (z. B. diätetische) Lebensmittel in Verkehr gebracht werden können, ist im Einzelfall zu prüfen und obliegt den zuständigen Behörden. Es gibt zahlreiche Substanzen, die sowohl in Arzneimitteln als auch in Lebensmitteln verwendet werden. Jedes Erzeugnis ist für sich zu prüfen und über die Einstufung zu entscheiden.[45]
Wissenschaftliche Bewertung
[Bearbeiten | Quelltext bearbeiten]Es gibt verschiedene Studien, die die gute Wirksamkeit von (hier: retardiertem, d. h. in der Wirkstofffreisetzung verlängertem) Melatonin für Menschen ab 55 Jahren belegen. Nachgewiesene Effekte sind unter anderem die nachhaltige Verkürzung der Einschlafzeit,[46] die Verbesserung der Schlafqualität[47] sowie die Verbesserung der morgendlichen Aufmerksamkeit und Tagesleistung.[48] Der Hauptvorteil von retardiertem Melatonin besteht den Studien nach in der gleichzeitigen Verbesserung sowohl der Schlafqualität als auch der morgendlichen Wachheit (Nachweis eines erholsamen Schlafs) bei Patienten mit Insomnie.[49]
Bei Kindern ist die Wirksamkeit für die Behandlung von Schlafstörungen bei verschiedenen Erkrankungen belegt, z. B. beim verzögerten Schlafphasensyndrom, bei der Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS), bei der Autismus-Spektrum-Störung oder bei verschiedenen weiteren neurologischen Entwicklungsstörungen wie dem Smith-Magenis-Syndrom. In den Studien verkürzte retardiertes Melatonin größtenteils die Einschlafzeit und wirkte sich positiv auf die Gesamtschlafdauer aus.[27]
Es gibt außerdem verschiedene Studien, die die Wirksamkeit von Melatonin bei Jetlag-Symptomatik untersucht haben. Die Daten hierzu sind recht unterschiedlich. Eine große Metaanalyse, publiziert in einem Cochrane Review,[50] deutet auf eine signifikante Wirksamkeit von Melatonin in einer Dosierung von 0,5 bis fünf Milligramm bei Jetlag-Symptomen hin. In all diesen Dosierungen hat Melatonin eine ähnliche Wirksamkeit. Allerdings ist die Zeit bis zum Einschlafen unter fünf Milligramm am kürzesten. Die Wirkung ist umso größer, je mehr Zeitzonen überquert werden; außerdem ist sie bei Flügen in Richtung Osten ausgeprägter als bei Flügen in Richtung Westen. In diesen Studien wurden subjektive Parameter des Schlafes untersucht, aber auch andere Symptome wie Tagesmüdigkeit und Wohlbefinden. Eine andere Metaanalyse[51] konnte keinen signifikanten Vorteil von Melatonin bei Jetlag-Symptomatik feststellen. Hier zeigte sich keine signifikante Verkürzung der Einschlafzeit bei Schlafstörungen infolge von Schichtarbeit. Auch die Gesamtschlafdauer konnte nicht deutlich verlängert werden. Ferner zeigte die Untersuchung, dass Wechselwirkungen mit Antithrombosemitteln und Antiepileptika möglich sind. Eine kurzzeitige Melatonineinnahme (< 3 Monate) hat keine schädlichen Folgen. Kritisiert an dieser Metaanalyse wurde die Auswahl der Studien (nur Kurzzeitanwendung, Dosierung, gewählte Endpunkte).
Verwandte Substanzen
[Bearbeiten | Quelltext bearbeiten]Eine dem Melatonin ähnliche chemische Struktur besitzt die Substanz Agomelatin. Im Unterschied zu Melatonin weist Agomelatin neben einer Affinität zu den Melatonin-Rezeptoren vom Typ MT1 und MT2 auch antagonistische Eigenschaften am Serotonin-Rezeptor 5-HT2c auf. Agomelatin wird als Arzneistoff in der Behandlung von Depressionen verwendet.
Tasimelteon ist eine weitere vom Melatonin abgeleitete Substanz, die als Agonist an MT1- und MT2-Rezeptoren wirkt. Tasimelteon ist in der EU als orphan drug zur Behandlung von Schlaf-Wach-Störungen mit Abweichung vom 24-Stunden-Rhythmus bei Blinden ohne Lichtwahrnehmung zugelassen.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Entdeckt und benannt wurde Melatonin 1958 durch den US-Dermatologen Aaron B. Lerner, der bereits die sedierende Wirkung beim Menschen beschrieb. 1990 entdeckte Franz Waldhauser, dass die Gabe von Melatonin die frühen Schlafphasen verkürzt und den REM-Schlaf verlängert.[52]
Analytik
[Bearbeiten | Quelltext bearbeiten]Der Nachweis von Melatonin erfolgt im Serum oder Speichel mittels RIA oder ELISA. Alternativ kann auch das Melatoninabbauprodukt 6-Hydroxy-Melatoninsulfat (6-OHMS) im Urin untersucht werden, um auf die nächtliche Melatoninsekretion zu schließen.[53][54][55][56]
Literatur
[Bearbeiten | Quelltext bearbeiten]- N. G. Harpsøe, L. P. Andersen, I. Gögenur, J. Rosenberg: Clinical pharmacokinetics of melatonin: a systematic review. In: European Journal of Clinical Pharmacology. Band 71, Nummer 8, August 2015, S. 901–909, doi:10.1007/s00228-015-1873-4, PMID 26008214 (Review).
- S. M. Webb, M. Puig-Domingo: Role of melatonin in health and disease. In: Clinical endocrinology. Band 42, Nummer 3, März 1995, S. 221–234, PMID 7758227 (Review).
- J. Arendt, Y. Touitou: Melatonin and the Pineal Gland: From Basic Science to Clinical Application. Elsevier Science 1993, ISBN 0-444-89583-3. (wissenschaftliches Standardwerk zu Melatonin).
- Arnold Hilgers, Inge Hoffmann: Melatonin. Mosaik Verlag, München 1996, ISBN 3-576-10622-7.
- Walter Pierpaoli, William Regelson: Melatonin – Schlüssel zu ewiger Jugend, Gesundheit und Fitness. Goldmann Verlag, München 1996, ISBN 3-442-12710-6.
- RKI: Melatonin in der umweltmedizinischen Diagnostik im Zusammenhang mit elektromagnetischen Feldern – Mitteilung der Kommission „Methoden und Qualitätssicherung in der Umweltmedizin“. 2005.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Melatonin Wirkung und Nebenwirkungen ( vom 2. Februar 2012 im Internet Archive) – studienbasierter, aktueller Artikel über die Melatonin-Wirkung und Einsatz im Anti-Aging-Bereich (2011)
- infomed.org/pharma-kritik – Pharma Kritik
- Wie ein Hormon Licht ins Dunkel bringt. Auf: wissenschaft.de vom 25. April 2006. Bericht über eine Publikation im Wissenschaftsmagazin PNAS
- Das beruhigende Geheimnis des Rotweins. Italienische Forscher haben möglicherweise entdeckt, warum ein Glas Rotwein am Abend so angenehm entspannend wirkt. Auf: wissenschaft.de vom 19. Juni 2006. Bericht über eine Publikation im Wissenschaftsmagazin Journal of the Science of Food and Agriculture
- Europäischer öffentlicher Beurteilungsbericht (EPAR) und Produktinformation zu Circadin ( vom 7. März 2009 im Internet Archive) auf der Website der Europäischen Arzneimittelagentur
- Fragen und Antworten zu melatoninhaltigen Nahrungsergänzungsmitteln – Bundesinstitut für Risikobewertung (BfR). 8. August 2024
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu MELATONIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c Datenblatt Melatonin bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b Eintrag zu Melatonin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b c d Scientific Committee on Consumer Safety: Opinion on Melatonin. (PDF; 286 kB) SCCS/1315/10, 24. März 2010.
- ↑ A. A. Borbély: A two process model of sleep regulation. In: Human Neurobiology. Band 1, Nr. 3, 1982, S. 195–204, PMID 7185792.
- ↑ Alexander A. Borbély, Serge Daan, Anna Wirz‐Justice, Tom Deboer: The two‐process model of sleep regulation: a reappraisal. In: Journal of Sleep Research. Band 25, Nr. 2, April 2016, S. 131–143, doi:10.1111/jsr.12371.
- ↑ S. J. Konturek, P. C. Konturek, T. Brzozowski, G. A. Bubenik: Role of melatonin in upper gastrointestinal tract. In: J. Physiol. Pharmacol. 58 Suppl 6, Dezember 2007, S. 23–52, PMID 18212399 (jpp.krakow.pl [PDF]).
- ↑ Juan C. Mayo, Rosa M. Sainz, Pedro González-Menéndez, David Hevia, Rafael Cernuda-Cernuda: Melatonin transport into mitochondria. In: Cellular and Molecular Life Sciences. Band 74, Nr. 21, November 2017, S. 3927–3940, doi:10.1007/s00018-017-2616-8.
- ↑ Dun-Xian Tan, Lucien Manchester, Lilan Qin, Russel Reiter: Melatonin: A Mitochondrial Targeting Molecule Involving Mitochondrial Protection and Dynamics. In: International Journal of Molecular Sciences. Band 17, Nr. 12, 16. Dezember 2016, S. 2124, doi:10.3390/ijms17122124 (mdpi.com [abgerufen am 12. April 2021]).
- ↑ Diana Maria Chitimus, Mihaela Roxana Popescu, Suzana Elena Voiculescu, Anca Maria Panaitescu, Bogdan Pavel: Melatonin’s Impact on Antioxidative and Anti-Inflammatory Reprogramming in Homeostasis and Disease. In: Biomolecules. Band 10, Nr. 9, 20. August 2020, S. 1211, doi:10.3390/biom10091211.
- ↑ Literaturrecherche Melatonin-Defizit ( vom 4. Oktober 2013 im Internet Archive) (PDF) Klinik für Schlafmedizin im St. Hedwig Krankenhaus, 2009.
- ↑ a b Madeleine Grigg-Damberger, Frank Ralls: Treatment strategies for complex behavioral insomnia in children with neurodevelopmental disorders. In: Current Opinion in Pulmonary Medicine. Band 19, Nr. 6, November 2013, S. 616–625, doi:10.1097/MCP.0b013e328365ab89.
- ↑ Veronika Butterweck, Axel Brattstroem, Oliver Grundmann, Uwe Koetter: Hypothermic effects of hops are antagonized with the competitive melatonin receptor antagonist luzindole in mice. In: Journal of Pharmacy and Pharmacology. Band 59, Nr. 4, 18. Februar 2010, S. 549–552, doi:10.1211/jpp.59.4.0009.
- ↑ a b Frank Kirchhoff u. a.: Einsatz von Melatonin bei Kindern mit Schlafstörungen – Stellungnahme der Arbeitsgruppe Pädiatrie der Deutschen Gesellschaft für Schlafforschung und Schlafmedizin e.V. (DGSM). In: DGSM. Deutsche Gesellschaft für Schlafforschung und Schlafmedizin e.V., 2018, abgerufen am 3. August 2022.
- ↑ Tan DX, Chen LD, Poeggeler B, Manchester LC, Reiter RJ (1993): Melatonin: a potent, endogenous hydroxyl radical scavenger, Endocrine J. 1: 57–60, abgerufen am 29. April 2017.
- ↑ a b Dun‐Xian Tan, Lucien C. Manchester, Maria P. Terron, Luis J. Flores, Russel J. Reiter: One molecule, many derivatives: A never‐ending interaction of melatonin with reactive oxygen and nitrogen species? In: Journal of Pineal Research. Band 42, Nr. 1, Januar 2007, S. 28–42, doi:10.1111/j.1600-079X.2006.00407.x.
- ↑ Rüdiger Hardeland: Antioxidative Protection by Melatonin: Multiplicity of Mechanisms from Radical Detoxification to Radical Avoidance. In: Endocrine. Band 27, Nr. 2, 2005, S. 119–130, doi:10.1385/ENDO:27:2:119.
- ↑ Russel J. Reiter, Lucien C. Manchester, Dun-Xian Tan: Neurotoxins: Free Radical Mechanisms and Melatonin Protection. In: Current Neuropharmacology. Band 8, Nr. 3, 1. September 2010, S. 194–210, doi:10.2174/157015910792246236.
- ↑ Burkhard Poeggeler, Seppo Saarela, Russel J. Reiter, Dun‐Xian Tan, Li‐Dun Chen, Lucien C. Manchester, Lornell R. Barlow‐Walden: Melatonin—A Highly Potent Endogenous Radical Scavenger and Electron Donor: New Aspects of the Oxidation Chemistry of this Indole Accessed in vitro a. In: Annals of the New York Academy of Sciences. Band 738, Nr. 1, November 1994, S. 419–420, doi:10.1111/j.1749-6632.1994.tb21831.x.
- ↑ a b Marino B. Arnao, Josefa Hernández-Ruiz: The Physiological Function of Melatonin in Plants. In: Plant Signaling & Behavior. Band 1, Nr. 3, Mai 2006, S. 89–95, doi:10.4161/psb.1.3.2640.
- ↑ Carlo Pieri, Maurizio Marra, Fausto Moroni, Rina Recchioni, Fiorella Marcheselli: Melatonin: A peroxyl radical scavenger more effective than vitamin E. In: Life Sciences. Band 55, Nr. 15, Januar 1994, S. PL271–PL276, doi:10.1016/0024-3205(94)00666-0.
- ↑ D.A. Lowes, N.R. Webster, M.P. Murphy, H.F. Galley: Antioxidants that protect mitochondria reduce interleukin-6 and oxidative stress, improve mitochondrial function, and reduce biochemical markers of organ dysfunction in a rat model of acute sepsis. In: British Journal of Anaesthesia. Band 110, Nr. 3, März 2013, S. 472–480, doi:10.1093/bja/aes577.
- ↑ Edward Mills, Ping Wu, Dugald Seely, Gordon Guyatt: Melatonin in the treatment of cancer: a systematic review of randomized controlled trials and meta‐analysis. In: Journal of Pineal Research. Band 39, Nr. 4, November 2005, S. 360–366, doi:10.1111/j.1600-079X.2005.00258.x.
- ↑ PMHDEV: Topics in Integrative, Alternative, and Complementary Therapies (PDQ®) - PubMed Health - National Cancer Institute (Mai 2013). In: ncbi.nlm.nih.gov. 13. Juni 2013, abgerufen am 29. April 2017 (englisch)., PMID 26389506
- ↑ Saad Abdul-Rehman Hussain, Ihab Ibrahim Al-Khalifa, Nizar Abdullatif Jasim, Faiq Isho Gorial: Adjuvant use of melatonin for treatment of fibromyalgia: Melatonin in fibromyalgia. In: Journal of Pineal Research. Band 50, Nr. 3, April 2011, S. 267–271, doi:10.1111/j.1600-079X.2010.00836.x.
- ↑ Fachinformation Circadin, Stand Juli 2015.
- ↑ a b S1-Leitlinie: Nichtorganische Schlafstörungen (F51). In: Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.V. (AWMF). Deutsche Gesellschaft für Kinder- und Jugendpsychiatrie, Psychosomatik und Psychotherapie e.V. (DGKJP), November 2021, abgerufen am 3. August 2022.
- ↑ a b c Xiao Meng, Ya Li, Sha Li, Yue Zhou, Ren-You Gan: Dietary Sources and Bioactivities of Melatonin. In: Nutrients. Band 9, Nr. 4, 7. April 2017, doi:10.3390/nu9040367.
- ↑ M. Valtonen, L. Niskanen, A-P Kangas, T. Koskinen: Effect of melatonin-rich night-time milk on sleep and activity in elderly institutionalized subjects. In: Nordic Journal of Psychiatry. Band 59, Nr. 3, Juni 2005, S. 217–221, doi:10.1080/08039480510023034.
- ↑ Nachtmilchkristalle gegen Schlaflosigkeit sind Unsinn ( vom 8. Juni 2012 im Internet Archive) Deutsches Ärzteblatt, 17. Juni 2010.
- ↑ Irene Joy I. dela Peña, Eunyoung Hong, June Bryan de la Peña, Hee Jin Kim, Chrislean Jun Botanas, Ye Seul Hong, Ye Seul Hwang, Byoung Seok Moon, Jae Hoon Cheong: Milk Collected at Night Induces Sedative and Anxiolytic-Like Effects and Augments Pentobarbital-Induced Sleeping Behavior in Mice. In: Journal of Medicinal Food. Band 18, Nr. 11, November 2015, S. 1255–1261, doi:10.1089/jmf.2015.3448.
- ↑ Innovation: Nachts gemolkene Milch soll den Schlaf fördern - WELT. Abgerufen am 24. August 2024.
- ↑ Innovationsberatung Weihenstephan. Abgerufen am 24. August 2024.
- ↑ Silvia Miano, Pasquale Parisi, Andrea Pelliccia, Anna Luchetti, Maria Chiara Paolino, Maria Pia Villa: Melatonin to prevent migraine or tension-type headache in children. In: Neurological Sciences. Band 29, Nr. 4, September 2008, S. 285–287, doi:10.1007/s10072-008-0983-5.
- ↑ T.W. Fischer, G. Burmeister, H.W. Schmidt, P. Elsner: Melatonin increases anagen hair rate in women with androgenetic alopecia or diffuse alopecia: results of a pilot randomized controlled trial. In: British Journal of Dermatology. Band 150, Nr. 2, Februar 2004, S. 341–345, doi:10.1111/j.1365-2133.2004.05685.x.
- ↑ Russel J. Reiter, Dun-Xian Tan, Juan C. Mayo, Rosa M. Sainz, Josefa Leon, Zbigniew Czarnocki: Melatonin as an antioxidant: biochemical mechanisms and pathophysiological implications in humans. In: Acta Biochimica Polonica. Band 50, Nr. 4, 2003, S. 1129–1146, PMID 14740000.
- ↑ Roberto Valcavi, Michele Zini, Georges J. Maestroni, Ario Conti, Italo Portioli: Melatonin stimulates growth hormone secretion through pathways other than the growth hormone‐releasing hormone. In: Clinical Endocrinology. Band 39, Nr. 2, August 1993, S. 193–199, doi:10.1111/j.1365-2265.1993.tb01773.x.
- ↑ Zusammenfassung der Merkmale des Arzneimittels Circadin 2 mg Retardtabletten, EPAR der EMA, abgerufen am 30. Dezember 2023
- ↑ Zusammenfassung der Merkmale des Arzneimittels Slenyto 1 oder 5 mg Retardtabletten, EPAR der EMA, abgerufen am 30. Dezember 2023
- ↑ AMVV § 1, Nr. 1
- ↑ EU Register on nutrition and health claims
- ↑ EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA): Scientific Opinion on the substantiation of health claims related to melatonin and alleviation of subjective feelings of jet lag (ID 1953), and reduction of sleep onset latency, and improvement of sleep quality (ID 1953) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. In: EFSA Journal. Band 8, Nr. 2, Februar 2010, doi:10.2903/j.efsa.2010.1467.
- ↑ EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA): Scientific Opinion on the substantiation of a health claim related to melatonin and reduction of sleep onset latency (ID 1698, 1780, 4080) pursuant to Article 13(1) of Regulation (EC) No 1924/2006: Melatonin and reduction of sleep onset latency. In: EFSA Journal. Band 9, Nr. 6, Juni 2011, S. 2241, doi:10.2903/j.efsa.2011.2241.
- ↑ Julia Borsch: Melatonin als NEM: Wo sind die gesetzlichen Grenzen? In: Deutsche Apotheker Zeitung Online. 13. April 2022, abgerufen am 13. Dezember 2022.
- ↑ Florian Meyer: Melatonin und der Widerspruch zwischen der Health Claims Verordnung und dem Arzneimittelrecht ( vom 16. Dezember 2014 im Internet Archive), Kanzlei juravendis Rechtsanwälte, 8. Dezember 2014.
- ↑ Alan G. Wade, Gordon Crawford, Ian Ford, Alex McConnachie, Tali Nir, Moshe Laudon, Nava Zisapel: Prolonged release melatonin in the treatment of primary insomnia: evaluation of the age cut-off for short- and long-term response. In: Current Medical Research and Opinion. Band 27, Nr. 1, 1. Januar 2011, S. 87–98, doi:10.1185/03007995.2010.537317.
- ↑ Remy Luthringer, Muriel Muzet, Nava Zisapel, Luc Staner: The effect of prolonged-release melatonin on sleep measures and psychomotor performance in elderly patients with insomnia:. In: International Clinical Psychopharmacology. Band 24, Nr. 5, September 2009, S. 239–249, doi:10.1097/YIC.0b013e32832e9b08.
- ↑ Patrick Lemoine, Tali Nir, Moshe Laudon, Nava Zisapel: Prolonged‐release melatonin improves sleep quality and morning alertness in insomnia patients aged 55 years and older and has no withdrawal effects. In: Journal of Sleep Research. Band 16, Nr. 4, Dezember 2007, S. 372–380, doi:10.1111/j.1365-2869.2007.00613.x.
- ↑ Alan G. Wade, Ian Ford, Gordon Crawford, Alex McConnachie, Tali Nir, Moshe Laudon, Nava Zisapel: Nightly treatment of primary insomnia with prolonged release melatonin for 6 months: a randomized placebo controlled trial on age and endogenous melatonin as predictors of efficacy and safety. In: BMC Medicine. Band 8, Nr. 1, 16. August 2010, S. 51, doi:10.1186/1741-7015-8-51.
- ↑ Andrew Herxheimer, Keith J Petrie: Melatonin for the prevention and treatment of jet lag. In: Cochrane Database of Systematic Reviews. Band 2010, Nr. 1, 22. April 2002, doi:10.1002/14651858.CD001520.
- ↑ Nina Buscemi, Ben Vandermeer, Nicola Hooton, Rena Pandya, Lisa Tjosvold, Lisa Hartling, Sunita Vohra, Terry P Klassen, Glen Baker: Efficacy and safety of exogenous melatonin for secondary sleep disorders and sleep disorders accompanying sleep restriction: meta-analysis. In: The BMJ. Band 332, Nr. 7538, 18. Februar 2006, S. 385–393, doi:10.1136/bmj.38731.532766.F6.
- ↑ Richard J. Wurtman, Franz Waldhauser, Harris R. Lieberman: The Secretion and Effects of Melatonin in Humans. In: The Pineal Gland and its Endocrine Role. 1983, S. 551–573, doi:10.1007/978-1-4757-1451-7_29.
- ↑ P. Levallois: Effects of Electric and Magnetic Fields from High-power Lines on Female Urinary Excretion of 6-Sulfatoxymelatonin. In: American Journal of Epidemiology. Band 154, Nr. 7, 1. Oktober 2001, S. 601–609, doi:10.1093/aje/154.7.601.
- ↑ Dominik H. Pfluger, Christoph E. Minder: Effects of exposure to 16.7 Hz magnetic fields on urinary 6‐hydroxymelatonin sulfate excretion of Swiss railway workers. In: Journal of Pineal Research. Band 21, Nr. 2, September 1996, S. 91–100, doi:10.1111/j.1600-079X.1996.tb00275.x.
- ↑ E. Gilad, N. Zisapel: High-Affinity Binding of Melatonin to Hemoglobin. In: Biochemical and Molecular Medicine. Band 56, Nr. 2, Dezember 1995, S. 115–120, doi:10.1006/bmme.1995.1066.
- ↑ D.K. Lahiri, D. Davis, M. Adkins, J.I. Nurnberger: Factors That Influence Radioimmunoassay of Human Plasma Melatonin: A Modified Column Procedure to Eliminate Interference. In: Biochemical Medicine and Metabolic Biology. Band 49, Nr. 1, Februar 1993, S. 36–50, doi:10.1006/bmmb.1993.1004.