Schwefeldifluorid
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
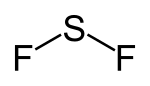
| ||||||||||
| Allgemeines | ||||||||||
| Name | Schwefeldifluorid | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | SF2 | |||||||||
| Kurzbeschreibung |
farbloses Gas[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 70,06 g·mol−1 | |||||||||
| Aggregatzustand |
gasförmig[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Schwefeldifluorid ist eine chemische Verbindung aus der Gruppe der Fluoride.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Schwefeldifluorid kann durch Halogenaustausch bei der Reaktion von Schwefeldichlorid mit Kaliumfluorid (170 °C) oder Quecksilber(II)-fluorid (150 °C) oder Silber(I)-fluorid (20 °C) bei Drücken < 25 mbar gewonnen werden, wobei auch andere Schwefelfluoride entstehen.
Ebenfalls möglich ist die Darstellung durch Reaktion von Carbonylsulfid mit Fluor.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Schwefeldifluorid ist ein farbloses Gas, das als Monomer (SF2), als auch als Dimer Dischwefeltetrafluorid und Trimer Trischwefelhexafluorid existiert. Es ist nur in verdünntem Zustand und nur in Abwesenheit von Zersetzungskatalysatoren (wie Fluorwasserstoff oder Metallfluoriden) kurzzeitig stabil, ansonsten zerfällt es über das Di- und Trimer zu Thiothionylfluorid und Schwefeltetrafluorid.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 564.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.


