Sultine

1,2λ4-Oxathiolan-2-on (PIN),
1,2-Oxathiolan-2-oxid,
Propan-1,3-sultin bzw.
γ-Propylsultin.[1]
Sultine sind eine Klasse chemischer Verbindungen mit organisch gebundenem, vierwertigem Schwefel und Sauerstoff, die als zyklische Ester einer Sulfinsäure aufgefasst werden können. Sie enthalten das Ringglied –S(=O)–O–.[2]
Die Bezeichnung Sultin hat ihren Ursprung in der Bezeichnung Sulton, wobei aufgrund der Sulfinatgruppe im Gegensatz zur Sulfonatgruppe das „o“ durch ein „i“ ersetzt ist.
Sultine werden jedoch selten als solche bezeichnet, meist findet das – nach den Chemikern Arthur Hantzsch und Oskar Widman benannte – Hantzsch-Widman-System für Heterocyclen Anwendung, demzufolge sie als 1,2‑Oxathiolan-2-oxide bezeichnet werden.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Ringbildung
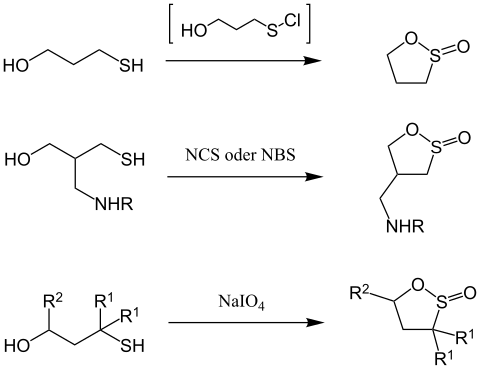
[Bearbeiten | Quelltext bearbeiten]Für die Darstellung gibt es eine Fülle an verschiedenen Syntheserouten. 1,2-Oxathiolan-2-oxide können zum Beispiel über Chlorierung von 1,3-Thioalkoholen[3] mit der in Klammern gesetzten Zwischenstufe oder über Behandlung mit NCS oder NBS von ähnlichen Edukten synthetisiert werden. Dies muss unter salzsauren Bedingungen erfolgen.[4] Auch simple Oxidation des 1,3-Thioalkohols mit Natriumperiodat führt zum gewünschten Produkt.[5]
Interessant ist die Darstellung über eine Ringerweiterung von Cyclopropanen mittels Schwefeloxiden. Beispiele sind die Reaktionen von Arylcyclopropanen mit Schwefeldioxid und TFA, welche zwei Regioisomere liefert:[6]

Fragmentierungen
[Bearbeiten | Quelltext bearbeiten]Ausgehend von 1,2-Oxathiolan-2-oxiden sind spezifische Substitutionen mit Br2 oder PCl3 möglich:

1,2-Oxathiolan-2-oxide sind für die Synthese von α,β-ungesättigten Carbonylverbindungen wie Zimtaldehyd von Interesse, da sie unter Erhitzen Schwefelmonoxid eliminieren, was zur Ringöffnung führt.[7]

Zweifach S-oxidierte 1,2-Oxathiolan-5-one fragmentieren analog in Schwefeldioxid und das entsprechende α,β-ungesättigte Carbonyl.[8]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1,2-Oxathiolan-2-oxid: CAS-Nr.: 24308-28-9, PubChem: 283800, ChemSpider: 250017, Wikidata: Q82044140.
- ↑ IUPAC: IUPAC Gold Book – sultines, abgerufen am 6. Januar 2019.
- ↑ J. F. King, R. Rathore: An easy preparation of simple sultines and hydroxyalkanesulfinate salts. In: Tetrahedron Letters. Band 30, Nr. 21, 1989, S. 2763–2766, doi:10.1016/S0040-4039(00)99119-6.
- ↑ R. M. J. Liskamp, H. J. Zeegers, H. C. J. Ottenheim: Synthesis and Ring-Opening Reactions of Functionalized Sultines. A New Approach to Sparsomycin. In: J. Org. Chem. Band 46, 31. Juli 1981, S. 5408–5413, doi:10.1021/jo00339a034.
- ↑ S. Yolka, R. Fellous, L. Lizzani-Cuvelier, M. Loiseau: Oxidation of 3-Suifanyl-alcohols with Sodium Metaperiodate: New Synthesis of Sultines. In: Tetrahedron Letters. Band 39, 1998, S. 991–992, doi:10.1016/S0040-4039(97)10757-2.
- ↑ E. V. Grigoriev, A. V. Yatsenko, N. V. Novozhilov, L. G. Saginova, V. S. Petrosyan: Determination of Structure and Configuration of Diastereomeric 3,5-diaryl-1,2-oxathiolane-2-oxides, Sulfur Addition-Products to 1,2-diarylcyclopropanes. In: Vestnik Moskovskogo Universiteta Seriya 2, Khimia. Band 34, Nr. 1, 1993, S. 87–93.
- ↑ R. F. J. Langdries, F. C. De Schryver: Photochemistry of heterocycles. Part IV. Photolysis of thiete-1,1-dioxides. In: Tetrahedron Letters. Band 13, Nr. 47, 18. Oktober 1972, S. 4781–4784, doi:10.1016/S0040-4039(01)94426-0.
- ↑ K. Nishitomi, T. Nagai, N. Tokura: The Thermal Decompositions and Mass Spectral Studies of the Cyclic Anhydrides of Some β-Sulfocarboxylic Acids. In: Bulletin of the Chemical Society of Japan. Band 41, Nr. 6, 1968, S. 1388–1394, doi:10.1246/bcsj.41.1388.