Tellurdichlorid
Zur Navigation springen
Zur Suche springen
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
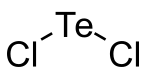
| ||||||||||
| Allgemeines | ||||||||||
| Name | Tellurdichlorid | |||||||||
| Summenformel | TeCl2 | |||||||||
| Kurzbeschreibung |
schwarzer Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 198,51 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
6,9 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
328 °C[1] | |||||||||
| Löslichkeit |
| |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Tellurdichlorid ist eine anorganische chemische Verbindung des Tellurs aus der Gruppe der Chloride.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Tellurdichlorid kann durch Reaktion von Tellur mit Dichlordifluormethan gewonnen werden.[3][4]
Die Verbindung kann auch durch Reaktion von Tellurtetrachlorid mit Tellur dargestellt werden.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Tellurdichlorid ist ein amorpher schwarzer Feststoff, der sich in Wasser zersetzt. Er schmilzt zu einer schwarzen Flüssigkeit und verdampft zu einem lilafarbenen Dampf.[1][6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Durch Reaktion von Bariumchlorid mit Tellurdichlorid in Wasser kann Bariumtellurit gewonnen werden.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 484 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Leopold Gmelin: Tellurium: Supplement volume. Springer-Verlag, 1977, OCLC 77834357, S. 72 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ E. E. Aynsley: 598. The preparation and properties of tellurium dichloride. In: Journal of the Chemical Society. 1953, S. 3016, doi:10.1039/JR9530003016.
- ↑ Arne Haaland: Molecules and Models The molecular structures of main group element compounds. OUP Oxford, 2008, ISBN 978-0-19-152860-6, S. 257 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Liv Fernholt, Arne Haaland u. a.: The molecular structure of tellurium dichloride, TeCl2, determined by gas electron diffraction. In: Journal of Molecular Structure. Band 128, 1985, S. 29, doi:10.1016/0022-2860(85)85037-7.
- ↑ Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 978-0-444-59553-9, S. 193 (eingeschränkte Vorschau in der Google-Buchsuche).
