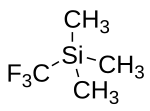
Trimethyl(trifluormethyl)silan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trimethyl(trifluormethyl)silan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H9SiF3 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 142,196 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,962 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Siedepunkt |
52–54 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Trimethyl(trifluormethyl)silan (auch als Ruppert-Prakash-Reagenz bekannt) ist eine Organosiliciumverbindung mit der Konstitutionsformel F3CSi(CH3)3. Bei der Verbindung handelt es sich um eine farblose Flüssigkeit, die dazu genutzt wird Trifluormethylgruppen in organische Moleküle einzuführen. Die Verbindung wurde erstmals 1984 von Ingo Ruppert synthetisiert[2] und von G. K. Surya Prakash als Reagenz weiterentwickelt.[3][4]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Das Reagenz kann ausgehend von Chlor(trimethyl)silan und Bromtrifluormethan unter Einwirken von Tris(diethylamino)phosphin in Benzonitril hergestellt werden:[2][5]

Bei dieser Reaktion wird nach Ruppert[2] zunächst ein reaktives Salzpaar zwischen dem Tris(diethylamino)phosphin und dem Bromtrifluormethan gebildet:
Das so gebildete reaktive CF3-Anion kann nun mit Chlor(trimethyl)silan reagieren:
Anwendung
[Bearbeiten | Quelltext bearbeiten]Trifluormethyltrimethylsilan reagiert in Gegenwart eines anionischen Initiators (KF oder N(Et)4F) mit Aldehyden oder Ketonen zu Trimethylsilylethern. Hydrolyse dieser Ether führt zu Trifluoromethylmethanol-Derivaten. Außerdem kann das Reagenz Ester in Trifluormethylketone, Imine in Trifluormethylamine, Isocyanate in Trifluoracetamide und Isothiocyanate in Trifluorthioacetamide überführen.[6] Außerdem dient es als Ausgangsstoff zur Synthese anderer Reagenzien zur Trifluormethylierung, wie zum Beispiel 1-(Trifluormethyl)-1,2-benziodoxol-3(1H)-on.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt Trimethyl(trifluoromethyl)silane bei Sigma-Aldrich, abgerufen am 1. November 2020 (PDF).
- ↑ a b c Ingo Ruppert, Klaus Schlich, Wolfgang Volbach: Die ersten CF3-substituierten organyl(chlor)silane. In: Tetrahedron Letters. Band 25, Nr. 21, Januar 1984, S. 2195–2198, doi:10.1016/S0040-4039(01)80208-2.
- ↑ G. K. Surya Prakash, Andrei K. Yudin: Perfluoroalkylation with Organosilicon Reagents. In: Chemical Reviews. 97. Jahrgang, Nr. 3, 1. Mai 1997, S. 757–786, doi:10.1021/cr9408991, PMID 11848888.
- ↑ Xiao Liu, Cong Xu, Mang Wang, Qun Liu: Trifluoromethyltrimethylsilane: Nucleophilic Trifluoromethylation and Beyond. In: Chemical Reviews. 115. Jahrgang, Nr. 2, 28. Januar 2015, S. 683–730, doi:10.1021/cr400473a, PMID 24754488.
- ↑ P. Ramaiah, R. Krishnamurti, G. K. S. Prakash: 1-TRIFLUOROMETHYL-1-CYCLOHEXANOL In: Organic Syntheses. 72, 1995, S. 232, doi:10.15227/orgsyn.072.0232 (PDF).
- ↑ George. A. Olah, G. K. Surya Prakash, Qi Wang, Xing-Ya Li, María Sánchez-Roselló: Trifluoromethyltrimethylsilane. In: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2009, ISBN 978-0-471-93623-7, S. 253, doi:10.1002/047084289x.rt253.pub2.
- ↑ Kyrill Stanek, Raffael Koller, Iris Kieltsch, Patrick Eisenberger, Antonio Togni: 1-(Trifluoromethyl)-1,2-benziodoxol-3(1 H )-one. In: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2009, ISBN 978-0-471-93623-7, S. rn01121, doi:10.1002/047084289x.rn01121.

![{\displaystyle \mathrm {BrCF_{3}+P(NEt_{2})_{3}\longrightarrow [(Et_{2}N)_{3}P{-}Br]^{+}CF_{3}^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/140b6f403f46081e88a1bb532a143265255e9934)
![{\displaystyle \mathrm {[(Et_{2}N)_{3}P{-}Br]^{+}CF_{3}^{-}+Cl{-}Si(CH_{3})_{3}\longrightarrow CF_{3}Si(CH_{3})_{3}+(Et_{2}N)_{3}PBrCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ae34d950c37fead0c8330e31c7009f7ac3bacbd)