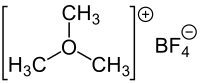
Trimethyloxoniumtetrafluoroborat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trimethyloxoniumtetrafluoroborat | ||||||||||||||||||
| Summenformel | (CH3)3O(BF4) | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 147,91 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Sublimationspunkt | |||||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Trimethyloxoniumtetrafluoroborat, [(CH3)3O+ BF4−] ist ein starkes Alkylierungsreagenz, das zu den Meerwein-Salzen (benannt nach dem deutschen Chemiker Hans Meerwein) gehört. Gelegentlich wird es auch schlicht als Meerwein-Salz bezeichnet, was aber nicht eindeutig ist.
Darstellung und Gewinnung
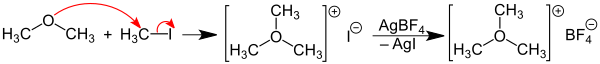
[Bearbeiten | Quelltext bearbeiten]Das Trimethyloxoniumtetrafluoroborat kann durch die Reaktion von Dimethylether mit Methyliodid und Silbertetrafluoroborat gewonnen werden. Zunächst reagiert hierbei der Ether mit Methyliodid zu Trimethyloxoniumiodid. Dieses wird dann in situ mit Silbertetrafluoroborat unter Ausfällung von Silberiodid zum Trimethyloxoniumtetrafluoroborat umgesetzt.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bei Trimethyloxoniumtetrafluoroborat handelt es sich um einen farblosen Feststoff, der bei 202–203 °C sublimiert. Es reagiert heftig mit Wasser unter Bildung einer sauren Lösung.
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Trimethyloxoniumtetrafluoroborat zersetzt sich in heftiger Reaktion in Wasser zu Dimethylether, Methanol und Tetrafluoroborsäure.
Es ist ein sehr starkes Methylierungsagens, das beispielsweise bei der Synthese von Fischer-Carbenen Anwendung finden kann. Die intermediär gebildete Lithiumverbindung wird hier unter Bildung eines Fischer-Carbens mit Trimethyloxoniumtetrafluoroborat methyliert.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt Trimethyloxoniumtetrafluoroborat bei Merck, abgerufen am 22. April 2010.
- ↑ a b Datenblatt Trimethyloxonium tetrafluoroborate bei Sigma-Aldrich, abgerufen am 9. April 2011 (PDF).
- ↑ G. A. Olah, H. Doggweiler, J. D. Felberg: "Onium Ylide Chemistry. 2. Methylenedialkyloxonium Ylides", in: J. Org. Chem., 1984, 49 (12), S. 2112–2116; doi:10.1021/jo00186a006.
Literatur
[Bearbeiten | Quelltext bearbeiten]- H. Meerwein: Triethyloxonium Fluoborate In: Organic Syntheses. 46, 1966, S. 113, doi:10.15227/orgsyn.046.0113; Coll. Vol. 5, 1973, S. 1080 (PDF).
- T. J. Curphey: Trimethyloxonium Tetrafluoroborate In: Organic Syntheses. 51, 1971, S. 142, doi:10.15227/orgsyn.051.0142; Coll. Vol. 6, 1988, S. 1019 (PDF).

![{\displaystyle {\ce {[(CH3)3O]+ [BF4]- + H2O -> (CH3)2O + CH3OH + HBF4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eec7703d18464eaaa225e3ec23a05b48545e4f72)
