Wolfram(VI)-bromid
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| _ W6+ _ Br− | |||||||
| Kristallsystem | |||||||
| Raumgruppe |
R3 (Nr. 148) | ||||||
| Gitterparameter | |||||||
| Allgemeines | |||||||
| Name | Wolfram(VI)-bromid | ||||||
| Andere Namen |
Wolframhexabromid | ||||||
| Verhältnisformel | WBr6 | ||||||
| Kurzbeschreibung |
dunkelgrauer Feststoff[2] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 663,26 g·mol−1 | ||||||
| Aggregatzustand |
fest[2] | ||||||
| Dichte |
6,9 g·cm−3[3] | ||||||
| Schmelzpunkt | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Wolfram(VI)-bromid ist eine anorganische chemische Verbindung des Wolframs aus der Gruppe der Bromide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Wolfram(VI)-bromid kann durch Reaktion von Wolfram(V)-bromid mit Brom bei Raumtemperatur unter Sauerstoffausschluss und Schutzatmosphäre gewonnen werden.[2]
Ebenfalls möglich ist die Darstellung durch Reaktion von Wolframhexacarbonyl mit Brom oder durch Reaktion von Wolfram(VI)-chlorid mit Bor(III)-bromid.[2]
Eigenschaften
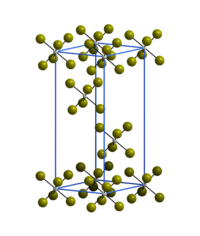
[Bearbeiten | Quelltext bearbeiten]Wolfram(VI)-bromid ist ein äußerst hydrolyseempfindliches dunkelgraues Pulver oder blass-grauer, metallisch glänzender Feststoff. Es reagiert bei Raumtemperatur langsam mit trockenem Sauerstoff unter Brom-Abgabe. Oberhalb 200 °C erfolgt rasche Zersetzung in Wolfram(V)-bromid und Brom.[2] Die Kristallstruktur (trigonal, Raumgruppe R3 (Raumgruppen-Nr. 148)) besteht aus isolierten WBr6-Oktaedern.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b W. Willing, U. Müller: Wolframhexabromid. In: Acta Crystallographica, 1987, C43, S. 1425–1426 (doi:10.1107/S0108270187091625).
- ↑ a b c d e Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1561.
- ↑ a b Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1462-7, S. 441 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.

