Parodontitis
| Klassifikation nach ICD-10 | |
|---|---|
| K05.2 | Akute Parodontitis |
| K05.3 | Chronische Parodontitis |
| ICD-10 online (WHO-Version 2019) | |

Die Parodontitis (von altgriechisch παρά para „neben“, ὀδούς odous „Zahn“ und -itis „Entzündung“) ist eine chronische, multifaktorielle, entzündliche Erkrankung des Zahnhalteapparates (Parodontium), die mit einem bakteriellen Zahnbelag vergesellschaftet und durch voranschreitende Zerstörung des Zahnhalteapparats gekennzeichnet ist.[1] Man unterscheidet zwischen der apikalen Parodontitis (von der Wurzelspitze ausgehend) und der marginalen Parodontitis (vom Zahnfleischsaum ausgehend). Die beiden Parodontitiden können auch ineinander übergehen (Paro-Endo-Läsionen). Die Parodontologie (λόγος lógos „Wort, Lehre“) ist die Lehre vom Zahnhalteapparat.
Der Begriff Parodontose ist veraltet und sollte nicht mehr verwendet werden.[2] In den Leitlinien und auf der Website der Deutsche Gesellschaft für Parodontologie (DG PARO) wird der Begriff Parodontose nicht mehr verwendet.[3] Der entzündungsfreie Zahnfleischrückgang oder Zahnfleischschwund wird als Gingivarezession bezeichnet.
Abgrenzung
[Bearbeiten | Quelltext bearbeiten]
Dieses Lemma behandelt die marginale Parodontitis. Diese wird weiter unterteilt.
Demgegenüber ist die Ursache für die apikale Parodontitis ein marktoter Zahn. Die Therapie besteht in einer Wurzelkanalbehandlung, einer Wurzelspitzenresektion oder dem Entfernen des Zahnes (Extraktion).
Parodontium
[Bearbeiten | Quelltext bearbeiten]Der Zahnhalteapparat besteht aus dem Zahnfleisch (Gingiva), dem Wurzelzement, der Wurzelhaut (Desmodont) mit kollagenen Fasern (den sogenannten Sharpeyschen Fasern) und dem Zahnfach.
Geschichte
[Bearbeiten | Quelltext bearbeiten]
Die Parodontologie führt ihren Ursprung auf John Mankey Riggs (1811–1885) zurück. Die Parodontitis wurde seit der Vorstellung seiner Behandlungstechniken 1876 als Riggs-Krankheit bezeichnet. Er war ein Gegner der Gingivaresektion, die damals praktiziert wurde und propagierte die Zahnsteinentfernung einschließlich Débridement und Zahnpolitur. Ferner betonte er die Wichtigkeit der Mundhygiene zur Parodontitisprävention. Der Schriftsteller Mark Twain, der Riggs zur Behandlung seiner Parodontitis aufsuchte, brachte Riggs Fertigkeiten in seinem kurzen Essay Happy Memories of the Dental Chair zu Papier.[4][5]
Im 19. Jahrhundert hatten die Parodontopathien zahlreiche Bezeichnungen, wie die 1746 erstmals von Pierre Fauchard[6] als pathologische Erscheinung beschriebene[7] Alveolarpyorrhöe (Blennorrhoea alveolaris), Alveolitis infectiosa, Caries alveolaris, Geissel medicorum, pyorrhee interalveolodentaire oder Pyorrhoea alveolaris. Ihre Behandlung beschränkte sich auf die Zahnsteinentfernung, das Schröpfen der Gingiva und die Exzision des hyperplastisch veränderten Gewebes. In Deutschland gilt Oskar Weski (1879–1925) als Vorreiter in der Parodontalbehandlung. Er prägte 1921 die Begriffe Paradentium und Paradentose (die später durch die etymologisch korrekten Begriffe Parodontium und Parodontitis abgelöst worden sind).[8][9]
Charles Cassedy Bass (1875–1975) versuchte sich an einer medikamentösen Behandlung der Parodontitis. Er bezeichnete die Erkrankung noch als Pyorrhea, für die er Endameba buccalis (Entamoeba gingivalis) verantwortlich machte.[10] Er entwickelte die Bass-Technik (Rütteltechnik) zum Zähneputzen.
Thomas B. Hartzell widerlegte die Bass-These und schlug eine gründliche Entfernung des Zahnsteins in Kombination mit parodontalchirurgischen Maßnahmen vor. 1922 veröffentlichten Paul R. Stillman und John Oppie McCall das erste maßgebliche Fachbuch dieses Fachgebiets A Textbook of clinical periodontia.[11] Er entwickelte die nach ihm benannte Stillman-Zahnputztechnik. Die Stillmanspalte (engl.: Stillman’s cleft), ein spaltförmiger Rückgang des Zahnfleisches, geht auf ihn zurück.[12]
Ursachen
[Bearbeiten | Quelltext bearbeiten]

Die Parodontitis wird (wie Gingivitis) durch bakterielle Plaque (Zahnbelag) verursacht, einen zäh anhaftenden Biofilm. Hauptunterscheidungsmerkmal ist der bei der Parodontitis vorhandene, röntgenologisch nachweisbare Knochenabbau, während die vertieften Zahnfleischtaschen bei der Gingivitis durch die entzündliche Schwellung der Gingiva zustande kommen. Eine langandauernde Gingivitis (Zahnfleischentzündung) kann auf den Kieferknochen, die Wurzelhaut und das Zement übergreifen. Der Übergang ist jedoch nicht zwangsläufig, gerade bei Kindern und Jugendlichen kann eine Gingivitis über Monate und Jahre bestehen, ohne auf andere Strukturen überzugreifen. Die genauen Mechanismen sind noch nicht vollständig geklärt. Sowohl bei der Gingivitis als auch bei der Parodontitis werden aus dem Biofilm bakterielle Stoffwechsel- und Zerfallsprodukte freigesetzt, die Abwehrreaktionen des Körpers auslösen. Die Hauptrolle bei der Gewebszerstörung selbst spielt das eigene Immunsystem, das versucht, die Bakterien zu beseitigen. Diese Immunantwort besteht aus einer vielfältigen Abfolge von Reaktionen und Aktionen, bei der verschiedene Entzündungsstoffe und -zellen beteiligt sind. Unter anderem werden Enzyme gebildet, die die Bakterien zerstören sollen, jedoch auch zu einer Zerstörung von Eigengewebe führen. Das führt letztlich zum Verlust von Bindegewebe und Knochen. Das Ergebnis der Reaktion auf die Bakterien sind Zahnfleischbluten, Taschenbildung, Zurückgehen des Zahnfleischs und schließlich Lockerung und Verlust der Zähne.
Von den etwa 500 verschiedenen Bakterienspezies, die in der Mundhöhle vorkommen können, sind nur wenige parodontalpathogen (krankheitserregend im Sinne einer Parodontitis). Diese werden auch als Hauptleitkeime bezeichnet und bilden sogenannte Cluster (Haufen), welche in ihrer Vergesellschaftung spezifisch sind. Sie sind obligat (immer) oder fakultativ (nach Bedarf) anaerobe, gramnegative, schwarzpigmentierte Bakterienarten.
Zu den Parodontitis-Markerkeimen zählen insbesondere:
- Aa, Aggregatibacter actinomycetemcomitans (alt: Actinobacillus actinomycetemcomitans)
- Pg, Porphyromonas gingivalis
- Pi, Prevotella intermedia
- Bf, Bacteroides forsythus (neu: Tannerella forsythia)
- Td, Treponema denticola
Wissenschaftliche Untersuchungen haben gezeigt, dass diese fakultativen und obligaten Anaerobier, die sich in der Tiefe von Zahntaschen entwickeln, eng mit der Ausbildung einer (progressiven) Parodontitis assoziiert sind.[13]
Risikofaktoren
[Bearbeiten | Quelltext bearbeiten]
Obwohl das Immunsystem und die Anwesenheit bestimmter Bakterien die Hauptrolle bei der Entstehung einer Parodontitis spielen, gibt es einige Risikofaktoren, die die parodontale Gesundheit beeinflussen:
- schlechte oder falsche Mundhygiene mit Zahnbelag (Plaque) und Zahnstein
- Tabakkonsum: Raucher haben verglichen mit Nichtrauchern ein vier- bis sechsfach erhöhtes Risiko, eine Parodontitis zu entwickeln.[14]
- genetische Prädisposition. In letzter Zeit wurde durch verschiedene Fallstudien,[15] aber auch in transversalen bevölkerungsrepräsentativen Studien[16] der bis dato noch unbekannte große Einfluss genetischer Prädisposition für das Krankheitsbild der Parodontitis erwiesen. Hier zeigt sich vor allem der Einfluss von Genotyp-Varianten im Bereich der Gene IL-1α (Interleukin), IL-1β und IL-1RN (Rezeptorantagonist).[17][18] und Tumor-Nekrose-Faktor α (TNF-α).[19] Dieser Zusammenhang ist auch für das Myeloperoxidase-Gen bekannt. Darüber hinaus konnte eine Assoziation zwischen dem genetischen Polymorphismus fremdstoffmetabolisierender Enzyme (Cytochrom P450, Glutathion-S-Transferase, N-Acetyltransferase) und dem Auftreten einer Parodontitis bewiesen werden[20][21][22]
- Diabetes mellitus (insbesondere wenn der Blutzuckerspiegel schlecht eingestellt ist). Dieser Aspekt des Diabetes mellitus ist schon seit längerem bekannt und in verschiedenen Studien[23] belegt worden.
- Schwangerschaft: Durch Hormonumstellung lockert das Bindegewebe auf, das Zahnfleisch schwillt an und Bakterien können leichter in die Tiefe vordringen.
- offene Zahnkaries
- Mundatmung
- Bruxismus (zumeist stressbedingtes Zähneknirschen)
- allgemeine Abwehrschwäche, insbesondere „immun-supprimierte“ Individuen (während oder nach Chemotherapie, Transplantationspatienten, HIV-Erkrankte etc.)
- unausgewogene Ernährung. Früher spielte Vitaminmangel eine große Rolle (Skorbut). Insgesamt scheint eine Ernährung arm an prozessierten Kohlenhydraten, aber reich an Omega-3 Fettsäuren, pflanzlichem Vitamin C, Vitamin D und Ballaststoffen parodontale Entzündungen zu senken.[24]
- ungünstig lokalisierte Piercings im Mundraum (Lippe, Lippenbändchen, Zunge) oder Metallteile im Zuge einer kieferorthopädischen Behandlung.
- psychischer Stress[25]
Parodontitis und Allgemeinerkrankungen
[Bearbeiten | Quelltext bearbeiten]Schwere und Verlauf der Erkrankung werden auch durch die Wirtsreaktivität bestimmt, die durch eine Vielzahl von Allgemeinerkrankungen beeinflusst wird. Demgegenüber scheint die Parodontitis aber auch selbst systemische Erkrankungen zu beeinflussen, wobei für Diabetes oder chronisch ischämische Herz-Kreislauf-Erkrankungen von einer wissenschaftlichen Evidenz ausgegangen werden kann, für andere Konditionen und Erkrankungen muss diese noch endgültig erbracht werden.[26] Auch ein Zusammenhang von Parodontitis und reaktiver Arthritis wird diskutiert.[27]
Gefäßerkrankungen
[Bearbeiten | Quelltext bearbeiten]Es existieren zahlreiche Studien, welche einen Zusammenhang zwischen periodontalen Erkrankungen (z. B. Parodontitis, Zahnfleischentzündung) und Gefäßerkrankungen (v. a. Arteriosklerose) nachweisen konnten. Ein Nachweis, ob dieser Zusammenhang kausal oder zufällig ist, existiert allerdings noch nicht.[28][29][30]
Diabetes
[Bearbeiten | Quelltext bearbeiten]Es gibt mehrere Studien, die zeigen, dass Diabetiker – vor allem diejenigen mit schlecht eingestellten Blutzuckerwerten (HbA1c-Wert > 7) – ein höheres Risiko für die Entstehung einer Parodontalerkrankung haben. Ein Mangel an Insulin, also ein erhöhter Blutzuckerwert, kann Ablagerungen an den kleinen Gefäßen (Kapillaren) zur Folge haben und diese in ihrer Funktion beeinträchtigen: Die Durchblutung lässt nach. Diese so genannten Mikroangiopathien wirken sich auf die Sauer- und Nährstoffversorgung des gesamten Gewebes aus, also auch auf das Zahnfleisch. Meistens verläuft bei diesen Patienten die Erkrankung in schwererer Ausprägung als bei Nichtdiabetikern. Besonders gefährdet sind Diabetiker, die älter als 40 sind, denn die Schwere der Parodontitis nimmt mit der Dauer des Diabetes zu. Zudem kann eine Infektion des Zahnhalteapparates, wie alle Infektionen, zu Schwierigkeiten bei der Kontrolle des Blutzuckerspiegels führen und damit die Einstellung der Blutzuckerwerte erschweren.
Schwangerschaft
[Bearbeiten | Quelltext bearbeiten]Seit Anfang der 1990er Jahre weiß die zahnmedizinische Forschung um den Zusammenhang zwischen Zahnfleischerkrankungen (Parodontal-Erkrankung) und dem erhöhten Risiko von Frühgeburten bzw. Neugeborenen mit unterdurchschnittlichem Geburtsgewicht. Einige Studien belegen, dass das Risiko einer Frühgeburt oder eines untergewichtigen Neugeborenen bei Frauen mit einer Parodontitis fast achtmal so hoch ist wie bei Frauen mit gesunden Zähnen und Zahnfleisch.
Alzheimer-Krankheit
[Bearbeiten | Quelltext bearbeiten]
Mehrere Studien zeigen einen engen Zusammenhang zwischen Parodontitis und einer Erkrankung an Morbus Alzheimer.[32] Beide Erkrankungen haben einen inflammatorischen Ursprung.[31] Anfänglich wurde die Assoziation zwischen beiden Erkrankungen so interpretiert, dass mit der Progression der Alzheimer-Krankheit die Mundhygiene nachlässt und so die Entstehung, beziehungsweise beschleunigte Progression einer bestehenden Parodontitis gefördert wird. Ursache wäre in diesem Fall die Alzheimer-Krankheit und Wirkung die Parodontitis. Neuere Studienergebnisse (ab etwa 2017) legen jedoch nahe, dass eine bestehende Parodontitis die Ursache für Alzheimer sein kann. Dabei werden unter anderem Mechanismen diskutiert, die eine direkte Invasion oraler Pathogene, wie beispielsweise Treponema denticola und Treponema socranskii aus der Wurzelhaut über die Blut-Hirn-Schranke in das Gehirn beschreiben.[33] Der Verdacht, dass Parodontitis zu Alzheimer führen kann, besteht seit dem Jahr 2008.[34]
2019 sorgte eine Studie für Aufsehen, bei der die Autoren sowohl das Bakterium Porphyromonas gingivalis als auch seine Stoffwechselprodukte im Gehirn von Alzheimer-Patienten nachweisen konnten. Wichtige Stoffwechselprodukte sind dabei toxische Proteasen mit dem Namen Gingipain. Im Labor konnten die Autoren in vitro und in vivo zeigen, dass Gingipaine die Fähigkeit haben, die Struktur von Tau-Proteinen zu beeinflussen. Bei Mäusen konnte ein oral applizierter Proteaseinhibitor die Vermehrung der Erreger und die fortschreitende Neurodegeneration stoppen.[35][36] Der in der Studie verwendete Inhibitor COR388 befindet sich seit Dezember 2017 in einer klinischen Phase-I-Studie mit gesunden Probanden.[37] Eine weitere, randomisierte, Placebo-kontrollierte, Doppelblindstudie in Phase I mit Alzheimer-Patienten wurde mit dieser Substanz im Februar 2018 begonnen.[38]
Verlauf
[Bearbeiten | Quelltext bearbeiten]
In den meisten Fällen handelt es sich um ein chronisch schubweise verlaufendes Geschehen. Dieses tritt vorwiegend bei Erwachsenen auf, ist nur selten schmerzhaft und führt, von den Betroffenen zumeist unbemerkt, erst nach Jahren zu Zahnlockerungen. Der Zahnfleischsaum bietet dabei für Bakterien einen relativen Schutz vor der Selbstreinigung der Mundhöhle durch Zunge und Speichel. Beim Gesunden garantiert das sogenannte Saumepithel durch seine Anhaftung am Schmelz eine kontinuierliche Oberfläche zwischen Zahnfleisch und Zahn. Wird die Plaque in diesen Nischen nicht sorgfältig entfernt, greifen die Ausscheidungsprodukte der Mikroorganismen (Exotoxine) das Saumepithel an und einige Bakterien sind sogar in der Lage, das Epithel zu durchwandern. Der Körper reagiert auf solche Angriffe mit der Einwanderung von Abwehrzellen aus dem Blut. Dabei bilden die neutrophilen Granulozyten und die Makrophagen einen Schutzwall gegen das weitere Vordringen von Fremdkörpern. Nach und nach werden so die Eindringlinge zerstört und phagozytiert („gefressen“). Dabei werden verschiedene Endotoxine freigesetzt. Sowohl die Exotoxine, als auch die Endotoxine und einige Zerfallsprodukte der Körperabwehrzellen stellen einen Reiz dar. Um das umliegende Gewebe vor diesen Reizen zu schützen und einem Vordringen der Entzündung in die Tiefe vorzubeugen, aktiviert der Körper u. a. Osteoklasten. Deren Aufgabe ist ein zielgerichteter Ab- und Umbau des Knochengewebes.

Bei einer guten Körperabwehr können die Mikroorganismen lange davon abgehalten werden, in die Tiefe vorzudringen. Die Kräfteverhältnisse in diesem Kampf sind jedoch sehr labil. Eine Verschlechterung der Körperabwehr, eine starke Vermehrung von Bakterien oder eine Veränderung der Aggressivität der Mikroorganismen führt dann zum Fortschreiten des Entzündungsgeschehens in die Tiefe. So kommt es im Verlauf zu einem stetigen Knochenverlust, der nur durch eine vollständige Entfernung der Reize gestoppt werden kann. Auf Röntgenbildern erscheint der Knochenverlust vorwiegend horizontal, da die Osteoklasten in Ruhephasen der Entzündung das zerklüftete Knochengewebe ausformen und so an die neuen Gegebenheiten anpassen. Aufgrund des langsamen und langen Krankheitsverlaufs wird diese Form der Entzündung als chronische Parodontitis bezeichnet.
Davon wird die aggressive Parodontitis unterschieden, welche rasch zu umfangreichem Knochenverlust führt und manchmal schon im Kindesalter auftritt. Darum wurde sie in der früheren Nomenklatur als juvenile Parodontitis bezeichnet. In Röntgenbildern erscheint der Knochenverlust bei diesem schnell fortschreitenden Verlauf als scharfkantiger vertikaler Krater entlang der Wurzeloberfläche, da keine Ummodellation stattgefunden hat. Als Ursachen für diese seltenere Form werden besonders aggressive Erreger und/oder eine nicht funktionierende lokale Abwehr der bakteriellen Reize diskutiert.
Da die Entzündungen in den Tiefen der parodontalen Taschen fortschreiten, ist eine Diagnose ohne zahnärztliche Hilfsmittel für Betroffene oft schwierig. Folgende Anzeichen können auf eine Erkrankung des Zahnhalteapparats hindeuten und sollten vom Zahnarzt abgeklärt werden:
- Gingivitiszeichen
- Zahnfleischbluten
- Rötungen, Schwellungen und Berührungsempfindlichkeit des Zahnfleisches
- in aktiven Entzündungsstadien außerdem
- Mundgeruch (Halitosis)
- Eiterbildung am Zahnfleisch
- bei fortgeschrittenem Verlauf
- Zahnfleischrückgang („die Zähne scheinen länger zu werden“)
- Zahnlockerung/-wanderung.
Panoramaröntgenaufnahme
[Bearbeiten | Quelltext bearbeiten]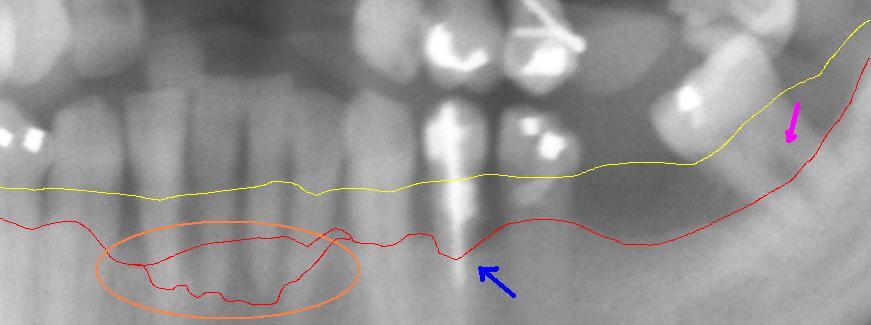
Ausschnitt aus einer Panoramaröntgenaufnahme einer fortgeschrittenen Parodontitis im linken Unterkiefer mit einem Knochenabbau zwischen 30 % und 80 %. Die rote Linie zeigt den aktuellen Knochenverlauf. Die gelbe Linie zeigt den ursprünglichen Verlauf des Zahnfleischsaums, der etwa 1 bis 2 mm über der physiologischen Knochengrenze verläuft. Der pinkfarbene Pfeil rechts zeigt eine freiliegende Bifurkation. Der blaue Pfeil in der Mitte zeigt auf einen besonders starken Knochenabbau. Der umkreiste Bereich weist einen besonders aggressiven Verlauf der Parodontitis im Bereich der unteren Frontzähne auf.
Prophylaxe
[Bearbeiten | Quelltext bearbeiten]Um einer Parodontitis vorzubeugen, sollte neben dem eigentlichen Zähneputzen mit der Zahnbürste auf eine Zahnzwischenraumpflege mit Zahnseide oder Interdentalbürsten und eine Entfernung von Belägen auf dem Zungenrücken geachtet werden. Bei regelmäßigen Kontrollen beim Zahnarzt in Verbindung mit einer professionellen Zahnreinigung alle sechs Monate können Putznischen gesäubert und Hilfestellungen bei der häuslichen Mundhygiene gegeben werden. Bei erhöhtem Risiko, zum Beispiel durch Schwangerschaft oder starken Stress, können die Prophylaxeintervalle beim Zahnarzt verkürzt werden, um frühestmöglich auf Veränderungen des Parodonts reagieren zu können. Die genannten Risikofaktoren (wie Nikotinabusus, Diabeteseinstellung) sind zu verringern.
Jüngste Forschungen empfehlen auch BLIS (bakteriozin ähnliche hemmende Substanzen) als mögliche Prophylaxe.[39]
Die Folgen des Zahnverlusts, vor allem die zum Teil sehr kostenintensiven prothetischen Maßnahmen, welche sich oft an eine parodontologische Behandlung anschließen, sowie die Erkenntnis über die allgemeinmedizinischen Zusammenhänge haben zur Folge, dass der Diagnose, Behandlung und vor allem der Vorbeugung dieser Erkrankung eine immer größere Bedeutung zukommt. Parodontitis ist wie eine Volkskrankheit – fast jeder Mensch ist im Laufe seines Lebens irgendwann mehr oder weniger stark davon betroffen. In der Altersgruppe über vierzig Jahren gehen mehr Zähne durch Parodontitis verloren als durch Karies.
Diagnostik
[Bearbeiten | Quelltext bearbeiten]
Eine umfassende Diagnostik bestimmt Art, Schwere und Verlauf der Erkrankung. Klinisch beurteilt man den Gesamtzustand des Gebisses, die Zahnlockerung, die Tiefe der Taschen (Screening mittels Parodontalem Screening-Index (PSI)), die mittels Parodontalsonden festgestellt wird, den Zahnfleischrückgang und die Mundhygiene des Patienten. Außerdem wird durch Röntgenaufnahmen der Knochenverlauf festgestellt. In manchen Fällen werden ergänzend mikrobiologische (Nachweis bestimmter parodontalpathogener Bakterien) und genetische (Nachweis einer genetischen Veranlagung) Tests durchgeführt. Auch eine Überweisung zum Allgemeinmediziner zum Ausschluss einer systemischen Erkrankung (Diabetes, HIV, Leukämie etc.) kann nötig sein.
Nekrotisierende Parodontalerkrankungen
[Bearbeiten | Quelltext bearbeiten]Unter den nekrotisierenden Parodontalerkrankungen werden die nekrotisierende ulzerierende Gingivitis (NUG) und die nekrotisierende ulzerierende Parodontitis (NUP) zusammengefasst. Beide Formen zeigen klinisch ein ähnliches Erscheinungsbild mit interdentalen gingivalen Nekrosen und Blutungen, starken Schmerzen, ausgeprägtem Foetor ex ore (Mundgeruch) und Pseudomembranen. Bei der NUP kommt es zusätzlich zu einem Verlust von parodontalem Stützgewebe. In schweren Fällen können zusätzlich eine Lymphadenopathie, ein allgemeines Krankheitsgefühl und Fieber auftreten.
Therapie
[Bearbeiten | Quelltext bearbeiten]

Die Therapie besteht darin, den Entzündungszustand des Zahnfleischs und des Zahnhalteapparats zu beseitigen und Plaque und Zahnstein sowie entzündungsfördernde Faktoren und die pathogene Bakterienflora zu beseitigen. Die Behandlung gliedert sich in verschiedene Phasen mit unterschiedlichen Maßnahmen.
In der sogenannten Hygienephase werden alle supragingival (oberhalb des Zahnfleischrands) gelegenen harten und weichen Beläge entfernt (professionelle Zahnreinigung, PZR). Dabei wird dem Patienten auch gezeigt, wie er zu Hause eine optimale Zahnpflege betreiben kann. Dieser Vorgang muss meist wiederholt werden. Außerdem müssen in dieser Phase bei Bedarf Füllungen oder Wurzelfüllungen gelegt oder erneuert und nicht erhaltungswürdige Zähne extrahiert werden. Dadurch werden weitere Bakterienherde in der Mundhöhle eliminiert. Durch verschiedene Spülflüssigkeiten oder Medikamente kann das Bakterienwachstum kontrolliert und verringert werden. Allein durch diese Hygienemaßnahmen kann bei vielen Betroffenen schon eine merkliche Besserung erreicht werden.
Im Anschluss beginnt bei Bedarf die sogenannte geschlossene Behandlungsphase, bei der die subgingival (unterhalb des Zahnfleischrands) liegenden harten und weichen Beläge entfernt werden (geschlossenes Debridement). Dies geschieht mit Küretten (speziell geformten Handinstrumenten), mit schall- und ultraschallbetriebenen Geräten oder unter Anwendung bestimmter Laser. Nach zwei bis drei Wochen Heilungszeit wird das Ergebnis dieser Behandlung kontrolliert, indem erneut die Sondierungstiefen gemessen und wenn nötig die Maßnahmen an einzelnen Stellen wiederholt werden.
Bei sehr tiefen Zahnfleischtaschen (über sechs Millimeter), welche durch die Hygienemaßnahmen und die geschlossene Behandlung nicht ausreichend zurückgegangen sind, kann es notwendig sein, in die offene Behandlungsphase überzugehen. Dabei werden die Bereiche chirurgisch eröffnet, damit die Maßnahmen der geschlossenen Behandlung unter Sicht wiederholt werden können. In diesem Fall ist es zum Teil auch möglich, eröffnete und gesäuberte Knochentaschen mit Knochenersatzmaterialien (Guided Bone Regeneration, GBR) aufzufüllen oder mit Membranen abzudecken (Guided Tissue Regeneration, GTR). Die letzteren beiden Maßnahmen sind jedoch keine Vertragsleistungen der Gesetzlichen Krankenversicherung.
Unter bestimmten Voraussetzungen (aggressive, schnell verlaufende Formen der Parodontitis) ist es sinnvoll, die Behandlung durch die Anwendung von Antibiotika und/oder der „Full Mouth Disinfection“-Therapie zu ergänzen. Metronidazol findet Anwendung in der unterstützenden Antibiosetherapie bei Parodontitis mit Anaerobierbefall, etwa Porphyromonas gingivalis. In einer Schweizer Feldstudie konnten mikrobiologisch fünf parodontale Typen (Vergesellschaftungen von Bakterien) nachgewiesen werden, welche verschieden zu therapieren sind: Bei drei Typen genügte eine Kürettage, bei zwei Typen mussten zusätzlich bestimmte Antibiotika verabreicht werden. Diese können in Tablettenform (systemisch) gegeben werden oder sie werden direkt in die Zahnfleischtasche eingebracht (lokal). In beiden Fällen ist es von Vorteil, vorher eine Keimbestimmung durchzuführen, um möglichst zielgerichtet zu behandeln. Es ist jedoch sinnlos, die Infektion mit Antibiotika zu therapieren, ohne die Zähne vorher zu reinigen. Die Bakterien sind in ihrem Biofilm vor der Einwirkung des antibiotischen Medikaments fast vollkommen geschützt. Erst durch die Zerstörung des Biofilms werden die Bakterien für die Antibiotika zugänglich.
Eine weitere lokale medikamentöse Behandlungsmethode (zusätzliche direkte Einbringung in die Zahnfleischtasche) ist die mit einem antiseptischen Chlorhexidinchip. Dieser sorgt für eine nachhaltige Keimfreiheit in der entzündeten Zahnfleischtasche und baut sich biologisch von selbst ab. Da es sich oftmals um eine chronische Form der Parodontitiserkrankung handelt, hat der Chlorhexidinchip zudem den Vorteil, dass die Keime keine Antibiotikaresistenz entwickeln, da es sich bei Chlorhexidin nicht um ein Antibiotikum handelt.
Als Adjuvans wird die antimikrobielle photodynamische Therapie angewandt. Hierbei werden nach der instrumentellen Reinigung die entzündungsauslösenden Mikroorganismen mit Hilfe einer Farbstofflösung angefärbt und anschließend mit einem Niedrigenergielaser (Diodenlaser) belichtet. Die Folgereaktion führt zur Bildung von aggressivem Sauerstoff, der die Bakterien zerstören soll, auch im Biofilm.[40]
Dass die Ernährung dabei eine große Rolle spielt, zeigten aktuell Forscher der Universitäten Würzburg und Hohenheim. In einer klinischen Studie, in der die Patienten reichlich Kopfsalatsaft konsumierten, der große Mengen an pflanzlichem Nitrat enthält, ging das Ausmaß der Zahnfleischentzündung zurück.[41]
Beurteilung durch das IQWiG
[Bearbeiten | Quelltext bearbeiten]Welche Vor- und Nachteile verschiedene Behandlungen bei entzündlichen Erkrankungen des Zahnhalteapparates bieten, ist Gegenstand einer Untersuchung des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG). Dieses meint in einem Vorbericht vom 24. Januar 2017, dass es zwar sehr viele Studien zu Parodontopathien gäbe. Diese seien aber sehr häufig nicht verwertbar. Aussagekräftige Studiendaten, die relevante Unterschiede in den Behandlungsergebnissen zeigten, gäbe es nur zu zwei Therapien:
- zur geschlossenen mechanischen Therapie (GMT) im Vergleich zu keiner Therapie und
- zu einem individuell angepassten Mundhygiene-Schulungsprogramm im Vergleich zu einer Standardunterweisung.
Es ließe sich aus den verfügbaren Daten ein Anhaltspunkt für einen (höheren) Nutzen der GMT respektive der mit einem individuell angepassten Mundhygiene-Schulungsprogramm kombinierten GMT ableiten.[42] Der Vorbericht stieß auf massive Kritik der einschlägigen Fachgesellschaften. „Mit seiner starren Methodik schließe das IQWiG zahlreiche international anerkannte Studienergebnisse bei der Bewertung aus“.[43][44]
Prognose
[Bearbeiten | Quelltext bearbeiten]Rechtzeitig und richtig behandelt kann einer Parodontitis fast immer Einhalt geboten werden, allerdings ist diese Behandlung zum Teil sehr langwierig und immer stark von der Mitarbeit des Patienten abhängig. Da die Parodontitis ein Ausdruck eines erfolgreichen bakteriellen Angriffs gegen die einst intakte Grenze Zahn-Zahnfleisch ist, muss sich jeder Betroffene im Klaren sein, dass selbst nach erfolgreicher Beseitigung dieser Entzündung die Gefahr des Rückfalls fortbesteht. Darum ist auch nach Beendigung der eigentlichen Therapie eine regelmäßige Nachsorge nötig, um einem erneuten Aufflammen der Entzündung frühestmöglich entgegenzuwirken.
Unbehandelt führt die Parodontitis fast immer zu Zahnverlust und daraus folgend zu ästhetischen und funktionellen Beeinträchtigungen. Außerdem ist Parodontitis ein Risikofaktor für allgemeinmedizinische Erkrankungen. So gilt ein Zusammenhang zwischen parodontalen Erkrankungen und erhöhtem Risiko für das Auftreten von Herz-Kreislauf-Erkrankungen (Herzinfarkt), Diabetes mellitus und Erkrankungen des rheumatischen Formenkreises als wissenschaftlich gesichert. In neueren Untersuchungen konnte außerdem gezeigt werden, dass eine unbehandelte Parodontitis das Risiko von Frühgeburten um das Siebenfache steigert und auch niedriges Geburtsgewicht ursächlich mit einer Parodontitis zusammenhängen kann.
Erhaltungstherapie
[Bearbeiten | Quelltext bearbeiten]Nach einer Parodontitisbehandlung ist eine lebenslange Erhaltungstherapie notwendig, die aus einer regelmäßigen Mundhygiene durch den Patienten und ebenso regelmäßig durchgeführten professionellen Zahnreinigungen durch den Zahnarzt bzw. eine entsprechend fortgebildete Zahnmedizinische Fachangestellte besteht. Letztere werden je nach Schweregrad der Erkrankung vierteljährlich bis halbjährlich durchgeführt.
Abrechnung von Leistungen der Gesetzlichen Krankenversicherung
[Bearbeiten | Quelltext bearbeiten]In Deutschland haben die gesetzlichen Krankenkassen die Parodontalbehandlung mit Wirkung vom 1. Januar 2004 neu organisiert. Damit sollen die Früherkennung von langsam fortschreitenden Parodontalerkrankungen gefördert und gleichzeitig der Patient zur verstärkten Eigenleistung animiert werden. Die Idee dahinter ist, dass der Patient selbst eine gute Mundhygiene als beste Prophylaxe sicherstellen soll. Die BEMA-Ziffer 04 wurde neu in den Leistungskatalog aufgenommen: Einmal alle zwei Jahre ist die Erstellung eines Parodontalen Screening-Indexes (PSI) zu Lasten der Krankenkasse abrechenbar. Seither kann die Entfernung des Zahnsteins (BEMA-Ziffer 107) im Rahmen der GKV nur noch einmal im Jahr abgerechnet werden. Stattdessen sollen Patienten bei Bedarf Prophylaxeleistungen mit dem Vertragszahnarzt privat vereinbaren und die Kosten selbst übernehmen. Die Höhe der diesbezüglichen Kosten ist patienten-, krankheits- und praxisbedingt unterschiedlich (Anzahl der zu reinigenden Zähne, Verschmutzungsgrad, Zahnstellung etc.). Teilweise gewähren Gesetzliche Krankenkassen einen Zuschuss zur Professionellen Zahnreinigung (PZR), teilweise werden die Kosten durch Zahn-Zusatzversicherungen übernommen.
Um für eine Parodontitistherapie die Kostenzusage durch eine Krankenkasse zu erhalten, muss diese zunächst bei der Krankenkasse mittels eines Parodontalstatus schriftlich beantragt und genehmigt werden. Grundlage für eine Leistungszusage sind die BEMA-Richtlinien,[45] die vom Gemeinsamen Bundesausschuss (G-BA) verabschiedet wurden. Dort heißt es:
Mitwirkung des Patienten
[Bearbeiten | Quelltext bearbeiten]„Der Zahnarzt hat den Patienten in allen Therapiephasen über die Notwendigkeit der aktiven Mitwirkung zu informieren. Die Mitwirkung besteht darin, dass sich der Patient nach seinen individuellen Möglichkeiten aktiv bemüht, exogene und endogene Risikofaktoren zu reduzieren, an den notwendigen Behandlungsterminen teilzunehmen und eventuell eingesetzte Therapiemittel indikationsgerecht anzuwenden. Vor und während der Parodontitisbehandlung ist zu überprüfen, in welchem Umfang eine Parodontitisbehandlung nach diesen Richtlinien angezeigt ist und dem Wirtschaftlichkeitsgebot entspricht. Dies hängt besonders von der Mitarbeit des Patienten ab.
Patienten, die trotzdem nicht ausreichend mitarbeiten oder unzureichende Mundhygiene betreiben, hat der Zahnarzt erneut auf die Notwendigkeit der Mitwirkung hinzuweisen und darüber aufzuklären, dass die Behandlung eingeschränkt oder ggf. beendet werden muss. Stellt der Zahnarzt fest, dass der Patient nicht ausreichend mitarbeitet, hat der Zahnarzt das Behandlungsziel neu zu bestimmen und ggf. die Behandlung zu beenden,
- wenn eine Verhaltensänderung des Patienten in absehbarer Zeit ausgeschlossen erscheint oder
- wenn er in einem weiteren Behandlungstermin feststellt, dass eine wesentliche Verhaltensänderung nicht erfolgt ist.
Der Zahnarzt hat hierüber die Krankenkasse zu unterrichten. Die Behandlung kann erst dann fortgeführt werden, wenn die Voraussetzungen gemäß Nr. 1 Absatz 2 vorliegen.“
Vorbehandlung
[Bearbeiten | Quelltext bearbeiten]Weitere Voraussetzung für die Kostenübernahme durch die GKV ist die Durchführung aller notwendigen Vorbehandlungsmaßnahmen, um das Gebiss in einen Zustand zu versetzen, den der Patient selbst sauber halten kann. Ferner müssen alle chirurgischen und konservierenden Leistungen vorab erfolgt sein, zum Beispiel die Extraktion nicht erhaltungsfähiger Zähne, Füllungen und Wurzelkanalbehandlungen. Hierzu gehören beispielsweise
- die Prüfung der Erhaltungswürdigkeit des jeweiligen Zahnes
- eine Zahnfleischtaschentiefe von mindestens 3,5 mm
- die Überprüfung des Lockerungsgrades des jeweiligen Zahnes
- die Auswertung der Röntgenaufnahmen
- die Prüfung der Vitalität der Zähne
- offenes Vorgehen
- geschlossenes Vorgehen
Die Kosten für eventuelle Zusatzleistungen wie beispielsweise
- Laserbehandlungen
- Bestimmung der Bakterienarten
- Bestimmung des genetischen Risikos
können mit gesetzlich versicherten Patienten privat vereinbart werden. Die unterstützende Parodontitistherapie (Kontroll- und Nachbehandlungen nach der von der Krankenkasse getragenen Hauptbehandlung), die sog. Erhaltungstherapie, ist weitgehend Privatleistung.
Werden dabei Leistungen erbracht, die über das Wirtschaftlichkeitsgebot gemäß § 12 SGB V hinausgehen (vor allem höherwertige Füllungen oder Nichtvertragsleistungen), so sind sie privat mit dem Patienten zu vereinbaren.
Die Durchführung einer Parodontitisbehandlung darf – wie die Durchführung jeder anderen vertragszahnärztlichen Leistung – nicht von einer privaten Zuzahlung oder Privatleistung abhängig gemacht werden.
Begutachtung
[Bearbeiten | Quelltext bearbeiten]Die Krankenkassen können die Kostenübernahmeerklärung von einer Begutachtung durch einen durch die Krankenkassen und Kassenzahnärztlichen Vereinigungen einvernehmlich bestellten Gutachter abhängig machen. Der Gutachter überprüft dabei die Einhaltung der BEMA-Richtlinien. Wird die Behandlung durch den Gutachter nicht befürwortet, kann ein Obergutachterverfahren eingeleitet werden. Die Obergutachter werden auf Bundesebene bestellt.
PA-Behandlung
[Bearbeiten | Quelltext bearbeiten]Im Anschluss an die Vorbehandlung, ggf. Begutachtung und Genehmigung kann die eigentliche Parodontitisbehandlung beginnen, welche die Krankenkasse im Umfang der BEMA-Richtlinien übernimmt.
Maßnahmen zur Sicherung des Behandlungserfolges
[Bearbeiten | Quelltext bearbeiten]Die BEMA-Richtlinien schreiben ebenfalls vor, dass die regelmäßige Untersuchung des Patienten nach Abschluss einer systematischen Behandlung von Parodontopathien (Erkrankungen des Zahnhalteapparats) wegen der Gefahr einer bakteriellen Wiederbesiedlung der Taschen erforderlich ist. Lokale Maßnahmen an einzelnen Parodontien sind gegebenenfalls zu wiederholen.
Die erste Nachuntersuchung sollte bei geschlossenem Vorgehen nach sechs Monaten und nach offenem Vorgehen spätestens nach 3 Monaten erfolgen.
Abrechnung von Privatleistungen
[Bearbeiten | Quelltext bearbeiten]Neben den bereits erwähnten Privatleistungen gehört eine ganze Reihe von Parodontitis-Therapieverfahren bzw. Begleittherapien nicht zum Leistungskatalog der Gesetzlichen Krankenversicherung, beispielsweise:
- augmentative Verfahren (Knochenaufbauverfahren),
- freie Ginigivatransplantate (Verpflanzung von Zahnfleisch),
- Knochentransplantate,
- funktionstherapeutische Leistungen,
- Verbreiterung der fixierten Gingiva,
- professionelle Zahnreinigung,
- mehr als einmal in zwei Jahren erfolgte Erhebung des parodontalen Screening-Index,
- wiederholte Befundung mittels Parodontalstatus,
die bei Privatpatienten oder durch private schriftliche Zusatzvereinbarung vor Beginn der Behandlung bei Kassenpatienten erbracht werden können.
Epidemiologie
[Bearbeiten | Quelltext bearbeiten]Fast 12 Millionen Deutsche leiden an Parodontitis. Mehr als die Hälfte der 35- bis 44-Jährigen litt 2007 in Deutschland an Parodontitis, etwa 20 Prozent sogar an einer schweren Form. Dies ergab die Vierte Deutsche Mundgesundheitsstudie (DMS IV), erstellt vom Institut der Deutschen Zahnärzte im Auftrag der Kassenzahnärztlichen Bundesvereinigung (KZBV) und der Bundeszahnärztekammer. Ein Grund für den Anstieg parodontaler Erkrankungen ist die verbesserte Mundgesundheit: Aufgrund der guten Kariesprophylaxe und zahnärztlicher Versorgung behalten ältere Menschen ihre eigenen Zähne immer länger. Die Zähne sind mit zunehmendem Alter aber einem hohen Parodontitis-Risiko ausgesetzt. Zum Beispiel leiden mehr als 40 Prozent der 65- bis 74-Jährigen an einer schweren Form der Parodontitis.[47]
In einer WHO-Studie zur Epidemiologie der Parodontitis wurde festgestellt, dass die Parodontitis in ihrer schweren Form bei etwa 10 bis 15 Prozent der Bevölkerung auftritt.[48] Die weltweiten Produktivitätsverluste aufgrund von Parodontitis werden auf ca. 54 Milliarden US-Dollar jährlich geschätzt.[49]
Tiere
[Bearbeiten | Quelltext bearbeiten]
Auch Tiere, beispielsweise Hunde und Katzen, können von Parodontitis betroffen sein. Der Verlauf ähnelt dem beim Menschen. Auch hier stellen regelmäßige Kontrollen und die Zahnsteinentfernung die häufigsten Behandlungsmethoden dar.
Literatur
[Bearbeiten | Quelltext bearbeiten]- American Academy of Periodontology; Annette Bergfeld (Übersetzung, Bearb.): Parodontalerkrankungen und Gesundheit. Phillip Verlag, München 2000, ISBN 3-934341-02-0.
- Deutsche Gesellschaft für Parodontologie e. V. (Hrsg.): Risikokompendium Parodontitis. Quintessenz-Verlag, Berlin u. a. 2002, ISBN 3-87652-433-4.
- C. Dörfer: Parodont und Allgemeingesundheit. In: zm. – Zahnärztliche Mitteilungen, ISSN 0341-8995, zm 92, Nummer 9, 2002, S. 38–43.
- S. Zimmer, A. Jordan, Universität Witten Herdecke: Adjuvante Parodontitis Therapie mit Chlorhexidin-Xanthan Gel. (PDF; 166 kB) Buchauszug: Die Einführung der Prophylaxe in der Zahnarztpraxis
- Patienteninformationen der Bundeszahnärztekammer und der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde zur Parodontalbehandlung (PDF; 339 kB), Regenerativen Therapie (GTR) (PDF; 115 kB), Mikrobiologischen Diagnostik und Parodontitistherapie (PDF; 77 kB) und zur Professionellen Zahnreinigung (PZR) (PDF; 247 kB).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Parodontitis und Herzinfarkt Universität Kiel
- Deutsche Gesellschaft für Parodontologie
- Österreichische Gesellschaft für Parodontologie
- Schweizerische Gesellschaft für Parodontologie
- European Federation of Periodontology
- Abteilung für Parodontologie Julius-Maximilians-Universität Würzburg
- S3-Leitlinie Die Behandlung von Parodontitis Stadium I bis III – Die deutsche Implementierung der S3-Leitlinie „Treatment of Stage I–III Periodontitis“ der European Federation of Periodontology (EFP) der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde e. V. (DGZMK) und der Deutschen Gesellschaft für Parodontologie e. V. (DG PARO). In: AWMF online (Stand 12-2020)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Panos N. Papapanou, Mariano Sanz, Nurcan Buduneli, Thomas Dietrich, Magda Feres: Periodontitis: Consensus report of workgroup 2 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. In: Journal of Clinical Periodontology. 45 Suppl 20, Juni 2018, ISSN 1600-051X, S. S162–S170, doi:10.1111/jcpe.12946, PMID 29926490.
- ↑ DocCheck Flexikon, Stichwort Parodontose, abgerufen am 5. Oktober 2022.
- ↑ Parodontitis DGParo. Abgerufen am 5. Oktober 2022.
- ↑ W. J. Maloney: A Periodontal Case Report by Dr. S. L. Clemens. In: Journal of Dental Research. 89, 2010, S. 676, doi:10.1177/0022034510366677.
- ↑ Mark Twain, Frederick Anderson, Lin Salamo, Bernard L. Stein: Mark Twain’s Notebooks & Journals. Band II: 1877–1883. University of California Press, 1975, ISBN 0-520-90553-9, S. 53 (books.google.com).
- ↑ Vgl. auch Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 28
- ↑ Ullrich Rainer Otte: Jakob Calmann Linderer (1771–1840). Ein Pionier der wissenschaftlichen Zahnmedizin. Medizinische Dissertation, Würzburg 2002, S. 20.
- ↑ Günter Koch: Oskar Weski: sein Leben und Wirken vor allem als Pionier der Paradontologie. Dissertation. LMU München, 1969.
- ↑ Oskar Weski: Review of Current Dental Literature: New Denomination of the So-Called Alveolar Pyorrhea. In: The Dental cosmos. Volume 74, Issue 2, Februar 1932, S. 200–201. Abgerufen am 27. April 2016.
- ↑ C. C. BASS: Habitat of Endameba buccalis in lesions of periodontoclasia. In: Proceedings of the Society for Experimental Biology and Medicine. Society for Experimental Biology and Medicine. Band 66, Nummer 1, Oktober 1947, ISSN 0037-9727, S. 9–12. PMID 20270656.
- ↑ Paul R. Stillman, John Oppie McCall: A Textbook of Clinical Periodontia. A Study of the Causes and Pathology of Periodontal Disease and a Consideration of Its Treatment. Macmillan Company, 1922.
- ↑ Malvin E. Ring: Geschichte der Zahnmedizin. Könemann Verlag, 1997, ISBN 3-89508-599-5, S. 303.
- ↑ Sylke Dombrowa: Sinnhaftigkeit der mikrobiologischen Diagnostik in der Therapie von Parodontitis und Periimplantitis – Teil 1. 23. November 2010, archiviert vom (nicht mehr online verfügbar) am 15. Dezember 2013; abgerufen am 22. November 2013. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Falk Schwendicke, Christof E. Dörfer, Toni Meier: Global smoking-attributable burden of periodontal disease in 186 countries in the year 2015. In: Journal of Clinical Periodontology. Band 45, Nr. 1, 21. November 2017, ISSN 0303-6979, S. 2–14, doi:10.1111/jcpe.12823.
- ↑ N. J. López, L. Jara, C. Y. Valenzuela: Association of interleukin-1 polymorphisms with periodontal disease. In: Journal of Periodontology. Band 76, Nummer 2, Februar 2005, S. 234–243, ISSN 0022-3492. doi:10.1902/jop.2005.76.2.234. PMID 15974847.
- ↑ P. Meisel, A. Siegemund, S. Dombrowa, H. Sawaf, J. Fanghaenel, T. Kocher: Smoking and polymorphisms of the interleukin-1 gene cluster (IL-1alpha, IL-1beta, and IL-1RN) in patients with periodontal disease. In: Journal of periodontology. Band 73, Nummer 1, Januar 2002, S. 27–32, ISSN 0022-3492. doi:10.1902/jop.2002.73.1.27. PMID 11846196.
- ↑ L. Quappe, L. Jara, N. J. Lopez: Association of interleukin-1 polymorphisms with aggressive periodontitis. In: J Periodontol. 75 (11), 2004, S. 1509–1515. PMID 15633328
- ↑ M. J. McDevitt, H. Y. Wang, C. Knobelman, M. G. Newman, F. S. di Giovine, J. Timms, G. W. Duff, K. S. Kornman: Interleukin-1 genetic association with periodontitis in clinical practice. In: J Periodontol. 71 (2), 2000, S. 156–163. PMID 10711605
- ↑ Y. Soga, F. Nishimura, H. Ohyama, H. Maeda, S. Takashiba, Y. Murayama: Tumor necrosis factor-alpha gene (TNF-alpha) -1031/-863, -857 single-nucleotide polymorphisms (SNPs) are associated with severe adult periodontitis in Japanese. In: J Periodontol. 30 (6), 2003, S. 524–531. PMID 12795791
- ↑ P. Meisel, R. Timm, H. Sawaf, J. Fanghänel, W. Siegmund, T. Kocher: Polymorphism of N-acetyltransferase (NAT2), smoking und the potential risk of periodontal disease. In: Arch Toxicol. 74 (6), 2000, S. 343–348. PMID 11846845
- ↑ J. S. Kim, J. Y. Park, W. Y. Chung, M. A. Choi, K. S. Cho, K. K. Park: Polymorphisms in genes coding for enzymes metabolizing smoking-derived substances and the risk of periodontitis. In: J Clin Periodontol. 31 (11), 2004, S. 959–964. PMID 15491310
- ↑ Gabriel Mohr: Untersuchung des genetischen Polymorphismus der N-Acetyltransferase-2 (NAT2) bei Patienten mit aggressiver Parodontitis. 2006, DNB 982950683.
- ↑ R. C. Oliver, T. Tervonen: Diabetes–a risk factor for periodontitis in adults? In: Journal of periodontology. Band 65, Nummer 5 Suppl, Mai 1994, S. 530–538, ISSN 0022-3492. doi:10.1902/jop.1994.65.5s.530. PMID 8046569. (Review).
- ↑ Schäfer, Edgar, Klimek, Joachim, 1947-, Attin, Thomas, 1963-: Einführung in die Zahnerhaltung : Prüfungswissen Kariologie, Endodontologie und Parodontologie. 7. überarbeitet Auflage. Köln 2018, ISBN 978-3-7691-3652-4.
- ↑ Lennart Seizer, Christian Schubert: On the Role of Psychoneuroimmunology in Oral Medicine. In: International Dental Journal. 30. September 2022, ISSN 0020-6539, doi:10.1016/j.identj.2022.07.002 (sciencedirect.com [abgerufen am 2. Oktober 2022]).
- ↑ Barbara Noack: Wechselwirkung: Parodontitis und Allgemeinerkrankungen. 4. Juni 2008, abgerufen am 10. Dezember 2013.
- ↑ Katarzyna J. Maresz, Annelie Hellvard, Aneta Sroka, Karina Adamowicz, Ewa Bielecka, Joanna Koziel, Katarzyna Gawron, Danuta Mizgalska, Katarzyna A. Marcinska, Malgorzata Benedyk, Krzysztof Pyrc, Anne-Marie Quirke, Roland Jonsson, Saba Alzabin, Patrick J. Venables, Ky-Anh Nguyen, Piotr Mydel, Jan Potempa, Barbara I. Kazmierczak: Porphyromonas gingivalis Facilitates the Development and Progression of Destructive Arthritis through Its Unique Bacterial Peptidylarginine Deiminase (PAD). In: PLoS Pathogens. 9, 2013, S. e1003627, doi:10.1371/journal.ppat.1003627.
- ↑ R. T. Demmer, M. Desvarieux: Periodontal infections and cardiovascular disease: the heart of the matter. In: Journal of the American Dental Association. Band 137 Suppl, Oktober 2006, S. 14S–20S, ISSN 0002-8177. PMID 17012731.
- ↑ B. Willershausen u. a.: Association between chronic dental infection and acute myocardial infarction. In: J Endod. 35(5), Mai 2009, S. 626–630.
- ↑ Yvonne Jockel-Schneider, Inga Harks, Imme Haubitz, Stefan Fickl, Martin Eigenthaler, Ulrich Schlagenhauf, Johannes Baulmann, Giuseppe Schillaci: Arterial Stiffness and Pulse Wave Reflection Are Increased in Patients Suffering from Severe Periodontitis. In: PLoS ONE. 9, 2014, S. e103449, doi:10.1371/journal.pone.0103449.
- ↑ a b F. B. Teixeira, M. T. Saito u. a.: Periodontitis and Alzheimer's Disease: A Possible Comorbidity between Oral Chronic Inflammatory Condition and Neuroinflammation. In: Frontiers in aging neuroscience. Band 9, 2017, S. 327, doi:10.3389/fnagi.2017.00327, PMID 29085294, PMC 5649154 (freier Volltext) (Review).
- ↑ Y. Leira, C. Domínguez u. a.: Is Periodontal Disease Associated with Alzheimer's Disease? A Systematic Review with Meta-Analysis. In: Neuroepidemiology. Band 48, Nummer 1–2, 2017, S. 21–31, doi:10.1159/000458411, PMID 28219071 (Review).
- ↑ P. Ganesh, R. Karthikeyan u. a.: A Potential Role of Periodontal Inflammation in Alzheimer's Disease: A Review. In: Oral health & preventive dentistry. Band 15, Nummer 1, 2017, S. 7–12, doi:10.3290/j.ohpd.a37708, PMID 28232969 (Review).
- ↑ A. R. Kamer, R. G. Craig u. a.: Inflammation and Alzheimer's disease: possible role of periodontal diseases. In: Alzheimer's & Dementia. Band 4, Nummer 4, Juli 2008, S. 242–250, doi:10.1016/j.jalz.2007.08.004, PMID 18631974 (Review).
- ↑ Stephen S. Dominy, Casey Lynch u. a.: Porphyromonas gingivalis in Alzheimer’s disease brains: Evidence for disease causation and treatment with small-molecule inhibitors. In: Science Advances. 5, 2019, S. eaau3333, doi:10.1126/sciadv.aau3333.
- ↑ Joachim Czichos: Bakterielle Infektion als eine Ursache der Alzheimer-Demenz. In: wissenschaft-aktuell.de. 24. Januar 2019, abgerufen am 26. Januar 2019.
- ↑ Klinische Studie (Phase I): Study of COR388 HCl in Healthy Subjects bei Clinicaltrials.gov der NIH
- ↑ Klinische Studie (Phase I): A Multiple Ascending Dose Study of COR388 bei Clinicaltrials.gov der NIH
- ↑ A. Meinelt: Molekulare Methoden zum Nachweis des oral-probiotischen Stammes Streptococcus salivarius ssp. salivarius K12 und Anwendung in vitro und in vivo. Dissertation. RWTH Aachen, 2006. Abgerufen am 15. Januar 2016.
- ↑ T. Eberhard: Die antimikrobielle photodynamische Therapie als adjuvante minimal-invasive Parodontitis- und Periimplantitistherapie: Eine longitudinale Kohortenstudie aus der Praxis; 5-Jahresergebnisse. In: ZWR-Das Deutsche Zahnärzteblatt. Band 121, Nr. 9, 2012, S. 428–439.
- ↑ Ulrich Schlagenhauf: Für gesunde Zähne. (PDF) In: UNI.KLINIK, Gesundheitsmagazin des Universitätsklinikums Würzburg. Abgerufen am 4. November 2016.
- ↑ Systematische Behandlung von Parodontopathien: Vorbericht publiziert, IQWiG, Pressemitteilung, 24. Januar 2017.
- ↑ Statement der Deutschen Gesellschaft für Parodontologie zur Nutzung der IQWiG zur systematischen Behandlung von Parodontopathien, Deutsche Gesellschaft für Parodontologie, Pressemitteilung, 25. Januar 2017.
- ↑ Bärendienst für die Patienten, KZBV kritisiert IQWiG-Vorbericht „Systematische Behandlung von Parodontopathien“, Kassenzahnärztliche Bundesvereinigung, Pressemitteilung, 24. Januar 2017.
- ↑ G-BA, BEMA-Richtlinien (PDF; 89 kB).
- ↑ BEMA-Z, PAR-Richtlinien (PDF; 239 kB)
- ↑ Mundgesundheit der deutschen Bevölkerung. Stand 2007.
- ↑ Epidemiologie der Parodontitis. In: H. Wolf u. a.: Farbatlanten der Zahnmedizin. Band 1: Parodontologie. 3. Auflage. Thieme Verlag, Stuttgart 2003, ISBN 3-13-655603-8, S. 75.
- ↑ S. Listl, J. Galloway, P. A. Mossey, W. Marcenes: Global Economic Impact of Dental Diseases. In: Journal of Dental Research. 28. August 2015, doi:10.1177/0022034515602879.