Zinkamid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| _ Zn2+ _ N3− _ H+ | ||||||||||
| Allgemeines | ||||||||||
| Name | Zinkamid | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | Zn(NH2)2 | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 97,4 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
2,13 g·cm−3[1] | |||||||||
| Löslichkeit |
nahezu unlöslich in Ammoniak[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Zinkamid ist eine anorganische chemische Verbindung des Zinks aus der Stoffgruppe der Metallamide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Amorphes Zinkamid kann durch Reaktion von Zinkdiethyl mit Ammoniak bei 150 °C gewonnen werden.[1]
Zinkamid kann auch durch Reaktion von Zinknitrat mit Kaliumamid in Ammoniak gewonnen werden, wobei sich bei Überschuss von Kaliumamid auch die Komplexverbindung Kaliumtetraamidozinkat bildet.[4]
Eigenschaften
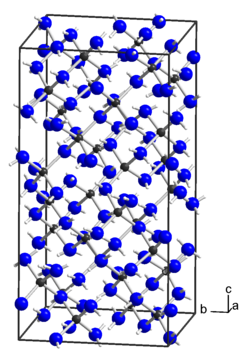
[Bearbeiten | Quelltext bearbeiten]Zinkamid ist ein farbloser Feststoff, der sich an Luft langsam zersetzt. Kristallines Zinkamid entsteht aus dem amorphen Produkt durch Erhitzen unter ammonothermalen Bedingungen im Autoklaven.[1] Die kristalline Form besitzt eine Kristallstruktur mit der Raumgruppe I41/acd (Raumgruppen-Nr. 142) und ist isotyp zu der von Magnesiumamid und Berylliumamid.[5] Die Verbindung verhält sich in Ammoniak amphoter.[2] Bei 350 °C zersetzt sie sich unter Bildung von Zinknitrid.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band 1. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 1030.
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 653.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Gopalan, R.: Inorganic Chemistry for Undergraduates. Universities Press, 2009, ISBN 81-7371-660-9, S. 139 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ B. Fröhling, G. Kreiner, H. Jacobs: Synthese und Kristallstruktur von Mangan(II)- und Zinkamid, Mn(NH2)2 und Zn(NH2)2. In: Zeitschrift für anorganische und allgemeine Chemie. 625, 1999, S. 211–216, doi:10.1002/(SICI)1521-3749(199902)625:2<211::AID-ZAAC211>3.0.CO;2-1.
- ↑ Mary Eagleson: Concise Encyclopedia Chemistry. Walter de Gruyter, 1994, ISBN 3-11-011451-8, S. 1197 (eingeschränkte Vorschau in der Google-Buchsuche).


![{\displaystyle \mathrm {Zn(NH_{2})_{2}+2\ KNH_{2}\longrightarrow K_{2}[Zn(NH_{2})_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a71dcd212079b63ba1038bbd46ceba778bdcfe7)
