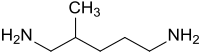
2-Methyl-1,5-diaminopentan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie – 1:1-Gemisch der Enantiomeren | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Methyl-1,5-diaminopentan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H16N2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 116,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser[1] | ||||||||||||||||||
| Brechungsindex |
1,4588 (25 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2-Methyl-1,5-diaminopentan MPMD ist ein verzweigtes aliphatisches primäres Diamin, das u. a. als Building Block für Vitamine, als Ausgangsstoff für Diisocyanate, als Härter für Epoxidharze und als Diaminkomponente für Polyamide Verwendung findet.[2]
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die österreichischen Chemiker Adolf Franke und Moritz Kohn publizierten bereits 1902 eine Synthese für 2-Methyl-1,5-diaminopentan aus 1,3-Dibrombutan[5] durch Kolbe-Nitrilsynthese mit Kaliumcyanid zu 2-Methylglutaronitril

und anschließende Hydrierung mit Natrium in siedendem Ethanol.[6]
Das bei der Dimerisierung von Acrylnitril durch Kopf-Schwanz-Verknüpfung entstehende 2-Methylenglutaronitril liefert bei vollständiger Hydrierung 2-Methylpentamethylendiamin in 80 %iger Ausbeute neben 3-Methylpiperidin (18 %).[7]
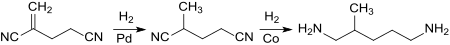
Die von Ni0-Phosphor-Komplexen katalysierte, als Hydrocyanierung bezeichnete, Addition von Cyanwasserstoff HCN an 1,3-Butadien liefert ein Gemisch von stellungsisomeren Pentennitrilen[8][9] mit der Hauptkomponente 3-Pentennitril 3PN (Vorstufe für Adiponitril) und der wichtigsten Nebenkomponente 2-Methyl-3-butennitril 2M3BN.

Weitere Hydrocyanierung von 2M3BN führt zum 2-Methylglutaronitril 2-MGN, das zur Zielverbindung 2-Methylpentan-1,5-diamin (neben wenig 3-Methylpicolin) hydriert wird.[10]
Die Synthese von 2-Methyl-1,5-diaminopentan aus einem Abfallprodukt des in industriellem Maßstab (ca. 2 Millionen Tonnen globale Kapazität[11]) hergestellten Adipodinitril (Ausgangsstoff für die Nylon 6.6-Diamin-komponente Hexamethylendiamin HMDA, sowie in geringerem Ausmaß auch für die Dicarbonsäure-komponente Adipinsäure) scheint die ökonomischste Variante zu sein.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2-Methyl-1,5-diaminopentan ist eine farblose, klare Flüssigkeit mit aminartigem Geruch, dessen wässrige Lösungen alkalisch reagieren (pH 12,1 in 5 %iger Lösung bei 25 °C[2]).
Anwendungen
[Bearbeiten | Quelltext bearbeiten]MPMD als Funktionschemikalie
[Bearbeiten | Quelltext bearbeiten]Korrosionsinhibitor: wie andere Diamine, z. B. Isophorondiamin, ist 2-Methyl-1,5-pentamethylendiamin ein wirksames Korrosionsschutzmittel in wässrigen Medien in Kontakt mit Eisenoberflächen.
Kühlschmiermittel: in Bohr-Schneidemulsionen unterdrückt 2-Methylpentan-1,5-diamin Oxidation und Verfärbung der bearbeiteten Metalloberflächen und verlängert die Funktionsdauer von Fräs-, Bohr- und Schneidwerkzeugen.
MPMD als Building Block
[Bearbeiten | Quelltext bearbeiten]Als verzweigtes aliphatisches Diamin eignet sich 1,5-Diamino-2-methylpentan zur Darstellung von Diisocyanaten durch Umsetzung mit Phosgen. Im Vergleich zu Hexamethylendiisocyanat HDI reduziert MPMD-Diisocyanat die Schmelztemperatur und erhöht die Flexibilität von Heißklebern.
Wegen seiner breiten Verfügbarkeit ist 1,5-Diamino-2-methylpentan ein bevorzugter Ausgangsstoff für die B-Vitamine Nicotinsäure bzw. Nicotinamid (Niacinamid). Dazu wird das Diamin MPMD unter Abspaltung von Ammoniak bei 335 °C praktisch quantitativ (>99,5 % Ausbeute) zu 3-Methylpiperidin MPI an einem Zeolithkontakt cyclisiert, das anschließend an einem Palladium-Magnesiumchlorid-Aluminiumoxid-Kontakt bei 280 °C mit 99,3 % Ausbeute zu 3-Methylpyridin (β-Picolin) dehydriert wird.

Die Reaktionsfolge kann auch ohne Isolierung des Zwischenprodukts MPI in zwei hintereinander geschalteten Reaktoren durchgeführt werden und liefert dann 3-Methylpyridin in 99,1 %iger Ausbeute.[12]
In der weiteren Niacinamidsynthese wird β-Picolin durch eine Ammonoxidation mit Luftsauerstoff und Ammoniak bei 330 °C in 95 %iger Ausbeute in 3-Cyanpyridin überführt, das biotechnologisch mittels immobilisierter Rhodococcus-Bakterien der Art Rhodococcus rhodochrous praktisch quantitativ zu Nicotinsäureamid umgesetzt wird.[13]
MPMD als Reaktivkomponente in Polymeren
[Bearbeiten | Quelltext bearbeiten]Der Einbau des verzweigten Diamins 2-Methyl-1,5-pentandiamin in polymere Materialien stört die parallele Anordnung der Polymerketten und behindert bzw. verhindert die Ausbildung kristalliner Strukturen. MPMD-haltige Polymere haben daher niedrigere Glasübergangstemperaturen bzw. Schmelztemperaturen. Sie sind meist leichter verarbeitbar und besitzen in vielen Fällen verbesserte Materialeigenschaften.
Epoxide: 2-Methyl-1,5-diaminopentan ist bereits bei niedrigen Temperaturen ein schneller und effizienter Härter und verkürzt die Gelierzeit bei Erhaltung der mechanischen Festigkeit von Epoxidharzen.
Polyurethane und Polyharnstoffe: 2-Methyl-1,5-pentamethylendiamin kann als Kettenverlängerer (engl. chain extender) und Vernetzer (engl. cross-linker) in Polyurethanen eingesetzt werden. Mit Diisocyanaten reagiert MPMD zu Polyharnstoffen.
Polyamide: in aliphatischen Polyamiden bewirkt der Einbau des asymmetrischen Diamins 2-Methyl-1,5-diaminopentan eine deutliche Absenkung der Schmelztemperatur (Nylon 6,6: TM=265 °C; Nylon MPMD,6: TM=184 °C), und Quenchen (rasches Abkühlen) der Schmelze lässt das MPMD-haltige Polyamid amorph erstarren. Dadurch eignen sich solche Polyamide als Heißkleber, für Pulverbeschichtungen und 3D-Druck. In teilaromatischen Polyamiden (Polyphthalamide mit Terephthalsäure PTA oder Isophthalsäure als Dicarbonsäurekomponenten) erniedrigt 2-Methyl-1,5-pentandiamin die Kristallinität, verbessert mechanische Eigenschaften, wie z. B. die Biegefestigkeit, und erhöht die Transparenz. Der Anteil teurer Reaktanden, z. B. Isophthalsäure, kann bei Zugabe von MPMD reduziert werden.[2]
Hersteller und Handelsnamen
[Bearbeiten | Quelltext bearbeiten]2-Methylpentamethylendiamin wurde ursprünglich DuPont entwickelt und auf den Markt gebracht. Heute ist es ein Produkt der Invista, die zu dem US-amerikanischen Unternehmen Koch Industries gehört und MPMD unter dem Markennamen DYTEK® A vermarktet.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Eintrag zu 2-Methylpentan-1,5-diamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. April 2020. (JavaScript erforderlich)
- ↑ a b c d e Technical Information, DYTEK® A Amine. (PDF) Invista, 5. März 2018, abgerufen am 22. April 2020.
- ↑ Eintrag zu 2-Methyl-1,5-diaminopentane bei TCI Europe, abgerufen am 22. April 2020.
- ↑ Datenblatt 1,5-Diamino-2-methylpentan bei Sigma-Aldrich, abgerufen am 22. April 2020 (PDF).
- ↑ A. Franke, M. Kohn: Über eine Synthese alkylierter Glutarsäuren aus β-Glycolen. In: Monatsh. Chem. Band 23, 1902, S. 740–746, doi:10.1007/BF01524932.
- ↑ A. Franke, M. Kohn: Über eine Synthese alkylierter Pentamethylendiamine und alkylierter Piperidine aus β-Glycolen. In: Monatsh. Chem. Band 23, 1902, S. 877–885, doi:10.1007/BF01536355.
- ↑ Patent US3408397: Methyl pentamethylene diamine process. Angemeldet am 1. Juni 1965, veröffentlicht am 31. Oktober 1967, Anmelder: National Destillers and Chemical Corp., Erfinder: J. Feldman, M. Thomas.
- ↑ Patent EP2041075B1: Process for making 3-pentenenitrile from butadiene. Angemeldet am 13. Juli 2007, veröffentlicht am 25. März 2015, Anmelder: Invista Technologies S.à.r.l., Erfinder: T. Foo, S.S. Kristjansdottir, R.J. McKinney, R. Ozer.
- ↑ N. Herrmann, D. Vogelsang, A. Behr, T. Seidensticker: Homogeneously catalyzed 1,3-diene functionalization: A success story from laboratory to miniplant scale. In: Chem. Cat. Chem. Band 10, Nr. 23, 2018, S. 5342–5365, doi:10.1002/cctc.201801362.
- ↑ Patent US4987263: Preparation of 2-methylpentadiamine. Angemeldet am 12. August 1988, veröffentlicht am 22. Januar 1991, Anmelder: Rhone-Poulenc Chimie, Erfinder: G. Cordier.
- ↑ Adiponitrile plant Shanghai Invista – Archive. Polyestertime, 25. Februar 2019, abgerufen am 24. April 2020.
- ↑ Patent EP0691955B1: Verfahren zur Herstellung von 3-Methylpiperidin und 3-Methylpyridin durch katalytische Cyclisierung von 2-Methyl-1,5-diaminopentan. Angemeldet am 30. März 1994, veröffentlicht am 28. Mai 1997, Anmelder: Lonza AG, Erfinder: J. Heveling, E. Armbruster, W. Siegrist.
- ↑ Patent US5719045: Process for preparing nicotinamide. Angemeldet am 31. Oktober 1996, veröffentlicht am 17. Februar 1998, Anmelder: Lonza AG, Erfinder: J. Heveling, E. Armbruster, L. Utiger, M. Rohner, H.-R. Dettwiler, R.J. Chuck.

