2-Methylglutaronitril
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Methylglutaronitril | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H8N2 | |||||||||||||||
| Kurzbeschreibung |
klare farblose bis braune Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 108,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,95 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
2-Methylglutaronitril (MGN) ist ein racemisches Dinitril mit einer seitenständigen Methylgruppe (α-Methyl-valerodinitril), das bei der großtechnischen Synthese von Adiponitril anfällt und Ausgangs-verbindung für das Vitamin Nicotinsäureamid und für die als „grüne“ Lösungsmittel propagierten Diester Dimethyl-2-methylglutarat und Esteramide Methyl-5-(dimethylamino)-2-methyl-5-oxopentanoat ist.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]2-Methylglutaronitril ist ein Nebenprodukt der Produktion von Adiponitril, der Vorstufe von Hexamethylendiamin und Adipinsäure als Bausteine für Polyamid 6.6.
Ausgehend von 1,3-Butadien oder einem butadienreichen (>40 Volumenprozent) C4-Schnitt aus einem Naphtha-Steamcracker wird in der ersten Stufe in einer Hydrocyanierung mit Ni0-Phosphin [PR3]-Katalysatoren[5] bzw. Phosphit [P(OR)3]- oder Phosphonit [P(OR)2R]-Katalysatoren[6] ein Gemisch von Pentennitrilen erhalten, das hauptsächlich trans-3-Pentennitril neben den Isomeren 2-Methyl-2-butennitril, 4-Pentennitril und 2-Pentennitril enthält.
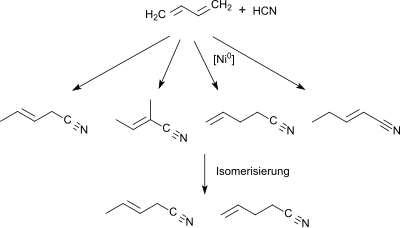
Das Gemisch der monoolefinischen C5-Mononitrile wird einer Isomerisierung mit einem Hydrocyanierungs-katalysator und einer Lewis-Säure, wie z. B. ZnCl2 zu 3- und 4-Pentennitril unterworfen[6] und in der dritten Stufe erneut mit Cyanwasserstoff zu einem Gemisch von Dinitrilen umgesetzt, das neben 2-Methyl-glutaronitril Adiponitril und 2-Ethylsuccinonitril enthält.

Daraus kann 2-MGN durch fraktionierte Destillation abgetrennt werden.[7]
Als unerwünschtes Nebenprodukt der Adiponitril-Produktion wurde die 2-MGN-reiche Fraktion mit der typischen Zusammensetzung von ca. 86 Gew.% 2-MGN, 11 Gew.% 2-Ethylsuccinonitril und 3 Gew.% ADN[8], bisher als Abfallstoff verbrannt.[9]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2-Methylglutaronitril ist eine sehr unangenehm riechende, klare, farblose bis braune Flüssigkeit mit niedrigem Dampfdruck und einem Flüssigbereich von >300 °C. Die Verbindung ist sehr giftig, insbesondere beim Einatmen.[1]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]2-Methylglutaronitril kann durch Umsetzung mit Wasserstoff an Platin- oder Palladium-Kontakten bei Temperaturen von 250 bis 400 °C in 3-Methylpyridin (β-Picolin) überführt werden.[10][11]

Neben 3-Methylpyridin fällt dabei auch 3-Methylpiperidin als Nebenprodukt an, aus dem durch Dehydrierung weiteres β-Picolin erhalten werden kann.
Ammonoxidation von 3-Methylpyridin an Übergangsmetallkontakten liefert 3-Cyanpyridin (Nicotinsäurenitril) in Ausbeuten von 95 %.[12]

Nitrilase-katalysierte Hydrolyse des 3-Cyanopyridins mittels immobilisierter Rhodococcus-Stämme führt in quantitativer Ausbeute zum Nicotinsäureamid (Vitamin B3).
Hydrierung einer Lösung von 2-MGN in Ethanol in Gegenwart Raney-Cobalt bei 15 bar und 100 °C liefert 2-Methylpentan-1,5-diamin.[13]

2-Methylpentandiamin lässt sich bei 300 bis 400 °C an einem Zeolith-Kontakt in 3-Methylpiperidin überführen und anschließend an einem Palladium-Kontakt zu 3-Methylpyridin dehydrieren, das über Nicotinsäurenitril in Nicotinsäureamid überführt werden kann.[12]
Das racemische Diamin kann auch zur Darstellung spezieller Polyamide und nach Umsetzung mit Phosgen zum 2-Methylpentandiisocyanat[14] als Reaktionskomponente in Polyurethanen verwendet werden. Nitrilasen hydrolysieren in α,ω-Dinitrilen regioselektiv die ω-Nitrilgruppe ohne die fassbare Amid-Zwischenstufe direkt zur Carboxygruppe. Dabei entsteht in hoher Ausbeute 4-Cyanpentansäure.[15]

Das Ammoniumsalz der 4-Cyanpentansäure kann durch katalytische Hydrierung in Gegenwart von Methylamin in 1,5-Dimethyl-2-piperidon,[16][17] einem umweltverträglichen Lösungsmittel, überführt werden.[18]

Die Hydrolyse beider Nitrilgruppen des 2-Methylglutaronitrils mit z. B. 20%iger Natronlauge bei 50 °C und anschließendes Ansäuern erzeugt 2-Methylglutarsäure.[4]

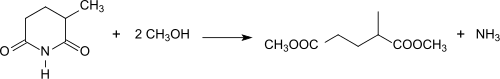
Ausgehend von 2-Methylglutaronitril kann die Hydrolyse zur 2-Methylglutarsäure auch über das 2-Methylglutarimid erfolgen, das beim Erhitzen eines 2-MGN/Wasser-Gemischs auf 275 °C in Gegenwart eines Titandioxid-Katalysators in Ausbeuten von 94 % erhalten wird.[19]

Hydrolyse im Alkalischen liefert 2-Methylglutarsäure.
Die Reaktion von 2-Methylglutarimid mit z. B. Methanol (Methanolyse) erzeugt in Gegenwart von Titandioxid[8] bzw. Lanthanoxid[20] den Diester Dimethyl-2-methylglutarat[21], der als umweltfreundliches aprotisch dipolares Lösungsmittel unter dem Namen Rhodiasolv® IRIS mit der typischen Zusammensetzung 87–89 % Dimethyl-2-methylglutarat, 9–11 % Dimethyl-2-ethylsuccinat und 1–2 % Dimethyladipat[9] als Ersatz für Aceton, Dichlormethan, N-Methylpyrrolidon u. ä. kommerzialisiert wurde.
Das Estergemisch weist große Ähnlichkeit mit den so genannten dibasischen Estern auf, wie sie als FlexiSolv® DBE® esters im Handel sind.[22]
Der Diester lässt sich mit Dimethylamin in Methanol/Natriummethanolat selektiv in ein Gemisch von 1- bzw. 5-substituierten Methylesteramiden überführen[23], die unter dem Namen Rhodiasolv® Polarclean als Formulierungshilfsmittel für Pflanzenschutzzubereitungen eingesetzt werden.[9] Die erhaltenen Esteramide sind leicht bioabbaubar und auch im Vergleich zu den häufig verwendeten N-Methylpyrrolidon, Cyclohexanon oder Isophoron gute Lösungsmittel für eine Vielzahl unterschiedlicher Pflanzenschutzmittel wie Insektizide oder Fungizide.
Andere Esteramide leiten sich z. B. von 2-MGN ab, die nach alkalischer Hydrolyse zur 2-Methylglutarsäure, Cyclisierung mit Acetanhydrid zum 2-Methylglutarsäureanhydrid, Reaktion mit Dimethylamin zum Monoamid, Säurechloridbildung mit Thionylchlorid und Veresterung mit hydrophoberen Alkoholen, wie z. B. Butanole oder Cyclohexanol gebildet werden.[24]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Solvay: GPS Safety Summary, 2-methylglutaronitrile ( vom 5. August 2014 im Internet Archive)
- ↑ a b c d e f g h Datenblatt 2-Methylglutaronitril 99% bei Sigma-Aldrich, abgerufen am 28. April 2016 (PDF).
- ↑ a b c Eintrag zu 2-Methylglutaronitrile bei TCI Europe, abgerufen am 28. April 2016.
- ↑ a b INVISTA, Technical Information, DYTEK® Methylglutaronitrile (MGN)
- ↑ Patent US5856555: Process for the hydrocyanation of organic compounds containing ethylenic unsaturation. Angemeldet am 11. April 1997, veröffentlicht am 5. Januar 1999, Anmelder: Rhone-Poulenc Fiber & Resin Intermediates, Erfinder: M. Huser, R. Perron.
- ↑ a b Patent US6242633B1: Catalyst comprising at least one phosphonite ligand based Nickel (0) complex and method for the production of nitriles. Angemeldet am 9. September 1998, veröffentlicht am 5. Juni 2001, Anmelder: BASF AG, Erfinder: J. Fischer, W. Siegel.
- ↑ Patent US7816551B2: Method for producing dinitriles. Angemeldet am 27. Januar 2005, veröffentlicht am 19. Oktober 2010, Anmelder: BASF AG, Erfinder: T. Jungkamp, R. Baumann, M. Bartsch, G. Haderlein, H. Luyken, J. Scheidel.
- ↑ a b Patent US8053594B2: Preparation of diesters from imide/dinitrile compounds. Angemeldet am 5. Juli 2007, veröffentlicht am 8. November 2011, Anmelder: Rhodia Operations, Erfinder: P. Leconte, P. Marion, R. Jacquot.
- ↑ a b c Sustainable solvents, products and process innovations. (PDF; 1 MB) In: chemspeceurope.com. Rhodia, member of the Solvay group, archiviert vom am 12. Mai 2016; abgerufen am 28. April 2016 (englisch).
- ↑ Patent CH654576A5: Verfahren zur Herstellung von 3-Methylpyridin. Angemeldet am 29. Juli 1982, veröffentlicht am 28. Februar 1986, Anmelder: Lonza AG, Erfinder: E.J. Newson, T.-B. Truong.
- ↑ Patent US4876348: Process for making 3-cyanopyridine. Angemeldet am 29. Oktober 1985, veröffentlicht am 24. Oktober 1989, Anmelder: The Standard Oil Co., Erfinder: R. DiCosimo, J.D. Burrington, D.D. Suresh.
- ↑ a b Patent US5719045: Process for preparing nicotinamide. Angemeldet am 31. Oktober 1996, veröffentlicht am 17. Februar 1998, Anmelder: Lonza AG, Erfinder: J. Heveling, E. Armbruster, L. Utiker, M. Rohner, H.-R. Dettwiler, R.J. Chuck.
- ↑ Patent US4987263: Preparation of 2-methylpentadiamine. Angemeldet am 12. August 1988, veröffentlicht am 22. Januar 1991, Anmelder: Rhone-Poulenc Chimie, Erfinder: G. Cordier.
- ↑ Patent WO2008074645A1: Process for preparing 2-methylpentane-1,5-diisocyanate from methylglutaronitrile. Angemeldet am 6. Dezember 2007, veröffentlicht am 26. Juni 2008, Anmelder: BASF SE, Erfinder: P. Pfab, E. Ströfer, C. Knösche, E. Schwab, M. Klötzer, G. Georgi.
- ↑ Patent US6551804: Process for preparing 4-cyanopentanoic acid. Angemeldet am 22. Januar 2001, veröffentlicht am 22. April 2003, Anmelder: E.I. Du Pont de Nemours and Co., Erfinder: R. DiCosimo, R.D. Fallon, J.E. Gavagan.
- ↑ Patent US5814508: Preparation of lactams from aliphatic α,ω-dinitriles. Angemeldet am 13. August 1997, veröffentlicht am 29. September 1998, Anmelder: E.I. Du Pont de Nemours and Co., Erfinder: R. DiCosimo, R.D. Fallon, J.E. Gavagan, F.E. Herkes.
- ↑ F.B. Cooling et al.: Chemoenzymatic production of 1,5-dimethyl-2-piperidone. In: J. Mol. Cat. B: Enzymat. Band 11, Nr. 4–6, 2001, S. 295–306, doi:10.1016/S1381-1177(00)00150-8.
- ↑ Patent US6261381B1: Composition and process for cleaning inks from various substrates including printing plates. Angemeldet am 9. November 2000, veröffentlicht am 17. Juli 2001, Anmelder: MacDermid, Inc., Erfinder: G. Wojcik.
- ↑ Patent US20150175515A1: Process for preparing diacid compounds. Angemeldet am 26. Juni 2013, veröffentlicht am 25. Juni 2015, Anmelder: Rhodia Operations, Erfinder: R. Jacquot, B. Rhers.
- ↑ Patent US20120071686A1: Production of diesters from dinitrile compounds. Angemeldet am 21. Oktober 2008, veröffentlicht am 22. März 2012, Erfinder: R. Jacquot, P. Leconte.
- ↑ Solvay: GPS Safety Summary, Dimethyl 2-methylglutarate ( vom 5. August 2014 im Internet Archive)
- ↑ INVISTA’s DBE® esters, FlexiSolv® DBE® esters ( vom 16. November 2016 im Internet Archive)
- ↑ Patent US20130237722A1: Process for preparing esteramide compounds. Angemeldet am 9. Juni 2011, veröffentlicht am 12. September 2013, Anmelder: Rhodia Operations, Erfinder: T. Vidal, R. Rached, M. Guglieri.
- ↑ Patent US20140221211A1: Use of esteramides as solvents, novel esteramides and process for preparing esteramides. Angemeldet am 9. April 204, veröffentlicht am 7. August 2014, Anmelder: Rhodia Operations, Erfinder: O. Jentzer, M. Guglieri.
