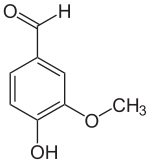
Vanillin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Vanillin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C8H8O3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, nach Vanille riechende Nadeln[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 152,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,06 g·cm−3 (20 °C)[4] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Vanillin (4-Hydroxy-3-methoxybenzaldehyd, FEMA 3107[1]) ist der Hauptaromastoff in den Kapselfrüchten der Gewürzvanille (Vanilla planifolia) sowie ein naturidentischer Aromastoff. Die organische chemische Verbindung mit der Summenformel C8H8O3 ist ein Derivat des Benzaldehyds mit je einer zusätzlichen Hydroxy- und Methoxygruppe.
Vanillin ist der Hauptbestandteil des natürlichen Vanilleextrakts, einer Mischung aus mehreren hundert verschiedenen Verbindungen. Aus diesem eher raren Naturprodukt wurde Vanillin schon Mitte des 19. Jahrhunderts isoliert, 1874 gelang die erste Synthese aus dem Naturstoff Coniferin. Die ersten kommerziellen Herstellungsverfahren von Vanillin gingen später von Eugenol aus. Heute wird Vanillin als naturidentisch kostengünstig aus Guajacol synthetisiert oder aus Lignin gewonnen, einem Bestandteil von Holz und dem häufigsten Nebenprodukt der industriellen Zellstoffherstellung. Das Vanillin im Lignin trägt auch zum typischen Geruch alten Papiers bei. Daneben sind inzwischen mehrere biotechnologische Verfahren etabliert, deren Produkte als „natürlich“ deklariert werden dürfen.
Vanillin ist weltweit mengenmäßig der wichtigste Aromastoff, der zudem preisgünstig hergestellt werden kann. Er wird in Lebensmitteln, Getränken, Speiseeis, Backwaren und Schokolade sowie in der Parfüm- und Pharmaindustrie verwendet.
Geschichte
[Bearbeiten | Quelltext bearbeiten]
Vanille als Aroma wurde von präkolumbischen Völkern Mittelamerikas geschätzt. Die Azteken nutzten sie für die Bereitung des Getränks cacahuatl, als Hernán Cortés Mexiko eroberte. Damit wurden um das Jahr 1520 Europäern sowohl der Kakao als auch die Vanille bekannt.[9]
Vanillin wurde erstmals im Jahre 1858 als relativ reine Substanz von Nicolas-Théodore Gobley isoliert; dies geschah durch vollständiges Eindampfen eines Vanilleextrakts und anschließendes Umkristallisieren aus heißem Wasser.[10] Im Jahr 1874 gelang erstmals dem Chemiker Wilhelm Haarmann zusammen mit Ferdinand Tiemann in Holzminden die Herstellung von Vanillin aus Coniferin, das im Rindensaft von Nadelhölzern (Coniferen) vorkommt.[11]
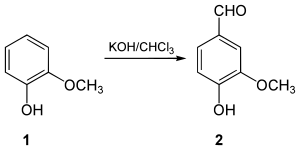
1876 synthetisierte Karl Reimer erstmals aus Guajacol (1) das Vanillin (2).[12] In der später als Reimer-Tiemann-Reaktion benannten Synthese wird Guajacol im Alkalischen mit Chloroform umgesetzt.[13] Dabei reagiert zuerst Chloroform mit der Base zu Dichlorcarben. Dieses lagert sich am Phenolat-Anion des Guajacols an.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]

Vanillin findet sich am häufigsten in den meist falsch als Schoten bezeichneten Kapselfrüchten der Gewürzvanille (Vanilla planifolia) (1,5–4 %), ferner auch in Styrax, Gewürznelken und anderen Pflanzen.[3] Die frisch geernteten grünen Samenkapseln enthalten Vanillin in Form seines β-D-Glucosids Vanillosid[3]. Die grünen Hülsen besitzen nicht den Geschmack oder Geruch von Vanille.[14] Relativ reines Vanillin kann sich als weißer Staub oder „Frost“ auf der Außenseite der Hülsen abscheiden.
In niedrigeren Konzentrationen trägt Vanillin zum Geschmack und Aroma von Lebensmitteln in vielfältiger Weise bei: in Olivenöl,[15] Butter,[16] Himbeeren[17] und Lychee-Früchten.[18] Bei der Reifung von Weinen und Spirituosen in Eichenfässern trägt Vanillin gleichfalls zum Geschmacksprofil bei.[19] In anderen Lebensmitteln entsteht durch Wärmebehandlung Vanillin aus anderen vorhandenen Inhaltsstoffen. Auf diese Weise trägt Vanillin zum Geschmack und Aroma von geröstetem Kaffee bei,[20][21] ferner in Ahornsirup[22] und Vollkornprodukten, einschließlich Mais-Tortillas[23] und Haferflocken.[24]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Natürliche Quellen
[Bearbeiten | Quelltext bearbeiten]Die bis zu 30 cm langen Kapselfrüchte der Gewürzvanille werden kurz vor der Reife geerntet. Diese haben noch nicht das typische Aroma und den Geschmack des fertigen Produkts. Zur Gewinnung werden die Früchte der sogenannten Schwarzbräunung unterzogen. Zuerst werden die Kapselfrüchte heißwasser- oder wasserdampfbehandelt, anschließend folgt eine Fermentation in luftdichten Behältern. Durch die Trocknungs- und Fermentierungsprozesse wandeln sich die β-D-Glucoside des Vanillins in Vanillin und Glucose um.


Ein Großteil des Vanillins wird aus den bei der Zellstoffherstellung anfallenden Sulfitabfällen gewonnen. Die hierin enthaltene Ligninsulfonsäure wird bei erhöhter Temperatur und erhöhtem Druck mit Oxidantien und Alkalien behandelt, wobei unter anderem Vanillin entsteht, das durch Extraktion, Destillation und Kristallisation gereinigt wird.[25][26] Die Ausbeuten betragen je nach Holzart 7–25 %.[27] Dieses künstliche Vanille-Aroma auf Lignin-Basis besitzt ein reicheres Geschmacksprofil. Dies ist auf die Anwesenheit von Acetovanillon als Lignin-Folgeprodukt zurückzuführen – eine Verunreinigung, die in Vanillin aus einer Guajacolsynthese nicht auftritt.[9]
Technische Synthesen
[Bearbeiten | Quelltext bearbeiten]- Vanillin lässt sich technisch durch Isomerisierung von Eugenol (1) zu Isoeugenol (2) mittels Alkalien und anschließender Oxidation durch Kaliumpermanganat oder Ozon gewinnen.[26][27]
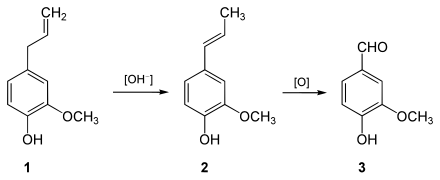
- Eine Synthese im Labormaßstab erfolgt durch eine elektrophile Bromierung von 4-Hydroxybenzaldehyd (1) zum 3-Brom-4-hydroxybenzaldehyd[28] (2), gefolgt von einer Kupfer-katalysierten Methoxylierung zum Vanillin (3):[29]

- Mittels der Vilsmeyer-Haack-Synthese erhält man Vanillin aus Guajacol in etwa 70%iger Ausbeute.[27] Guajacol und N-Methylformanilid reagieren in Gegenwart von Phosphoroxychlorid als Katalysator unter Bildung von Vanillin.[30]
- Guajacol lässt sich mit Formaldehyd und 3-Nitrobenzolsulfonsäure in einem mehrere Tage dauernden Prozess zu Vanillin und Metanilsäure umwandeln.
- Eine weitere Möglichkeit ist die Substitutionsreaktion von Guajacol (1) mit Glyoxylsäure und anschließende Oxidation der gebildeten Vanillinmandelsäure (2) zu 4-Hydroxy-3-methoxyphenylglyoxylsäure (3), die zu Vanillin (4) decarboxyliert wird.[9]

- Eine weitere häufig verwendete Methode ist die Fries-Umlagerung von Guajacolacetat in Acetovanillon und nachfolgender Degradation zu Vanillin.[31]
Biotechnologische Methoden
[Bearbeiten | Quelltext bearbeiten]Alternativ stehen verschiedene biotechnologische Methoden zur Verfügung.[32][33] Vanillin kann beispielsweise durch Amycolatopsis- oder Streptomyces-Stämme aus Ferulasäure hergestellt werden. Die Ferulasäure kann ebenfalls biotechnologisch mit Hilfe von Pseudomonas-Stämmen aus Eugenol im Fed-Batch-Verfahren (Eugenol ist toxisch für die Zellen) hergestellt werden. Eugenol ist ein gut verfügbarer Rohstoff und stammt aus Nelkenöl. Ebenfalls dient Curcumin als Präkursor von Vanillin, mit Hilfe der Bakterien Rhodococcus rhodochrous wird dieses durch Biotransformation gewonnen.[34] Möglich ist auch die Gewinnung aus Glucose durch genetisch modifizierte Escherichia coli Bakterien und nachfolgender Dehydrogenase.[31]
Es kann auch über den Shikimisäureweg aus Hefekulturen hergestellt werden.[35]
Vanillin als Produkt des Shikimisäurewegs (1). Endprodukte dieses Wegs chemischer Reaktionen sind die Aminosäuren Phenylalanin, Tyrosin und Tryptophan. Phenylalanin (2) wird biosynthetisch mit Hilfe des Enzyms Phenylalanin-Ammoniak-Lyase (PAL) unter Freisetzung von Ammoniak (NH3) zu Zimtsäure (3) umgesetzt. Dies ist der erste Schritt in der Biosynthese der Phenylpropanoide.[36][37][38]
Zwei wesentliche Wege sind in Diskussion, wie auf Basis von Phenylpropanoidverbindungen die Schritte zum Vanillin verlaufen: der Ferulasäureweg und der Benzoatweg. Beide gehen zunächst von einer p-Hydroxylierung der Zimtsäure zur p-Cumarsäure (4-Hydroxyzimtsäure) (4) aus. Danach folgen drei Reaktionsschritte, deren Reihenfolge unterschiedlich ist, aber letztlich zum Zielmolekül führen.
- Im Ferulasäureweg erfolgt zunächst eine Hydroxylierung an der 3-Position im Ring zur Kaffeesäure (5) und anschließend deren Methylierung zur Ferulasäure (6), schließlich die Spaltung der Doppelbindung zum Aldehyd, dem Vanillin (7).
- Im Benzoatweg erfolgt hingegen zuerst die Spaltung der Doppelbindung zum 4-Hydroxybenzaldehyd (8), anschließend die Hydroxylierung an der 3-Position im Ring zum Protocatechualdehyd (9) und schließlich deren Methylierung zum Vanillin (7).

Die Hydroxylierungen von 3 nach 4 und von 8 nach 9 werden vom Enzym Diphenolase katalysiert. Die Diphenolase wirkt bei letzterer Reaktion als Monophenoloxidase;[39] diese Aktivität hat momentan eine unterschiedliche EC-Nummer (EC 1.14.18.1), es handelt sich aber um dasselbe Enzym.[40]
Im Gegensatz zur chemischen Herstellung („naturidentisch“) darf das biotechnologisch hergestellte Vanillin als „natürlich“ deklariert werden.
Biosynthetisches Vanillin ist etwa 60-mal teurer als synthetisches (2015), aber immer noch billiger als natürliches.[35]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Vanillin tritt in Form farbloser, charakteristisch süßlich riechender Nadeln auf, die an feuchter Luft allmählich zu Vanillinsäure oxidieren.[3] Vanillin löst sich schlecht in Wasser (10 g/l bei 25 °C)[4] hingegen gut in Ethanol und Diethylether.[3] Die Verbindung tritt in zwei polymorphen Kristallformen auf.[5] Die Form I schmilzt bei 82 °C mit einer Schmelzenthalpie von 22,4 kJ·mol−1.[5] Sie kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21 (Raumgruppen-Nr. 4) mit den Gitterparametern a = 1404,9 pm, b = 787,4 pm, c = 1501,7 pm, β = 115,45° und vier Formeleinheiten pro Elementarzelle.[41] Die Form II schmilzt bei 80 °C mit einer Schmelzenthalpie von 20,7 kJ·mol−1.[5] Beide Kristallformen stehen monotrop zueinander, wobei Form I die thermodynamisch stabile Kristallform ist. Vanillin siedet bei 285 °C bei Normaldruck in einer CO2-Atmosphäre[3] bzw. 154 °C bei Unterdruck (13 hPa).[4]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Substanz leitet sich strukturell sowohl vom Benzaldehyd als auch vom Guajacol (2-Methoxyphenol) ab. Infolge seines bifunktionalen Charakters ist Vanillin sehr reaktionsfreudig. Durch Veretherung, Veresterung oder Aldolkondensation sind sehr viele Derivate synthetisierbar. Durch Angriff am aromatischen Ring sind weitere Reaktionen möglich. Eine katalytische Hydrierung von Vanillin führt zu Vanillylalkohol bzw. zu 2-Methoxy-4-methylphenol.[42] Vanillin kann enzymatisch zur Vanillinsäure oxidiert werden.[43] Eine wässrige Lösung von Eisen(III)-chlorid bildet mit Vanillin eine blauviolette Färbung.[3]
Der pKs-Wert der phenolischen OH-Gruppe beträgt 7,40 (25 °C).[3][7] Dieser Wert ist gegenüber dem Phenol mit 9,99[7] deutlich niedriger; die elektronenziehende Aldehydgruppe erhöht durch ihren −M-Effekt die OH-Acidität; die phenolische OH-Bindung wird zunehmend polarisiert. Der pKs-Wert des 4-Hydroxybenzaldehyds bewegt sich bei einem ähnlichen Wert und beträgt 7,66;[7] die fehlende Methoxygruppe macht hier kaum einen Unterschied aus. Zum Vergleich besitzt auch das Guajacol (2-Methoxyphenol) mit seinem pKs-Wert von 9,98[7] praktisch keinen Unterschied zum Phenol mit 9,99.
Isomere und strukturelle Verwandte
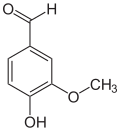
[Bearbeiten | Quelltext bearbeiten]Isovanillin (3-Hydroxy-4-methoxybenzaldehyd) ist ein Isomer und unterscheidet sich vom Vanillin durch die Stellung der Methoxygruppe. Anstatt an Position 3 ist diese hier an Position 4 vorzufinden. Hydroxy- und Methoxygruppe tauschen im Vergleich zum Vanillin die Plätze.
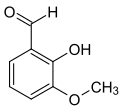
ortho-Vanillin (2-Hydroxy-3-methoxybenzaldehyd) ist gleichfalls ein Isomer und unterscheidet sich vom Vanillin durch die Stellung der Hydroxygruppe. Die Vorsilbe ortho- kennzeichnet hier die Position der Hydroxygruppe im Substitutionsmuster bezüglich der Aldehydgruppe; im Vanillin befinden sich diese beiden Gruppen in para-Stellung.
 |
 |
|
| Isovanillin | Vanillin | ortho-Vanillin |
Ethylvanillin (3-Ethoxy-4-hydroxybenzaldehyd) ist ein struktureller Verwandter und unterscheidet sich vom Vanillin, indem man die Methylgruppe gegen eine Ethylgruppe austauscht. Es kommt nicht natürlich vor, sondern wird auf dem Syntheseweg hergestellt. Heute wird es oft als künstlicher Aromastoff anstelle des teureren Vanillins verwendet, da es etwa halb soviel kostet und zudem zwei- bis viermal intensiver in Geschmack und Aroma ist.[44]
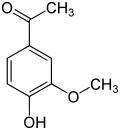
Acetovanillon (4-Hydroxy-3-methoxyacetophenon, auch Apocynin) ist gleichfalls ein struktureller Verwandter und unterscheidet sich vom Vanillin, indem man die Aldehydgruppe gegen eine Acetylgruppe austauscht. Es entsteht in künstlichen Vanille-Aromen auf Lignin-Basis.[9]
 |
 |
|
| Ethylvanillin | Vanillin | Acetovanillon |
Vanillin und Ethylvanillin besitzen einen ähnlichen Geruch, der des Isovanillins ist hingegen kaum merkbar.[45] Vanillin und Ethylvanillin lassen sich mit Gemischen aus Hexan und Essigsäureethylester per Dünnschichtchromatographie gut trennen.[46]
Veratrumaldehyd (3,4-Dimethoxybenzaldehyd), auch Methylvanillin ist gleichfalls ein struktureller Verwandter mit der gleichen Summenformel.
Als Ersatzstoff wird auch Propenylguaethol (Vanitrope) verwendet, es besitzt ein typisches Vanillinaroma und dessen Geruch ist etwa 15-mal intensiver als der von Vanillin.[47]
Analytik
[Bearbeiten | Quelltext bearbeiten]Die zuverlässige qualitative und quantitative Bestimmung von Vanillin in unterschiedlichen Untersuchungsmaterialien gelingt nach hinreichender Probenvorbereitung durch den Einsatz der Gaschromatographie oder HPLC gekoppelt mit der Massenspektrometrie.[48][49][50][51][52]
Die Bestimmung von Vanillin kann auch zur Überprüfung der Güteklassen von Olivenöl als Markersubstanz herangezogen werden. Dieser analytische Einsatz zur Prüfung auf Authentizität in extrem fetthaltiger Matrix erfordert jedoch besondere Verfahren.[53]
Verwendung
[Bearbeiten | Quelltext bearbeiten]
Vanillin ist mengenmäßig der wichtigste Aromastoff weltweit, nicht zuletzt, da er technisch preisgünstig hergestellt werden kann. Man geht von einem Verbrauch von etwa 15.000 Tonnen im Jahr aus (2004).[3] Die rund 2.000 Tonnen Kapselfrüchte echter Vanille, die jährlich weltweit geerntet werden, enthalten aber nur etwa 40 Tonnen Vanillin (der Vanillingehalt einer handelsüblichen Vanille-Schote beträgt zwischen 1,6 und 2,4 % laut ISO-Norm 5565-1:1999). Über 99,7 % des in Verkehr gebrachten Vanillins sind also nicht natürlichen Ursprungs.
Vanillezucker ist eine Zubereitung mit dem natürlichen Vanillearoma von mindestens 1 g gemahlenen Vanilleschoten oder deren Extrakten auf 16 g Zucker (Saccharose), Vanillinzucker enthält die aromatisierende Beimengung von mindestens 0,17 g Vanillin auf 16 g Zucker.[54] Vanillin wird als Aromastoff in verschiedenen Lebensmitteln verwendet, unter anderem in Speiseeis, Backwaren und Schokolade. Daneben ist Vanillin einer von vielen Duftstoffen bei der Parfümherstellung und zur Geschmacksverbesserung von Pharmazeutika und Vitaminpräparaten, wo er in kleinen Mengen zur Abrundung und Fixierung von süßen, balsamischen Düften verwendet wird.
Auch in der chemischen Industrie wird Vanillin verwendet, beispielsweise als Ausgangsstoff oder Zwischenprodukt bei der Synthese von verschiedenen Arzneistoffen, wie beispielsweise Levodopa, Methyldopa und Papaverin. Es ist außerdem Bestandteil von Günzburgs Reagenz – einer alkoholischen Lösung von Phloroglucin und Vanillin zum qualitativen Nachweis der freien Salzsäure im Magensaft.[3]
Vanillin wird in der Histologie bei der Vanillin-HCl-Färbung zum Färben von Tanninen verwendet. Vanillin kann als Nachweisreagenz zur Derivatisierung von Verbindungen bei der Dünnschichtchromatographie verwendet werden. Dabei wird die entwickelte Platte durch Aufsprühen oder Tauchen mit einer Vanillin-Schwefelsäure-Lösung benetzt und erhitzt. Einige Verbindungen zeigen dabei charakteristische Farbreaktionen, anhand derer sie identifiziert werden können.
Weitere Reaktionen und Enzyme
[Bearbeiten | Quelltext bearbeiten]- Vanillin-Dehydrogenase – Enzym, katalysiert Vanillin zur Vanillinsäure
- Vanillin-Synthase – Katalyse
- Vanillylalkohol-Oxidase – Enzym, katalysiert verschiedene phenolische Verbindungen durch Oxidation
- Vanillat-Monooxygenase – Katalyse von Vanillat zu Protocatechusäure
Literatur
[Bearbeiten | Quelltext bearbeiten]- Beilstein. E IV 8, 1763.
- Deutsche Vanille. In: Die Gartenlaube. Heft 32, 1875, S. 548 (Volltext [Wikisource]).
- Alfons M. Burger: Die natürlichen und künstlichen Aromen. Hüthig-Verlag, Heidelberg 1968.
- Jean-Paul Vidal: Vanillin. In: Food and Feed Technology. In: Kirk-Othmer Food and Feed Technology, Band 2. John Wiley & Sons, New York 2007, ISBN 978-0-470-17448-7, S. 526–538, eingeschränkte Vorschau in der Google-Buchsuche, doi:10.1002/0471238961.2201140905191615.a01.pub2.
- Andrew J. Taylor, Robert Linforth (eds.): Food Flavour Technology. Wiley-Blackwell, Oxford 2010, ISBN 978-1-4051-8543-1, S. 170, eingeschränkte Vorschau in der Google-Buchsuche.
- Björn Bernhard Kuhse: Vanillin – Historie und Schulrelevanz. Die Geschichte einer regionalen Riechstoffindustrie und deren Verwendung in einem praxisorientierten Chemieunterricht. Dissertation der Universität Bielefeld. Cuvillier Verlag, Göttingen 2010, ISBN 978-3-86955-459-4, Inhaltsverzeichnis.
- Georg Schwedt: Am Anfang war das Vanillin: Die Väter der Aromen-Industrie in Holzminden. Books on Demand, Norderstedt 2017, ISBN 978-3-7448-9306-0, eingeschränkte Vorschau in der Google-Buchsuche.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Vanille aus Orchideen, Vanillin aus Holz (www.chemieunterricht.de).
- Simon Cotton (Uppingham School, Rutland, UK): Vanillin.
- Eintrag zu Vanillin in der Human Metabolome Database (HMDB), abgerufen am 8. Dezember 2013.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu FEMA 3107 in der Datenbank der Flavor and Extract Manufacturers Association of the United States.
- ↑ Eintrag zu VANILLIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. Februar 2020.
- ↑ a b c d e f g h i j k l m Eintrag zu Vanillin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2014.
- ↑ a b c d e f g h i j Eintrag zu Vanillin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c d e Braga, D.; Grepioni, F.; Maini, L.; Mazzeo, P.P.; Rubini, K.: Solvent-free preparation of co-crystals of phenazine and acridine with vanillin in Thermochim. Acta 507–508 (2010) 1–8, doi:10.1016/j.tca.2010.04.021
- ↑ Datenblatt Vanillin (PDF) bei Carl Roth, abgerufen am 5. August 2016.
- ↑ a b c d e CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Cecilia Guízar González, Natali Rianika Mustafa, Erica Georgina Wilson, Robert Verpoorte, Young Hae Choi: Application of natural deep eutectic solvents for the “green”extraction of vanillin from vanilla pods. In: Flavour and Fragrance Journal. Band 33, Nr. 1, Januar 2018, S. 91–96, doi:10.1002/ffj.3425.
- ↑ a b c d Lawrence J. Esposito, K. Formanek, G. Kientz, F. Mauger, V. Maureaux, G. Robert, F. Truchet: Vanillin. In: Kirk-Othmer Encyclopedia of Chemical Technology. 4. Auflage. Vol. 24. John Wiley & Sons, New York 1997, S. 812–825.
- ↑ N.-T. Gobley: Recherches sur le principe odorant de la vanille. In: Journal de Pharmacie et de Chimie. 34, 1858, S. 401–405; Textarchiv – Internet Archive.
- ↑ Ferd. Tiemann, Wilh. Haarmann: Ueber das Coniferin und seine Umwandlung in das aromatische Princip der Vanille. In: Berichte der Deutschen Chemischen Gesellschaft, 7 (1), 1874, S. 608–623 (doi:10.1002/cber.187400701193).
- ↑ K. Reimer: Ueber eine neue Bildungsweise aromatischer Aldehyde., In: Berichte der deutschen chemischen Gesellschaft. 9 (1), 1876, S. 423–424 (doi:10.1002/cber.187600901134).
- ↑ W. Brandt, A. Braun, R. Brieger, H. Dieterle, R. Dietzel, W. Moeser, P. N. Schürhoff, F. Stadlmayr, O. Wiegand: Kommentar zum Deutschen Arzneibuch. 6. Ausgabe. 1926, S. 661. (Reprint: Springer-Verlag, 2013, ISBN 978-3-642-90746-3)
- ↑ Nicholas J. Walton, Melinda J. Mayer, Arjan Narbad: Vanillin. In: Phytochemistry. 63 (5), 2003, S. 505–515 (doi:10.1016/S0031-9422(03)00149-3).
- ↑ Manuel Brenes, Aranzazu García, Pedro García, José J. Rios, Antonio Garrido: Phenolic Compounds in Spanish Olive Oils. In: Journal of Agricultural and Food Chemistry, 47 (9), 1999, S. 3535–3540 (doi:10.1021/jf990009o).
- ↑ Mohamed Adahchour, René J. J. Vreuls, Arnold van der Heijden, Udo A. Th. Brinkman: Trace-level Determination of Polar Flavour Compounds in Butter by Solid-phase Extraction and Gas Chromatography-Mass Spectrometry. In: Journal of Chromatography A, 844 (1–2), 1999, S. 295–305 (doi:10.1016/S0021-9673(99)00351-9).
- ↑ Deborah D. Roberts, Terry E. Acree: Effects of Heating and Cream Addition on Fresh Raspberry Aroma Using a Retronasal Aroma Simulator and Gas Chromatography Olfactometry. In: Journal of Agricultural and Food Chemistry. 44 (12), 1996, S. 3919–3925 (doi:10.1021/jf950701t).
- ↑ Peter K. C. Ong, Terry E. Acree: Gas Chromatography/Olfactory Analysis of Lychee (Litchi chinesis Sonn.). In: Journal of Agricultural and Food Chemistry. 46 (6), 1998, S. 2282–2286 (doi:10.1021/jf9801318).
- ↑ Carole Viriot, Augustin Scalbert, Catherine Lapierre, Michel Moutounet: Ellagitannins and Lignins in Aging of Spirits in Oak Barrels. In: Journal of Agricultural and Food Chemistry. 41 (11), 1993, S. 1872–1879 (doi:10.1021/jf00035a013).
- ↑ Imre Blank, Alina Sen, Werner Grosch: Potent Odorants of the Roasted Powder and Brew of Arabica Coffee. In: Zeitschrift für Lebensmittel-Untersuchung und -Forschung. 195 (3), 1992, S. 239–245 (doi:10.1007/BF01202802).
- ↑ P. Semmelroch, G. Laskawy, I. Blank, W. Grosch: Determination of Potent Odourants in Roasted Coffee by Stable Isotope Dilution Assays. In: Flavour and Fragrance Journal. 10 (1), 1994, S. 1–7 (doi:10.1002/ffj.2730100102).
- ↑ S. Kermasha, M. Goetghebeur, J. Dumont: Determination of Phenolic Compound Profiles in Maple Products by High-Performance Liquid Chromatography. In: Journal of Agricultural and Food Chemistry. 43 (3), 1995, S. 708–716 (doi:10.1021/jf00051a028).
- ↑ Ron G. Buttery, Louisa C. Ling: Volatile Flavor Components of Corn Tortillas and Related Products. In: Journal of Agricultural and Food Chemistry. 43 (7), 1995, S. 1878–1882 (doi:10.1021/jf00055a023).
- ↑ Helmut Guth, Werner Grosch: Odorants of Extrusion Products of Oat Meal. Changes During Storage. In: Zeitschrift für Lebensmittel-Untersuchung und -Forschung. 196 (1), 1995, S. 22–28 (doi:10.1007/BF01192979).
- ↑ Martin B. Hocking: Vanillin: Synthetic Flavoring from Spent Sulfite Liquor. In: Journal of Chemical Education, 74 (9), 1997, S. 1055–1059 (doi:10.1021/ed074p1055).
- ↑ a b Gary M. Lampman, Jennifer Andrews, Wayne Bratz, Otto Hanssen, Kenneth Kelley, Dana Perry, Anthony Ridgeway: The Preparation of Vanillin from Eugenol and Sawdust. In: Journal of Chemical Education, 54 (12), 1977, S. 776–778 (doi:10.1021/ed054p776).
- ↑ a b c Beyer / Walter: Lehrbuch der Organischen Chemie. 19. Auflage. S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 504.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3-Brom-4-hydroxybenzaldehyd: CAS-Nr.: 2973-78-6, EG-Nr.: 608-409-1, ECHA-InfoCard: 100.107.158, PubChem: 76308, Wikidata: Q63395282.
- ↑ Douglass F. Taber, Shweta Patel, Travis M. Hambleton, Emma E. Winkel: Vanillin Synthesis from 4-Hydroxybenzaldehyde. In: Journal of Chemical Education, 84 (7), 2007, S. 1158 (doi:10.1021/ed084p1158).
- ↑ Vanillin (Seite nicht mehr abrufbar. Suche in Webarchiven) (PDF; 1,97 MB); abgerufen am 31. Juli 2016.
- ↑ a b Bernd Schaefer: Natural Products in the Chemical Industry. Springer, 2014, ISBN 978-3-642-54460-6, S. 116.
- ↑ H. Priefert, J. Rabenhorst, A. Steinbüchel: Biotechnological Production of Vanillin. In: Applied Microbiology and Biotechnology, 56, 2001, S. 296–314 (doi:10.1007/s002530100687).
- ↑ Biotechnologische Produktion von Vanillin.
- ↑ Suvendu Bhattacharya: Conventional and Advanced Food Processing Technologies. John Wiley & Sons, 2014, ISBN 978-1-118-40632-8, S. 399.
- ↑ a b Oliver Kayser, Nils Averesch: Technische Biochemie. Springer, 2015, ISBN 978-3-658-05547-9, S. 86.
- ↑ Daphna Havkin-Frenkel, Andrzej Podstolki, Ewa Witkowska, Pjotr Molecki, Monika Mikolajczyk: Vanillin biosynthetic pathways: an overview. In: Tong-Jen Fu, Gurmeet Singh, Wayne R. Curtis: Plant Cell and Tissue Culture for the Production of Food Ingredients. American Chemical Society 1999. Division of Agricultural and Food Chemistry, S. 35–43. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ Patent WO03071861: Vanillin Biosynthetic Pathway Enzyme from Vanilla planifolia. Veröffentlicht am 4. September 2003, Erfinder: Daphna Havkin-Frenkel, Andrzej Podstolski, Richard A. Dixon.
- ↑ Osamu Negishi, Kenji Sugiura, Yukiko Negishi: Biosynthesis of Vanillin via Ferulic Acid in Vanilla planifolia. In: Journal of Agricultural and Food Chemistry. 57 (21), 2009, S. 9956–9961 (doi:10.1021/jf901204m. PMID 19817415).
- ↑ Peter Schopfer: Experimentelle Pflanzenphysiologie. Band 2, Springer-Verlag, 2013, ISBN 978-3-642-61336-4, S. 55.
- ↑ R. Debowska, A. Podstolski: Properties of Diphenolase from Vanilla planifolia (Andr.) Shoot Primordia Cultured in Vitro. In: Journal of Agricultural and Food Chemistry, 49 (7), 2001, S. 3432–3437 (doi:10.1021/jf001180z. PMID 11453787).
- ↑ R. Velavan, P. Sureshkumar, K. Sivakumar, S. Natarajan: Vanillin-I. In: Acta Cryst. C51, 1995, S. 1131–1133 (doi:10.1107/S0108270194011923).
- ↑ Riechstofflexikon: Vanillin.
- ↑ Georgios I. Panoutsopoulos, Christine Beedham: Enzymatic Oxidation of Vanillin, Isovanillin and Protocatechuic Aldehyde with Freshly Prepared Guinea Pig Liver Slices. In: Cell Physiol Biochem. 15 (1–4), 2005, S. 89–98 (PMID 15665519; (PDF)
- ↑ Eintrag zu Ethylvanillin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- ↑ Toru Egawa, Akiyo Kameyama, Hiroshi Takeuchi: Structural Determination of Vanillin, Isovanillin and Ethylvanillin by Means of Gas Electron Diffraction and Theoretical Calculations. In: Journal of Molecular Structure, 794 (1–3), 2006, S. 92–102 (doi:10.1016/j.molstruc.2006.01.042; hokudai.ac.jp (PDF; 478 kB)
- ↑ A. V. Gerasimov, N. V. Gornova, N. V. Rudometova: Determination of Vanillin and Ethylvanillin in Vanilla Flavorings by Planar (Thin-Layer) Chromatography. In: Journal of Analytical Chemistry, 58 (7), 2003, S. 677–684 (doi:10.1023/A:1024764205281).
- ↑ P. H. List, L. Hörhammer: Hagers Handbuch der Pharmazeutischen Praxis. 7. Band: Arzneiformen und Hilfsstoffe. Teil B, 4. Auflage. Springer, 1977, ISBN 3-642-65823-7, S. 37.
- ↑ Y. Shen, B. Hu, X. Chen, Q. Miao, C. Wang, Z. Zhu, C. Han: Determination of four flavorings in infant formula by solid-phase extraction and gas chromatography-tandem mass spectrometry. In: J. Agric Food Chem. 62(45), 2014, S. 10881–10888. PMID 25338226.
- ↑ J. Gerloff, I. K. Sundar, R. Freter, E. R. Sekera, A. E. Friedman, R. Robinson, T. Pagano, I. Rahman: Inflammatory Response and Barrier Dysfunction by Different e-Cigarette Flavoring Chemicals Identified by Gas Chromatography-Mass Spectrometry in e-Liquids and e-Vapors on Human Lung Epithelial Cells and Fibroblasts. In: Appl. In Vitro Toxicol. 3(1), 2017, S. 28–40. PMID 28337465.
- ↑ L. Franitza, M. Granvogl, P. Schieberle: Influence of the Production Process on the Key Aroma Compounds of Rum: From Molasses to the Spirit. In: J. Agric Food Chem. 64(47), 2016, S. 9041–9053. PMID 27788585.
- ↑ D. Q. Li, Z. Q. Zhang, X. L. Yang, C. H. Zhou, J. L. Qi: Online restricted-access material combined with high-performance liquid chromatography and tandem mass spectrometry for the simultaneous determination of vanillin and its vanillic acid metabolite in human plasma. In: J. Sep. Sci. 39(17), 2016, S. 3318–3326. PMID 27384745.
- ↑ M. Bononi, G. Quaglia, F. Tateo: Easy Extraction Method To Evaluate δ13C Vanillin by Liquid:Chromatography-Isotopic Ratio Mass Spectrometry in Chocolate Bars and Chocolate Snack Foods. In: J. Agric Food Chem. 63(19), 2015, S. 4777–4781. PMID 25965784.
- ↑ N. P. Kalogiouri, N. A. Alygizakis, R. Aalizadeh, N. S. Thomaidis: Olive oil authenticity studies by target and nontarget LC-QTOF-MS combined with advanced chemometric techniques. In: Anal. Bioanal. Chem. 408(28), 2016, S. 7955–7970. PMID 27585916.
- ↑ Richtlinien für Vanille-Zucker und Vanillin-Zucker (veröffentlicht vom Bund für Lebensmittelrecht und Lebensmittelkunde e. V. 1962), in denen die Verkehrsauffassung der Lebensmittelwirtschaft niedergelegt ist; Neuauflage 2007.
