Herz-Lungen-Wiederbelebung

Die Herz-Lungen-Wiederbelebung (HLW) oder kardiopulmonale Reanimation (auch kardiopulmonale Wiederbelebung) soll einen Atem- und Kreislaufstillstand beenden und damit den unmittelbar drohenden Tod des Betroffenen abwenden. Andere Namen hierfür sind Wiederbelebung, Reanimation und englisch cardiopulmonary resuscitation (CPR). Bei einem Kreislaufstillstand ist es unerlässlich, schnell zu handeln: Bereits nach ungefähr drei Minuten wird das Gehirn nicht mehr genügend mit Sauerstoff versorgt, sodass dort irreversible Schäden auftreten können.
Mit der Herzdruckmassage kann der Restsauerstoff im Blut zirkulieren und so bis zum Eintreffen des Rettungsdienstes bzw. fachlicher Hilfe die Überlebenswahrscheinlichkeit entscheidend erhöht werden. Auch ohne Ersthelferkenntnisse ist es dem medizinischen Laien so möglich, mittels der Basismaßnahmen (basic life support) Leben zu retten oder zumindest zu verlängern. Er soll prüfen, ob die bewusstlose Person noch normal atmet, unter der europaweit gültigen Notrufnummer 112 den Rettungsdienst rufen sowie bei Erwachsenen auf einem nicht nachgebenden Untergrund fest und 100 bis 120 Mal pro Minute das Brustbein in der Mitte des Brustkorbs etwa fünf Zentimeter eindrücken und wieder komplett entlasten und nicht damit aufhören, bis Hilfe eintrifft.[1][2][3] Die Beatmung ist nicht die wichtigste Maßnahme bei Menschen mit plötzlichem Herz-Kreislauf-Stillstand. Zentral und effektiv ist die Herzdruckmassage. Nach Möglichkeit sollte sie durch eine Beatmung (z. B. Mund-zu-Mund-Beatmung) ergänzt werden. Bei Erwachsenen wird empfohlen, 30 Mal zu drücken und danach zweimal zu beatmen. Zur Findung des Rhythmus eignen sich unter anderem[4] Stayin’ Alive oder Highway to Hell.[5]
Sofern in der Nähe vorhanden, kann auch ein automatisierter externer Defibrillator (AED) eingesetzt werden. Erweiterte Maßnahmen (advanced life support) erfordern speziell ausgebildetes Personal mit entsprechenden Hilfsmitteln bzw. Geräten und werden von Mitarbeitern des Rettungsdienstes, einem Notarzt oder auch dem medizinischen Fachpersonal im Krankenhaus durchgeführt. Dabei kommen die Gabe von Medikamenten, die Intubation, professionelle Defibrillation und äußere (transkutane) Herzschrittmacher zum Einsatz. Dennoch ist die Prognose wiederbelebter Patienten schlecht, die längerfristige Überlebensrate (Zeitpunkt der Krankenhausentlassung) liegt zwischen zwei und sieben Prozent.[6]
Diesem Artikel liegen die Reanimationsrichtlinien des European Resuscitation Council (ERC) von 2015 zugrunde (Aktuelle Version: März 2021[7]). Die praktische Umsetzung weicht in verschiedenen Ländern, medizinischen Institutionen und Hilfsorganisationen davon ab.
Ursachen und Formen des Kreislaufstillstandes
[Bearbeiten | Quelltext bearbeiten]Die häufigste Ursache eines Kreislaufstillstandes ist in westlichen Industrienationen mit über 80 % der plötzliche Herztod, bedingt durch Herzinfarkt oder Herzrhythmusstörungen. In Deutschland sterben 80.000 bis 100.000 Menschen pro Jahr durch den plötzlichen Herztod, dies entspricht 250 Fällen pro Tag. Weitere innere Erkrankungen wie Lungenerkrankungen (beispielsweise Lungenembolie), Erkrankungen des Gehirns (beispielsweise Schlaganfall) und andere haben einen Anteil von etwa 9 %. In weiteren 9 % sind äußere Einwirkungen wie Unfall, Ersticken, Vergiftung, Ertrinken, Suizid oder Stromunfall die Ursache des Kreislaufstillstandes.[6]


Besonders für die Maßnahmen der erweiterten Therapie ist die Unterscheidung von hyperdynamen (defibrillierbaren, elektrisch aktiven, hypersystolischen) und hypodynamen (nicht-defibrillierbaren, elektrisch inaktiven, asystolischen) Kreislaufstillständen wichtig. Bei der hyperdynamen Form, die in ca. 25 % der Fälle beim Auffinden des Patienten vorliegt, zeigen Muskel und Erregungsleitungssystem des Herzens eine Aktivität, die jedoch ungeordnet ist. Es findet keine koordinierte Herzarbeit und damit kein wesentlicher Auswurf von Blut in den Kreislauf mehr statt. Pulslose ventrikuläre Tachykardie (ventricular tachycardia, VT), Kammerflattern und Kammerflimmern (ventricular fibrillation, VF) sind mögliche Ursachen dieser Art des Kreislaufstillstandes. Sie geht nach einigen Minuten unweigerlich in die hypodyname Form über, bei der keine elektrische Aktivität mehr nachweisbar ist und die als Asystolie bezeichnet wird. Eine Sonderform ist die elektromechanische Entkoppelung (EMD) beziehungsweise pulslose elektrische Aktivität (PEA), bei der zwar eine geordnete elektrische Aktivität beobachtet wird, diese jedoch keine Auswurfleistung in Form einer Pulswelle mehr bewirkt.[8][9]
Die Datenlage über die Häufigkeit von Wiederbelebungsmaßnahmen bei Kreislaufstillstand ist unvollständig. Die jährliche Inzidenz der Reanimation bei außerklinischem Kreislaufstillstand mit kardialer Ursache lag in einer schottischen Studie zwischen 50 und 66 pro 100.000 Einwohnern. Die Rate der innerklinischen Fälle variiert von 150 (Norwegen) bis 350 (England) pro 100.000 aufgenommenen Patienten.[10]
Basismaßnahmen der Reanimation
[Bearbeiten | Quelltext bearbeiten]
Die ohne zusätzliche Hilfsmittel anwendbaren Basismaßnahmen, in der internationalen Fachsprache auch als basic life support (BLS) bezeichnet, dienen der Aufrechterhaltung eines minimalen Kreislaufes im Körper des Patienten mittels Herzdruckmassage und Versorgung mit ausreichend oxygeniertem Blut durch Mund-zu-Mund-Beatmung oder Mund-zu-Nase-Beatmung (siehe Atemspende) bis zur Wiederherstellung einer normalen Blutzirkulation[11] bzw. zur Überbrückung der Zeit bis zur Anwendung erweiterter Therapiemaßnahmen, ohne dass lebenswichtige Organe des Patienten irreversibel geschädigt werden. Dies betrifft vor allem das Gehirn, welches durch Sauerstoffmangel schon nach wenigen Minuten Schäden nimmt. Der durch die Basismaßnahmen erzielbare Blutfluss entspricht bestenfalls etwa einem Drittel des gesunden Kreislaufes. Die Basismaßnahmen können von einem oder auch zwei Helfern durchgeführt werden. Das Verhältnis von Herzdruckmassage zu Beatmung ist davon unabhängig.[8]
Als Merkregel wurde ein ABC-Schema (ABC-Basismaßnahmen, ABC der Ersten Hilfe) der lebensrettenden Sofortmaßnahmen entwickelt:
- A (Atemwege freimachen und freihalten)
- B (Beatmen bzw. Beatmung)
- C (Zirkulation, englisch Circulation, in Gang bringen, insbesondere durch Herzdruckmassage).[12]
Erweitert als ABCDE-Schema:
- D (neurologisches Defizit)
- E (Exploration, weitere Untersuchungen/Maßnahmen)
Die Basismaßnahmen (auch im Rahmen der Ersten Hilfe) lassen sich heute in drei einfache Schritte unterteilen:
- Prüfen: Prüfen, ob die womöglich bewusstlose Person reagiert (zunächst Ansprechen, Schütteln an der Schulter), Überprüfen der Atmung: Keine oder keine normale Atmung (z. B. Schnappatmung, Röcheln)?
- Rufen: Um Hilfe rufen – umstehende Personen einbinden und einen Notruf durchführen oder veranlassen
- Drücken: Fest und schnell (100 bis 120 Mal pro Minute) in die Mitte des Brustkorbes drücken (z. B. im Takt von Stayin’ Alive der Bee Gees)
Wenn möglich sollte eine Mund-zu-Mund-Beatmung oder Mund-zu-Nase-Beatmung durchgeführt werden: 30 Mal drücken und danach zweimal beatmen. Mit der Herzdruckmassage kann der Restsauerstoff im Blut zirkulieren und das Gehirn mit Sauerstoff versorgen. Bis zur Übernahme durch Mitarbeiter des Rettungsdienstes kann die Überlebenswahrscheinlichkeit so entscheidend erhöht werden, denn bereits nach drei Minuten wird das Gehirn nicht mehr genügend mit Sauerstoff versorgt – es treten unwiderrufliche Schäden auf.
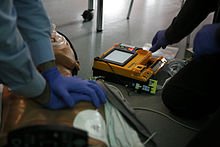
Zunehmend stehen auch an zentraler Stelle in öffentlichen Gebäuden speziell für den Einsatz durch Ersthelfer konzipierte, halbautomatische Defibrillatoren (Automatisierter Externer Defibrillator, AED) zur Verfügung. Diese führen den ungeschulten Anwender mit Sprachanweisungen durch die Defibrillation und geben teilweise auch Anweisungen zur Durchführung von Herzdruckmassage und Beatmung. Die automatisierte Defibrillation, ursprünglich eine erweiterte Maßnahme professioneller Helfer, wird somit inzwischen zu den Basismaßnahmen der Reanimation gezählt.[8] Der Einsatz von AEDs darf dabei allerdings nicht die Durchführung der Herzdruckmassage verzögern oder gar ersetzen.
Zu den Basismaßnahmen zählt für den Ersthelfer auch, mittels eines Notrufes unverzüglich den Rettungsdienst anzufordern. Dieser führt die Basismaßnahmen auf dieselbe Art durch, allerdings stehen technische Hilfsmittel wie beispielsweise ein Defibrillator zur Verfügung. Hinzu kommen erweiterte Maßnahmen zur Sicherung der Atemwege und somit der Sicherstellung der Beatmung zum Einsatz. Sauerstoff kann dem Patienten in hoher Konzentration zum Beispiel mittels eines Beatmungsbeutels oder eines Beatmungsgerätes über einen Endotracheal- oder einen Larynxtubus zur Verfügung gestellt werden. Dasselbe gilt für Reanimationen in medizinischen Einrichtungen, die oft von „Reanimationsteams“ durchgeführt werden.
Jeder, der eine reglose Person auffindet, ist verpflichtet, nach bestem Wissen unverzüglich mit lebensrettenden Sofortmaßnahmen zu beginnen, da er sich ansonsten in Deutschland der unterlassenen Hilfeleistung schuldig machen kann. Ausnahmen sind Körper, welche bereits eindeutige Todeszeichen aufweisen wie starke Anzeichen einer Verwesung oder Verletzungen, die mit dem Leben unvereinbar sind. Einmal begonnen, ist die Herz-Lungen-Wiederbelebung ohne Unterbrechung bis zur Übernahme (nicht nur bis zum „Eintreffen“!) von Hilfe fortzuführen, über einen Abbruch der Maßnahmen entscheidet anhand bestimmter Kriterien (beispielsweise Lebensalter, Dauer des Kreislaufstillandes, Prognose der zugrundeliegenden Störung) ein Arzt. Davon ausgenommen ist ein Nicht-Aufnehmen oder eine Unterbrechung der Maßnahmen bei Eigengefährdung, z. B. aus gesundheitlicher Belastung.
Erkennen eines Kreislaufstillstandes, Freimachen der Atemwege
[Bearbeiten | Quelltext bearbeiten]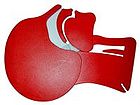
|

|
| verschlossene Atemwege | freie Atemwege |
| Atemwege am Kopfschnittmodell eines Erwachsenen, links vor, rechts nach Überstrecken des Halses | |
Um einen Kreislaufstillstand zu erkennen, werden die Vitalfunktionen Bewusstsein und Atmung des Patienten überprüft (auch als diagnostischer Block bezeichnet). Eine Überprüfung der Kreislauftätigkeit entfällt für Laienhelfer, da bei Atemstillstand meist auch kein Kreislauf vorhanden ist und die Überprüfung für einen Ungeübten nicht sicher durchführbar ist. Unter Beachtung der eigenen Sicherheit prüft der Helfer die Reaktion des Patienten durch Ansprechen und Schütteln an der Schulter. Zum Teil ist ein Zwicken in den Arm oder Ähnliches besser geeignet als das Rütteln an der Schulter, damit keine eventuelle Schädigung der Wirbelsäule etc. verschlimmert wird.
In neutraler Kopfposition fällt beim liegenden Patienten die Zunge in den Rachenraum zurück und verlegt die Atemwege. Um eine Überprüfung der Atmung oder eine Beatmung zu ermöglichen, muss daher der Kopf bzw. der Nacken überstreckt werden (Lebensrettender Handgriff). Dies sollte, um die eventuell verletzte (Hals-)Wirbelsäule zu schonen, durch Bewegung am Kinn und an der Stirn, jedoch nicht durch einen Griff in den Nacken erfolgen. Zusätzlich kann zum Lebensrettenden Handgriff auch der Esmarch-Handgriff angewendet werden, bei dem der nach hinten gefallene Unterkiefer nach vorne gezogen wird. Damit setzt eventuell wieder eine Eigenatmung des Betroffenen ein.
Im Anschluss wird die Atemtätigkeit für maximal 10 Sekunden geprüft, indem auf das Atemgeräusch gehört wird, die Ausatemluft an der eigenen Wange gefühlt wird und die Atembewegungen des Brustkorbes beobachtet werden. Findet sich beim Patienten keine „normale“ Atmung, beginnt der Ersthelfer mit den Basismaßnahmen der Reanimation. In der Laienreanimation kommt es vor, dass irrtümlicherweise die Schnappatmung als nicht bedrohlicher Zustand wahrgenommen wird. Schnappatmung ist durch langsame, unregelmäßige, oft geräuschvolle Atemzüge erkennbar, der Kopf, Mund und Kehlkopf bewegen sich dabei oft auf unnatürlich anmutende Weise.
Eine Person mit Schnappatmung muss reanimiert werden.
Ein normal atmender Patient wird in die stabile Seitenlage gebracht, die Atmung wird dabei weiter überwacht, um ggf. auftretende Atemstillstände oder einen Übergang in Schnappatmung frühzeitig zu erkennen und mit der Reanimation beginnen zu können. Besteht der Verdacht, dass Fremdkörper (Speisereste, Zahnprothesen, Kaugummi usw.)[13] die Atemwege verlegen, wird bei Bewusstlosen mit der Reanimation begonnen, ohne es durch länger dauernde Versuche der Fremdkörperentfernung zu einer Verzögerung kommen zu lassen. Durch einige Thoraxkompressionen im Rahmen der Reanimation kann es dann zu einer Entfernung des Fremdkörpers aus dem Atemweg kommen.[14] Herausnehmbarer Zahnersatz wird, wenn möglich, vorher entfernt.
Ist ein Patient mit Fremdkörpern in den Atemwegen noch bei Bewusstsein, wird versucht, diese zunächst durch hustenauslösende, kräftige Schläge zwischen die Schulterblätter, anschließend durch wiederholten Druck auf den Oberbauch (Heimlich-Handgriff) zu entfernen.[8] Vom Heimlich-Handgriff wurde aufgrund der Verletzungsgefahr von Leber und Milz verschiedentlich abgeraten,[15] er ist bei akuter Erstickungsgefahr jedoch das Mittel der Wahl.[16]
Medizinisches Personal führt die Überprüfung der Vitalfunktionen mit ausführlicheren Maßnahmen durch. Vor der Überprüfung der Atmung wird zusätzlich der Mundraum auf das Vorhandensein von Fremdkörpern oder Erbrochenem inspiziert. Diese werden gegebenenfalls entfernt. Dies kann mit Hilfe der Finger, einer Absaugpumpe oder einer Magill-Zange geschehen. Während der Überprüfung der Atmung kann zusätzlich eine Kreislaufkontrolle erfolgen, sofern die Beurteilungszeit 10 Sekunden nicht übersteigt. Dabei wird neben der Beachtung allgemeiner Lebenszeichen (Bewegung, Atmung oder Husten) von ausgebildetem Personal auch der Carotis- oder Femoralispuls getastet. Dies kann jedoch auch für Erfahrene schwierig sein. Beim Eintreffen eines EKG/Defibrillator-Gerätes wird der Herzrhythmus elektrokardiografisch analysiert. Die einzuleitenden Maßnahmen unterscheiden sich nicht wesentlich von der Durchführung durch Laien.[8]
Herzdruckmassage
[Bearbeiten | Quelltext bearbeiten]
Die Effektivität der offenen bzw. direkten Herzmassage, erstmals von Moritz Schiff tierexperimentell gezeigt, wurde im Jahr 1900 von Jan Prus mit ausgedehnten Versuchsreihen an mit Chloroform zum Kreislaufstillstand mit Asystolie gebrachten Hunden bestätigt. Bei Kammerflimmern konnten um diese Zeit keine Erfolge gemeldet werden. Die erste erfolgreiche direkte Herzmassage am Menschen, zur Wiederbelebung einer 43-jährigen Frau, erfolgte 1901 durch den Norweger Igelsrud. Die Patientin hatte am Ende einer Operation in Chloroformnarkose einen Herzstillstand erlitten.[17]
Um die Jahrhundertwende kam dann auch die Idee der äußeren (externen) Herzmassage auf. Bereits im Jahr 1878 hatte R. Boehm an Katzen mit durch Chloroform erzeugtem Herzstillstand Versuche zur äußeren bzw. indirekten Herzmassage durchgeführt. Bei der (externen oder extrathorakalen) Herzdruckmassage (wiederholte Thoraxkompression), genannt auch Herzmassage (nicht zu verwechseln mit der von Max Joseph Oertel beschriebenen Herzmassage[18]), wird das Herz durch Druck auf das Brustbein in Richtung Wirbelsäule gepresst. Dabei erhöht sich der Druck im Brustkorb und Blut wird aus dem Herzen in den Kreislauf ausgeworfen. In der darauf folgenden Entlastungsphase füllt sich das Herz erneut mit Blut. Als Ursache für die Wirkung der Herzdruckmassage wurden sowohl die Kompression des Herzens durch den von außen ausgeübten Druck als auch dadurch verursachte Druckschwankungen im Brustkorbinneren („Thoraxpumpenmechanismus“) angesehen.[19] Wichtig ist die Minimierung von Unterbrechungen („No-Flow-Time“) während der Herzdruckmassage.
Als vorbereitende Maßnahme wird der Patient flach in Rückenlage auf einer harten Fläche wie dem Boden oder einem Reanimationsbrett gelagert und sein Brustkorb freigemacht. Der Druckpunkt befindet sich in der Mitte des Brustkorbes auf dem Brustbein.
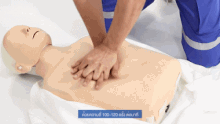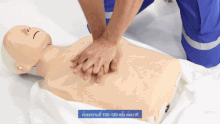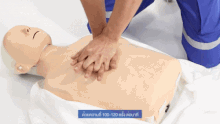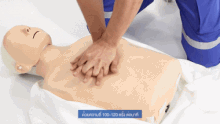
Für Erwachsene gilt: Das Brustbein wird 30 Mal in Folge kurz und kräftig heruntergedrückt und anschließend wird 2 Mal beatmet. Die Eindrucktiefe beträgt etwa fünf bis sechs Zentimeter. Zwischen zwei Pumpstößen soll der Brustkorb wieder entlastet werden, damit sich das Herz ausreichend mit Blut füllen kann. Die angestrebte Frequenz der Herzdruckmassage liegt bei mindestens 100 und maximal 120 Kompressionen pro Minute. Die richtige Körperhaltung bei der (äußeren) manuellen Herzdruckmassage erleichtert dem Helfer die Arbeit. Er kniet aufrecht neben dem Patienten, seine Schultern befinden sich senkrecht über dem Brustbein des Patienten. Der Helfer drückt rhythmisch mit dem Gewicht seines Oberkörpers, während seine Arme gestreckt und die Ellenbogen durchgedrückt sind. Seit den 1990er Jahren werden zur Herzdruckmassage auch zunehmend Geräte mit frequenz- und stärkegesteuerten Kolben als mechanische Reanimationshilfen eingesetzt.[8] Bei Säuglingen und Kleinkindern beträgt die Kompressionstiefe etwa ein Drittel der Brustkorbtiefe und zur Kompression werden nur die Fingerspitzen benutzt (Näheres siehe #Besonderheiten bei Neugeborenen, Säuglingen und Kindern). Steht mehr als ein Helfer zur Verfügung, können Herzdruckmassage und Beatmung auf zwei Personen aufgeteilt werden.[20]
Bei der Herzdruckmassage kommt es häufig, auch bei korrekter Durchführung, zu Rippenbrüchen. Diese sind hier als Nebeneffekt hinzunehmen. Daher sollte auch nach einem oder mehreren Rippenbrüchen die Herzdruckmassage nach Überprüfung der angewendeten Technik weitergeführt werden.[21]
Beatmung
[Bearbeiten | Quelltext bearbeiten]
Die Beatmung ohne weitere Hilfsmittel erfolgt als Mund-zu-Nase- oder Mund-zu-Mund-Beatmung (siehe Atemspende). Der Hals des Betroffenen wird dabei überstreckt. Die Nase muss bei der Mund-zu-Mund-Beatmung, der Mund bei der Mund-zu-Nase-Beatmung, verschlossen werden. Das Volumen ist richtig gewählt, wenn sich der Brustkorb sichtbar hebt. Die Beatmungsphase sollte etwa eine Sekunde betragen; die Beatmung wird (solange nicht beides parallel bzw. ununterbrochen erfolgen kann wie nach erfolgter Intubation der Luftröhre, im Wechsel mit der Herzdruckmassage und einem Verhältnis der Beatmung zur Thoraxkompression von 2:30) so lange wiederholt, bis die beatmete Person wieder von selbst atmet. Um die Hygiene zu verbessern und eventuell vorhandenen Ekel zu überwinden, gibt es verschiedene Beatmungshilfen wie Beatmungsfolien mit einem Filter und verschiedene Arten von Taschenmasken, deren Einsatz allerdings Übung erfordert. Wenn der Verdacht einer Vergiftung mit Kontaktgiften (beispielsweise Pflanzenschutzmitteln wie Parathion) besteht, sollte auf die Atemspende verzichtet werden. Wenn ein Helfer sich eine Beatmung nicht zutraut, ist eine ununterbrochene Herzdruckmassage für diesen eine akzeptable Alternative.[22]
Entsprechend ausgestattete und ausgebildete Helfer verwenden zur Beatmung einen Beatmungsbeutel mit Gesichtsmaske, oft in Verbindung mit einem Guedel-Tubus, Larynxtubus oder nach einer (endotrachealen) Intubation. Die Atemluft lässt sich dabei zusätzlich mit Sauerstoff anreichern, wobei durch entsprechende Sauerstoffflusseinstellung (maximaler Flow) und Verwendung eines Sauerstoffreservoirs Konzentrationen von fast 100 % erreicht werden können.[8]
Erweiterte Maßnahmen der Reanimation
[Bearbeiten | Quelltext bearbeiten]
Spätestens zehn Minuten nach erfolgter Durchführung der Basismaßnahmen sollten erweiterte Maßnahmen zur Verfügung stehen. Ziel der erweiterten Maßnahmen, auch als advanced life support (ALS, Begriff des European Resuscitation Council) oder advanced cardiac life support (ACLS, Bezeichnung der American Heart Association) bezeichnet, ist die Wiederherstellung eines physiologischen Herzrhythmus des Patienten. Dazu gehören die Atemwegssicherung mittels Intubation, Anlage eines venösen Zuganges zur Verabreichung von Flüssigkeiten und Medikamenten, die medikamentöse Basistherapie sowie die Therapie reversibler Ursachen des Kreislaufstillstandes. Zur Diagnostik im Rahmen der erweiterten Maßnahmen gehört ein EKG-Monitoring[11] und das Prüfen der Kreislauffunktion, insbesondere durch Pulskontrollen. Bei der Therapie wird zudem, wie bereits beschrieben, zwischen defibrillierbaren und nicht-defibrillierbaren Formen des Kreislaufstillstandes unterschieden. Bei einem defibrillierbaren Rhythmus, meist Kammerflimmern, hat die schnelle Anwendung von elektrischem Strom mittels eines Defibrillators oberste Priorität; gegebenenfalls (bei einem langsamen Grundrhythmus) ist auch eine (transthorakale bzw. externe) Schrittmachertherapie mit entsprechenden Klebeelektroden sinnvoll. Auch die Gabe von antiarrhythmischen Medikamenten kommt in Frage.
Der Ablauf der Maßnahmen wird in den Richtlinien des ERC als Algorithmus beschrieben, wodurch eine standardisierte und einheitliche Durchführung ermöglicht wird.[23]
Defibrillation und Schrittmachertherapie
[Bearbeiten | Quelltext bearbeiten]Die Defibrillation ist bei Kammerflimmern, Kammerflattern und pulsloser ventrikulärer Tachykardie das Mittel der Wahl, bei Asystolie jedoch nicht angezeigt. Bei Defibrillatoren mit monophasischem Impuls wird ein Schock von 360 Joule appliziert, bei solchen mit biphasischem Schockverlauf 150–200 Joule beim ersten, 200–360 bei allen weiteren Schocks. Durch diesen Stromstoß kann die ungeordnete elektrische Aktivität des Herzmuskels durchbrochen und ein Neustart mit regulärem Rhythmus ermöglicht werden. Direkt nach jeder Defibrillation wird zunächst mit Herzdruckmassage und Beatmung im Verhältnis 30:2 für zwei Minuten fortgefahren. Erst dann wird eine erneute Rhythmus- und Pulskontrolle durchgeführt, denn sollte die Defibrillation den Herzrhythmus erfolgreich wiederhergestellt haben, ist die anfängliche Auswurfsleistung zu gering, um eine ausreichende Perfusion sicherzustellen. Bei pulsloser elektrischer Aktivität oder bei Asystolie mit P-Wellen im EKG kann der Einsatz eines transkutanen Schrittmachers erwogen werden.[23][9]
Eine Entwicklung der letzten Jahre ist die zunehmende Verbreitung von automatisierten Defibrillatoren an öffentlichen Plätzen. Diese automatisierten externen Defibrillatoren (AED) verfügen über eine automatisierte Rhythmuserkennung und ermöglichen mittels akustischer Anleitung auch dem Ersthelfer, eine Defibrillation durchzuführen. Das Gerät diagnostiziert selbstständig das vorliegende Problem und gibt dem Anwender genaue Anweisungen. Ist eine Defibrillation notwendig, braucht der Helfer nur der Ansage folgend den Auslöseknopf zu drücken.[8]
Atemwegssicherung
[Bearbeiten | Quelltext bearbeiten]Die endotracheale Intubation gilt als Goldstandard bei der Atemwegssicherung im Rahmen der Reanimation. Dabei wird ein Tubus durch Mund oder Nase zwischen den Stimmlippen des Kehlkopfes (Larynx) hindurch in die Luftröhre (Trachea) geschoben. Vorteile der Intubation sind Schutz vor Aspiration von Mageninhalt und die Möglichkeit der kontrollierten manuellen oder maschinellen Beatmung. Da die endotracheale Intubation einen erhöhten Schwierigkeitsgrad aufweist, sollen laut Richtlinien nur geübte und erfahrene Helfer diese Methode anwenden. Als Alternative wird der Einsatz von Larynxtubus, Combitubus oder Larynxmaske empfohlen.[23]
Für die Intubation sollte die Herz-Lungen-Wiederbelebung nicht oder nur kurz unterbrochen werden. Ein Intubationsversuch soll nicht länger als 5 Sekunden dauern. Die korrekte Lage des Tubus muss durch die Bewertung der Messung von Kohlenstoffdioxid (CO2) mittels Kapnometrie in der ausgeatmeten Luft überprüft werden. Die Kapnometrie gibt auch Hinweise auf eine effizient durchgeführte Herzdruckmassage.[24] Nach erfolgreicher Intubation wird die Herzdruckmassage kontinuierlich, die Beatmung (gegebenenfalls unter Erhalt eines positiven Atemwegdrucks am Ende der Ausatmungsphase, dem PEEP[25][26]) mit einer Frequenz von 10/min fortgeführt.[27]
Medikamente
[Bearbeiten | Quelltext bearbeiten]Die Medikamentengabe erfolgt – abgesehen vom Sauerstoff – bevorzugt intravenös, da dieser Zugang schnell zu erreichen und sicher ist. Eine Alternative ist die Gabe über einen intraossären Zugang durch Punktion des Knochenmarks, die oft bei kleinen Kindern angewandt wird. Eine Gabe von Medikamenten durch den Tubus (endobronchiale Applikation) wird im Allgemeinen nicht empfohlen, da eine sichere Resorption nicht gewährleistet ist und der Plasmaspiegel des Medikaments nicht vorhersagbar ist. Eine intrakardiale Gabe direkt in das Herz wird nicht mehr durchgeführt.
Adrenalin ist das Standardmedikament der Reanimation. Es wird aufgrund seiner α-adrenergen vasokonstriktorischen Eigenschaften gegeben, die zu einer Verengung der peripheren Blutgefäße führen, was durch eine Erhöhung des peripheren Widerstandes die Durchblutung von Herz und Gehirn verbessert (bei Erwachsenen 1 mg, bei Kindern 10 µg/kg, alle drei bis fünf Minuten). Die Hoffnungen, die in das ebenfalls gefäßverengende Vasopressin als Alternative zu Adrenalin gesetzt wurden, haben sich nicht erfüllt. Mehrere große randomisierte Studien konnten keinen Überlebensvorteil bei der Gabe von Vasopressin nachweisen, die Gabe wird in den europäischen Richtlinien nicht mehr empfohlen.[28]
Bei anhaltendem Kammerflimmern oder Kammertachykardie und dreimaliger Defibrillation wird oft noch das Antiarrhythmikum Amiodaron (300 mg bei Erwachsenen) gegeben. Es hat das zuvor übliche Lidocain in den Empfehlungen abgelöst.[29] Eine am 5. Mai 2016 im New England Journal of Medicine veröffentlichte Studie kam zu dem Ergebnis, dass auch Amiodaron beim Kammerflimmern wirkungslos ist.[30]
Die 2010 aktualisierten Reanimationsrichtlinien empfehlen bei einer Asystolie oder einer pulslosen elektrischen Aktivität keine Gabe von Atropin mehr, da ein Vorteil durch die Blockierung des parasympathischen Nervensystems (Parasympathikolyse) nicht nachgewiesen werden konnte.
Die früher praktizierte „Pufferung“ einer durch Minderdurchblutung und verminderte Kohlendioxid-Elimination verursachten Azidose (Übersäuerung, die eine verringerte Wirksamkeit der bei der Reanimation eingesetzten Katecholamine bewirken kann) des Kreislaufs im Rahmen eines Kreislaufstillstandes mit Natriumbicarbonat ist nicht mehr gerechtfertigt. Die Infusion von Natriumbicarbonat produziert CO2, das in die Zellen diffundiert und somit die intrazelluläre Azidose verschlimmert – also den gegenteiligen Effekt erzielt. Daher wird Natriumbicarbonat bei der außerklinischen Reanimation nur noch im Rahmen von schwersten Hyperkaliämien und Intoxikationen mit trizyklischen Antidepressiva in geringer Dosierung empfohlen.[23]
Bei speziellen Rhythmusstörungen kann weiterhin die Gabe von Magnesiumsulfat in Betracht kommen. Für den Einsatz eines Thrombolytikums bei Verdacht auf einen Herzinfarkt liegen nur ungenügende Daten vor; er sollte jedoch bei Verdacht auf Lungenembolie erwogen werden.[23]
Kausale Behandlung
[Bearbeiten | Quelltext bearbeiten]Neben den Reanimationsmaßnahmen, die eine symptomatische Therapie darstellen, muss auch versucht werden, die reversiblen Ursachen des Kreislaufstillstandes zu diagnostizieren und ursächlich zu behandeln (kausale Therapie). Zu den reversiblen Ursachen zählen eine ungenügende Sauerstoffversorgung des Patienten (Hypoxie), ein Mangel an Blutvolumen (Hypovolämie bzw. hypovolämischer Schock), Unterkühlung (Hypothermie) und metabolische Störungen, insbesondere zu viel oder zu wenig Kalium (Hyperkaliämie oder Hypokaliämie) in Blut. Als weitere kurzfristig im Rahmen einer Reanimation therapierbare Ursachen gelten eine Herzbeuteltamponade, Vergiftung (Intoxikation), Thromboembolien (Herzkranz- oder Lungengefäße) sowie ein Spannungspneumothorax.[31]
Zu den möglichen, daraus abgeleiteten Maßnahmen zählen der Einsatz von Thrombolytika bei einem Herzinfarkt oder einer Lungenembolie, die Behandlung eines akuten Blutverlustes durch Infusionstherapie, weiterhin die Korrektur von Elektrolytstörungen, das Aufwärmen von unterkühlten Patienten, die Verabreichung von Antidoten bei Vergiftungen, die Entlastung eines Spannungspneumothorax sowie die Therapie weiterer spezieller Krankheitsbilder wie akuter obstruktiver Atemwegserkrankungen (Asthma-Anfall) oder Anaphylaxien. Die Maßnahmen werden in der Postreanimationsphase (s. u.) fortgesetzt.[23][31]
Besonderheiten bei Neugeborenen, Säuglingen und Kindern
[Bearbeiten | Quelltext bearbeiten]
Kinder sind keine kleinen Erwachsenen; daher gilt es bei der Reanimation einige Besonderheiten zu beachten. Es wird zwischen Neugeborenen (Kinder bis zum 28. Lebenstag), Säuglingen (bis etwa 12 Monate) und älteren Kindern (ab etwa 12 Monate bis zum Erreichen der Pubertät, wobei Kinder ab dem neunten Lebensjahr[32] wie Erwachsene behandelt werden) unterschieden.
Während bei Erwachsenen Kreislaufstillstände meist kardial bedingt sind, ist bei Säuglingen und Kindern häufig eine Störung der Atmung ursächlich für eine (bereits bei einer Herzfrequenz von unter 60 pro Minute) bedrohliche Verlangsamung des Herzschlags sowie den Kreislaufstillstand („sekundärer Herzstillstand“).[33] Aus diesem Grund werden bei Kindern vor Beginn der Herzdruckmassage zunächst fünf initiale Atemhübe hintereinander gegeben. Der neonatale Herz-Kreislauf-Stillstand ist in der Regel durch eine Asphyxie bedingt. Als eine weitere Besonderheit wird zur Beatmung speziell bei Säuglingen der Kopf nicht überstreckt, sondern nahezu in der Neutralposition belassen („Schnüffelstellung“). Die Beatmung erfolgt wegen der Körpergröße der Patienten bei Neugeborenen (mit eventuell noch nicht vollständig entfalteter Lunge) und Säuglingen über Mund und Nase gleichzeitig (Mund zu Mund und Nase).
Zur Durchführung der Herzdruckmassage wird bei Kindern nur ein Handballen benutzt. Für Säuglinge verwendet man zwei Finger oder umfasst den Brustkorb mit beiden Händen und drückt ihn (bei Zusammenarbeit von zwei Helfern) mit den Daumen ein. Die Drucktiefe sollte etwa 1/3 des Brustkorbdurchmessers betragen. Die Abfolge nach den fünf initialen Atemhüben beträgt für den Ersthelfer – wie beim Erwachsenen – 30 Herzdruckmassagen zu zwei Beatmungen; für medizinisches Personal gilt ein Druckverhältnis von 15:2, wenn mehrere Helfer anwesend sind. Bei Neugeborenen, die zudem vor Wärmeverlusten geschützt werden müssen, wird ein Verhältnis von 3:1 eingesetzt.[34][35]
Prinzipiell erfolgt die Durchführung der Herz-Lungen-Wiederbelebung wie beim Erwachsenen und wird lediglich dem Körperbau von Kindern und Säuglingen angepasst. Im Zweifelsfall ist nach dem Schema für Erwachsene zu verfahren, da, wie die Richtlinien ausdrücklich betonen, das zeitige Beginnen von Maßnahmen wichtiger ist als eine an das Alter angepasste Durchführung.[34]
Beim Einsatz eines automatischen externen Defibrillators (AED) werden nach Möglichkeit Kinderelektroden verwendet werden. Bei Kindern unter einem Jahr sollte kein AED verwendet werden. Erweiterte Maßnahmen verlaufen entsprechend der Durchführung beim Erwachsenen in angepasster Form. Da es bei Kindern oft schwierig ist, einen venösen Zugang zu finden, wird alternativ eine intraossäre Punktion durchgeführt.[34]
Postreanimationsphase
[Bearbeiten | Quelltext bearbeiten]Die Versorgungsphase nach einer erfolgreichen Reanimation (Postreanimationsphase, englisch post-resuscitation care) beginnt mit dem Wiedereinsetzen eines spontanen Kreislaufes (englisch return of spontaneous circulation, ROSC). Sie beinhaltet eine weitere präklinische Stabilisierung, den Transport in ein geeignetes Zentrum sowie eine erweiterte intensivmedizinische Behandlung und Überwachung. Die Maßnahmen in dieser Phase beeinflussen die Prognose signifikant.[23][36]
Im Vordergrund stehen in dieser Phase kausale Therapiemaßnahmen wie z. B. eine Reperfusionstherapie nach Herzinfarkt oder die operative Versorgung von Verletzungen. Daneben erfolgt die symptomatische Behandlung von Atmungs- und Herz-Kreislauffunktion, um eine ausreichende Versorgung mit Sauerstoff, insbesondere des Gehirns, sicherzustellen. Dazu ist unter Umständen eine Beatmungstherapie unter Sedierung, eine Schrittmachertherapie sowie der vielfältige Einsatz von Medikamenten notwendig, u. a. um mit Katecholaminen einen ausreichenden organversorgenden Blutdruck sicherzustellen oder Krämpfe und Myoklonien zu behandeln. Daneben werden weitere wichtige Körperparameter überwacht und Störungen gegebenenfalls behandelt. Hervorgehoben werden kann hier unter anderem der Blutzucker, stellt eine korrekte Einstellung doch unabhängig von der Grunderkrankung einen wichtigen Überlebensvorteil dar.[23]
Zur Minderung des zerebralen Schadens wurde 2010 für bewusstlose Erwachsene mit einer überlebten Reanimation eine Abkühlung auf 32–34 °C für 12 bis 24 Stunden empfohlen (milde therapeutische Hypothermie, MTH).[23] Dieses in den internationalen Leitlinien zur Reanimation von erwachsenen Patienten aufgenommene Verfahren trägt zur Erhöhung der Überlebensrate und zur Verbesserung des neurologischen Zustandes nach erfolgreichen Reanimationen bei[37] und sollte frühestmöglich veranlasst werden.[38] Eine Auswertung der INTCAR Datenbank (international cardiac arrest registry) von Sendelbach zeigte 2012:[39]
- Je fünf Minuten Verzögerung beim Einleiten der milden therapeutischen Hypothermie bedeuten einen Anstieg des schlechten neurologischen Outcomes um 8 %.
- 30 Minuten Verzögerung beim Erreichen der Zieltemperatur von 32 bis 34 °C erhöhen die Wahrscheinlichkeit eines schlechten neurologischen Outcomes um 17 %.
- Durchschnittlich benötigen Kliniken 94 Minuten bis zum Einleiten der MTH und 309 Minuten bis zum Erreichen der Zieltemperatur.
Das Erreichen einer Sauerstoffsättigung größer als 96 % scheint nicht indiziert, da eine Hyperoxämie in der Postreanimationsphase oxidativen Stress erzeugt und somit postischämisch Neurone schädigen kann. Tierexperimentelle Untersuchungen zeigten, dass sich das neurologische Outcome verbessert, wenn in der ersten Stunde nach ROSC die Sauerstoffgabe auf eine Ziel-Sauerstoffsättigung von 94–96 % ausgerichtet wird, der Patient also kontrolliert reoxygeniert wird.[40]
Sollten die Patienten längerfristig (>5 Tage) künstlich beatmet werden müssen, ist eine künstliche Ernährung über den Magen-Darm-Trakt oder venös sinnvoll.[41]
Prognose
[Bearbeiten | Quelltext bearbeiten]Die Überlebensraten bei einem Kreislaufstillstand hängen von vielen Faktoren ab. Die zugrunde liegende Ursache, Alter und Vorerkrankungen des Betroffenen wie auch der Zeitpunkt bis zur Einleitung von Reanimationsmaßnahmen sind unter anderem für diese Rate entscheidend, weswegen allgemeine Aussagen zur Prognose schwierig sind. Die langfristige Prognose nach einer primär erfolgreichen Reanimation wird von der Grunderkrankung bestimmt.
Von den menschlichen Organen reagieren die Nervenzellen des Gehirns am empfindlichsten auf Sauerstoffmangel. Schon drei Minuten nach Beginn des Kreislaufstillstands besteht die Gefahr von bleibenden Hirnschäden. Deshalb sind neben dem Überleben die neurologischen Folgeschäden ein weiterer wichtiger Aspekt bei der Wiederbelebung. Eine Vielzahl von Patienten, die einen Kreislaufstillstand überlebt haben, trägt solche Schäden davon. Voraussagen über neurologische Schäden nach überlebtem Kreislaufstillstand sind schwer zu treffen. Verlässliche diagnostische Verfahren gibt es nicht. Mit Einschränkungen weisen eine hohe Serumkonzentration der neuronenspezifischen Enolase (NSE) und der S-100-Proteine auf ein schlechteres Outcome hin.[23]
Die Zeit, die bis zum Beginn von Reanimationsmaßnahmen vergeht, ist der wichtigste der die Prognose beeinflussenden Faktoren. Pro Minute, die bis zum Beginn der Herz-Lungen-Wiederbelebung verstreicht, verringert sich die Überlebenswahrscheinlichkeit des Patienten um etwa 10 %. So sind bei Herzdruckmassage mit Beatmung und einer Defibrillation innerhalb der ersten drei bis fünf Minuten Überlebensraten von 50–75 % ohne bleibende Zellschäden möglich, die danach stark abfallen – nach vier Minuten auf unter 30 %. Unwiderrufliche Zellschäden und somit auch der biologische Tod treten erst fünf Minuten (bei Unterkühlung auch längere Zeit) nach dem sogenannten klinischen Tod auf.[42] Da in den europäischen Ländern die Frist bis zum Eintreffen des Rettungsdienstes meist bei acht Minuten oder mehr liegt, sind die Maßnahmen von anwesenden Laien für das Überleben des Patienten entscheidend. Ein schneller Beginn von Basismaßnahmen mit schnellem Notruf und erweiterten Maßnahmen, insbesondere Frühdefibrillation, verdoppeln bis verdreifachen insgesamt die Überlebensquote, bei Erwachsenen und Kindern.[8][43]
Die Ursache des Kreislaufstillstandes ist ein wichtiger prognostischer Faktor. In einer Untersuchung der über 21.000 in Schottland 1991–1998 außerhalb des Krankenhauses aufgetretenen Fälle eines Kreislaufstillstands waren etwa vier Fünftel kardialer Ursache; hiervon überlebten bis zur Entlassung etwa 7 %, ein Jahr danach lebten noch 6 %. Demgegenüber betrug die Überlebensrate ungefähr 2 % für das übrige Fünftel nicht-kardialer Ursache.[6] Reanimationen bei Kreislaufstillständen, die durch Traumata verursacht sind, haben eine besonders schlechte Erfolgsquote. Die weitaus meisten Überlebenden dieser Gruppe tragen Hirnschäden davon (> 98 %). Besser ist die Prognose bei Unterkühlung und Ertrinkungsunfällen.[23]
Ethische, rechtliche und psychische Aspekte
[Bearbeiten | Quelltext bearbeiten]
“There remains a widespread divergence of views on ethical aspects of resuscitation with the countries of Europe that are largely unpredictable according to commonly perceived national characteristics. […] For many ethical questions there can be no clear and correct didactic answers.”
„In vielen ethischen Aspekten der Reanimation herrscht ein weites Spektrum an Sichtweisen in Europa, die großteils nicht durch vermeintliche nationale Eigenheiten erklärbar sind. […] Für viele ethische Fragen kann es deshalb keine eindeutigen und richtigen Antworten geben.“[44]
Bei einem Kreislaufstillstand stellt sich unweigerlich die Frage nach dem Sinn von Reanimationsmaßnahmen und deren Abbruch. Diese Entscheidungen werden durch individuelle, international und lokal kulturelle, rechtliche, traditionelle, religiöse, soziale und ökonomische Faktoren beeinflusst.[44][45] Sie ist neben vielen anderen Fragen Thema der Medizinethik bzw. der Ethik allgemein.

An eine Patientenverfügung, in der die Unterlassung von Wiederbelebungsmaßnahmen formuliert sein kann, ist der behandelnde Arzt gebunden. Derartige Willensäußerungen eines Patienten werden in der Regel berücksichtigt, wenn die Patientenverfügung bekannt ist und Anweisungen für die tatsächlich eingetretene Situation enthält. Im präklinischen Bereich jedoch ist eine Prüfung unter dem situationsbedingten Zeitdruck oft schwierig bis unmöglich, so dass trotz einer Verfügung eine Reanimation begonnen wird. In der Haltung des medizinischen Personals zu schriftlichen Vorausverfügungen gibt es international erhebliche Abweichungen. Das Gleiche gilt auch für gesetzliche Regelungen zur Verbindlichkeit solcher Patientenverfügungen. Vorwiegend in den USA lassen sich manche Personen, die Wiederbelebungsversuche ablehnen „No CPR“ (no cardiopulmonary resuscitation) tätowieren oder bringen es mittels Pflastern oder Stempeln mit gleichem Wortlaut zum Ausdruck.[46] Diese Verfügung ist jedoch rechtlich umstritten.[47]
Neben dem Beginn von Reanimationsmaßnahmen wird auch deren Beendigung kontrovers diskutiert. Eindeutige Zeichen, die mit einem möglichen Erfolg oder Misserfolg einer Wiederbelebung korrelieren, sind bisher in keiner Studie eindeutig belegt worden. Sind die therapeutischen Möglichkeiten ausgeschöpft, dauert eine erfolglose Reanimation lange an oder sind keine Aussichten auf ein akzeptables Überleben gegeben, kann der behandelnde Arzt die Maßnahmen beenden.[48] Allgemeine Entscheidungsregeln zu dieser, die Verlängerung des Sterbestadiums eines Menschen lediglich vermeidenden, in den meisten Ländern legalen passiven Sterbehilfe beim Abbruch der Maßnahmen sowie auch zur Beendigung der Behandlung im persistierenden vegetativen Zustand nach einer Reanimation kann es nicht geben. Vor allem in den Ländern des angelsächsischen Sprachraums wird die Entscheidung zur Nicht-Aufnahme oder Beendigung der Wiederbelebung durch nichtärztliches Personal getroffen.[49] Diese Vorgangsweise wird in anderen Ländern strikt abgelehnt.
Sehr unterschiedliche Sichtweisen gibt es bei der Frage der Forschung und Ausbildung an gerade Gestorbenen.[50] Insbesondere im islamisch geprägten Kulturkreis, zunehmend aber auch in westlichen Staaten, insbesondere in den USA, wird dies abgelehnt. Verschiedene Fachgesellschaften sehen die Zukunft der Forschung in diesem Bereich durch die zunehmend striktere Gesetzgebung in vielen Ländern gefährdet.
Das Konzept der Anwesenheit von Angehörigen während der Reanimation entstand in den 1980er Jahren. Verschiedene Untersuchungen zeigen, dass es zur Bewältigung dieses belastenden Ereignisses beitragen kann. Dieses Vorgehen ist in vielen europäischen Ländern dabei, akzeptierte Praxis zu werden.[51][52] Eine wichtige Entwicklung ist die Unterstützung von traumatisierten Angehörigen nach erfolgloser Reanimation durch Kriseninterventionsteams.
Auch für Ärzte und Mitarbeiter des Rettungsdienstes stellt eine Reanimation einen psychisch belastenden Einsatz dar. In besonderem Maße betrifft dies die Wiederbelebung von Kindern. Mögliche Folge bei diesen Berufsgruppen ist die Ausbildung von posttraumatischen Belastungsstörungen und Burnout-Syndrom. Parallel zur Krisenintervention bei Angehörigen stehen für die Bewältigung besonders traumatisierender Erfahrungen Methoden für die Helfer zur Verfügung, die Critical Incident Stress Management (CISM) oder Stressbearbeitung nach belastenden Ereignissen (SbE) genannt werden.
Fachgesellschaften und Richtlinien
[Bearbeiten | Quelltext bearbeiten]Fachgesellschaften wie die American Heart Association (AHA), das European Resuscitation Council sowie das International Liaison Committee on Resuscitation (ILCOR) veröffentlichen regelmäßig gemeinsame Richtlinien zur Durchführung der Reanimation, die auf aktuellen wissenschaftlichen Erkenntnissen fußen. Aktuell sind die Richtlinien von 2010, die von den Ärztekammern einzelner Länder in verschiedenem Ausmaß übernommen und von Hilfsorganisationen, Krankenhäusern und anderen Institutionen mit Verzögerung und oft mit Unterschieden umgesetzt werden. Im März 2021 hat das ERC seine Richtlinien zuletzt aktualisiert[53].
In Deutschland haben sich die in der Bundesarbeitsgemeinschaft Erste Hilfe (BAGEH) vertretenen Hilfsorganisationen und der „Deutsche Beirat für Erste Hilfe und Wiederbelebung bei der Bundesärztekammer“ im Jahr 2002 auf einen nationalen Konsens geeinigt, der auf der vorhergehenden Version der Reanimationsrichtlinien von 2000 basierte. Im März 2006 veröffentlichte die Bundesärztekammer Eckpunkte für eine Aktualisierung, die auf den ERC-Richtlinien von 2005 basieren.[54] In Österreich und der Schweiz haben sich die ärztlichen Organisationen und die Organisationen, die den Rettungsdienst und die Breitenausbildung in Erster Hilfe durchführen, darauf verständigt, die ERC-Richtlinien anzuwenden.
Um einen wissenschaftlichen Vergleich von Reanimationen weltweit zu ermöglichen, schufen die führenden Verbände Mitte der 1990er Jahre mit Festlegung des Utstein-Style-Protokolls einen einheitlichen Datensatz.[55] Zahlreiche Veröffentlichungen zu Reanimationsabläufen orientieren sich daran. In Deutschland baut die Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI) seit 2003 ein bundesweites Reanimationsregister auf.

Seit 2012 fördern Anästhesisten in Deutschland, vertreten durch die DGAI, den Berufsverband Deutscher Anästhesisten e. V., den Deutschen Rat für Wiederbelebung und die Stiftung Deutsche Anästhesiologie, gestützt vom Bundesministerium für Gesundheit, mit ihrer Kampagne „Ein Leben retten. 100 Pro Reanimation“ die Steigerung der Reanimationsrate durch Laien. Dabei soll das Selbstvertrauen der Menschen in ihre eigenen Fähigkeiten als Ersthelfer gestärkt werden und die Ersthelferquote nachhaltig und langfristig gesteigert werden. Aus verschiedenen Gründen greifen zu wenige Personen bei einem Notfall helfend ein: Sie wissen nicht, was zu tun ist, oder wenden Gelerntes nicht an – meist aus Scheu, etwas falsch zu machen. Die Daten des Deutschen Reanimationsregisters zeigen, dass 2012 in Deutschland die Bereitschaft zur Reanimation durch medizinische Laien bei 19,8 Prozent lag. Dies ist ein im Vergleich zu anderen europäischen Ländern geringer Wert, wo die Erste-Hilfe-Bereitschaft (Ersthelferquote) deutlich höher liegt. Zum Beispiel weisen die Niederlande eine Quote von 70 Prozent auf, gefolgt von Schweden (68 %), Norwegen (63 %) und Tschechien (55 %). Mit der Kampagne konnte eine deutliche Verbesserung der Erste-Hilfe-Bereitschaft erreicht werden. So stieg die Bereitschaft zur Reanimation im Folgejahr auf fast 28 Prozent.[3] Im Jahr 2019 lag die Laien-Reanimationsquote in Deutschland bei 42 %.[56]
Lehre in der Reanimation
[Bearbeiten | Quelltext bearbeiten]Die Lehre in der Reanimation ist wissenschaftlich untersucht und ein zentraler Baustein, um das Überleben von Patienten zu verbessern. Sie hat ein eigenes Kapitel in der ERC-Leitlinie zur kardiopulmonalen Reanimation.[57] Es existieren evidenzbasierte Anleitungen für Bürger und Fachkräfte im Gesundheitswesen, um das Lehren und Erlernen von Wissen, Fähigkeiten und Einstellungen zur Reanimation zu fördern. Ziel der ERC-Leitlinie sind auch staatliche und politische Institutionen im Gesundheitswesen und im Bildungsbereich. Dabei wird sich auf die zweite wichtige Komponente der Utstein-Überlebensformel, nämlich die „Effizienz der Lehre“ konzentriert.[57] Die Bildungsmethoden sind die entscheidende Brücke zwischen wissenschaftlichen Erkenntnissen und ihrer praktischen Anwendung.[57] Die Qualität von Lehrinitiativen im Bereich der Reanimation kann durch die Anwendung pädagogischer Theorien verbessert werden.[57]
Die fünf Kernaussagen der ERC-Leitlinie zur Lehre umfassen:
- Der ERC bietet CPR-Unterricht an, um allen Bürgern die grundlegenden Fertigkeiten zu vermitteln, ein Leben retten zu können
- Die erforderlichen Reanimationsmaßnahmen sind leicht zu erlernen und leicht zu vermitteln
- Verbesserungen des Basic-Lifesupport-Unterrichts
- Medizinisches Fachpersonal soll an Kursen zu erweiterten lebensrettenden Maßnahmen teilnehmen und seine Zertifikate erhalten
- Faculty Development – Entwicklung der Lehrenden
- (ERC-Leitlinie 2021)[57]
Geschichte der Wiederbelebung
[Bearbeiten | Quelltext bearbeiten]Altertum
[Bearbeiten | Quelltext bearbeiten]Schon seit Jahrtausenden wird versucht, Menschen, die keine klaren Lebenszeichen mehr zeigen, wieder ins Leben zurückzurufen. Dabei gab es verschiedene Versuche, bewusstlose Personen durch laute Ansprache, Berührung, Atemspende und Thoraxkompression zu reanimieren.
Der Ursprung der Atemspende ist nicht bekannt, man weiß nur, dass die Methode sehr alt ist. Möglicherweise hatten die Ägypter schon vor etwa 5000 Jahren erste Kenntnisse von Beatmungstechniken, worauf Funde hindeuten.[58] Im 2. Buch der Könige im Alten Testament (etwa 700 v. Chr.) heißt es:
„Als Elischa in das Haus kam, lag das Kind tot auf seinem Bett. Er ging in das Gemach, schloss die Tür hinter sich und dem Kind und betete zum Herrn. Dann trat er an das Bett und warf sich über das Kind; er legte seinen Mund auf dessen Mund, seine Augen auf dessen Augen, seine Hände auf dessen Hände. Als er sich so über das Kind hinstreckte, kam Wärme in dessen Leib.“[59]
Weitere Bibelwunder[60] lassen ebenfalls an eine Wiederbelebung denken.[61]
Neuzeit
[Bearbeiten | Quelltext bearbeiten]Lange Zeit bestimmte die Lehre des Galen von Pergamon aus der Zeit der Spätantike die Vorstellungen von den Vorgängen im menschlichen Körper. Erst im 17. Jahrhundert wurde Galens Lehre von William Harveys Entdeckung des Blutkreislaufes abgelöst. Dieser beschrieb zum ersten Mal schlüssig und zusammenhängend den Blutkreislauf und die Aufgabe des Herzens als Druckpumpe. Zuvor hatte bereits Andreas Vesal Galens Fehler aus der Tieranatomie verbessert.[62] Vesal gelang zudem im Tierversuch, durch Beatmung eines Tieres mit Herzstillstand über ein in die Luftröhre eingebrachtes Schilfrohr, eine Wiederbelebung. Bei der Londoner Royal Society demonstrierte der Universalgelehrte Robert Hooke 1667 die Beatmung anhand des über eine Thorakotomie geöffneten Brustkorbs eines Hundes und die dabei sichtbare Belüftung der Lunge. Ähnlich wie Vesal konnte er zeigen, dass das Herz ohne Beatmung zum Stillstand kommt, bei kontinuierlicher Luftinsufflation es aber zum Wiedereinsetzen der Herzkontraktionen kommt.[63] An einem Bergmann führte 1744 der Chirurg Tossach erstmals eine erfolgreiche Mund-zu-Mund-Beatmung durch. Eine Beschreibung der Mund-zu-Mund-Beatmung veröffentlichte kurz darauf auch der französische Anatom und königliche Leibarzt Antoine Portal (1742–1832).[64] Auch der Mediziner John Hunter konnte 1755 zeigen, dass ein aufgrund Asphyxie stillstehendes Herz durch Beatmung „wiederbelebbar“ ist, und leitete aus den Ergebnissen seiner Experimente in seiner Schrift Proposals for the Recovery of People apparently Drowned Richtlinien für die Wiederbelebung von Ertrunkenen ab (Auch kannte Hunter bereits die Vorteile des Einsatzes des erst kurz zuvor entdeckten Sauerstoffs bei der Beatmung). Als J. M. Schosulan der Ältere 1786[65] versuchte, Reanimationsmethoden auch Laienhelfern[66] zu vermitteln, war die Mund-zu-Mund- oder Mund-zu-Nase-Beatmung bereits gut bekannt, ebenso die Vorteile eines Luftröhrenschnitts als Bestandteil von Wiederbelebungsmaßnahmen bei Verlegung der oberen Atemwege.[67] Man hatte somit die Bedeutung der Beatmung für die Wiederbelebung „Scheintoter“ erkannt, neue Erkenntnisse wurden jedoch nicht konsequent in der Wiederbelebung umgesetzt.
Es gab aus heutiger Sicht auch kuriose Empfehlungen zur Wiederbelebung, beispielsweise die Empfehlung, warme Luft mit einem Blasebalg oder einer Klistierspritze in die Gedärme zu blasen, oder das Einblasen von Tabakrauch (Fumigation) in den Darm. Der spätere Großherzog von Sachsen-Weimar-Eisenach, Carl August, erließ 1776 die folgende Anweisung zur Wiederbelebung:
„Hierauf muss man Luft in den Mund blasen, entweder mittels eines Blasebalgs oder, welches besser, auf die Weise, dass ein Mensch, der eine gesunde Lunge hat, seinen Mund auf den Mund des Ertrunkenen einbringt und dazu sich eines abgebrochenen Pfeifenstils oder einer anderen Röhre bedient, bei diesem sowohl des Odems, als auch Tabakrauch aber muss ein anderer mit der einen Hand die Nase des Ertrunkenen zuhalten und mit der anderen über die Brust hin und her streichen und vornehmlich von der Herzgrube nach der Brust reiben und rücken.“[68]
Im Jahr 1895 veröffentlichte Oscar Langendorff als eines seiner Ergebnisse aus physiologischen Experimenten, dass ein stillstehendes Herz nur wieder zum Schlagen zu bringen ist, wenn vor der Wiederbelebung der Herzmuskel oxygeniert (ausreichend mit Sauerstoff versorgt) worden ist. Zu Beginn des 20. Jahrhunderts wurde, unter anderem von Hans Winterstein, experimentell bestätigt, dass für die Wiederbelebung des Gesamtorganismus nur eine kurze Frist zur Verfügung steht.[69]

Im 19. Jahrhundert wurde auch eine Vielzahl verschiedener manueller Verfahren der Atemspende durch direkte oder indirekte Thoraxkompression ausprobiert und beschrieben, wie etwa die Methode nach Silvester, bei der die Beatmung durch passive Armbewegungen des Patienten praktiziert werden soll.[70]
Auch zur Frage der Herzdruckmassage gab es verschiedene Ansätze. Moritz Schiff hatte erstmals im Tierexperiment direkte Herzmassagen am durch Thorakotomie freigelegten Herzen durchgeführt, während die Lungen automatisch belüftet wurden, und erreichte damit eine circulation artéficielle. Im Jahr 1874 berichtete Schiff darüber der Medizinisch-Physikalischen Gesellschaft und im selben Jahr publizierte dies T. G. Hake. 1888 führte der Chirurg Niehaus in Bern bei einem 40-jährigen Mann mit „Chloroformsynkope“, nach Rippenresektion und Freilegung des Herzens eine manuelle Herzmassage durch. Das dem Kreislaufstillstand zugrundeliegende Kammerflimmern konnte damit allerdings nicht behoben werden. Publiziert wurde diese erste direkte Herzmassage beim Menschen 1903.[71] Der französische Herzchirurg Théodore Tuffier (1857–1929) hatte erstmals erfolgreich eine (interne, d. h. nach Thorakotomie am offenen Brustkorb durchgeführte) direkte Herzmassage an einem Menschen versucht,[72] worüber Tuffier und Hallion 1898 berichteten. Eine offene Herzmassage wird heute nur noch selten angewandt (etwa bei Herzstillstand im Operationssaal bei offenem Brustkorb bzw. nach Thorakotomie oder bei einem Thoraxtrauma mit offenen Verletzungen). Bei Bauchoperationen wurde auch die erstmals 1903 von M. Bourcart anhand von Tierversuchen vorgestellte, aber schon zuvor, wie Ernest Starling 1902 berichtete, von dem Chirurgen Lane an einem Menschen erfolgreich angewendete subdiaphragmale Herzmassage über das geschlossene Zwerchfell angewandt. Über das eröffnete Zwerchfell wurde der von Mauclaire 1902 vorgeschlagene transdiaphragmatische (mit dem Daumen geschaffene) Zugang zum Herzen erprobt, der am 5. Dezember 1901 bereits von P. Poirier bei einer transdiaphragmatischen Herzmassage durchgeführt worden war. Im Gegensatz zum subdiaphragmatischen Vorgehen erfolgten für das transdiaphragmatische keine Erfolgsmeldungen. Der chirurgische Assistenzarzt Friedrich Maass hatte 1892 festgestellt, dass rasch aufeinanderfolgende rhythmische Kompressionen der unteren Thoraxapertur mit 120 Kompressionen pro Minute effektiver sind als niedrigere Frequenzen. Dieses auch von Maass Lehrer Franz Koenig verteidigte Verfahren der äußeren Herzmassage fand jedoch erst fast 70 Jahre später allgemeine Akzeptanz.[73] Im Jahr 1904 erschien das Buch Die Frau als Hausärztin von Anna Fischer-Dückelmann, in dem eine Anleitung zu einer externen Herzmassage zu finden ist:
„Indirekte Herzmassage: Das Zwerchfell wird beeinflusst, ebenso das Herz, wenn man mit beiden Handflächen die Eingeweide in die Höhe schiebt und nach links aufwärts drückt, dann plötzlich loslässt. – Dadurch wird das Herz hinauf und hinunter geschoben, durch die Erhebung des Zwerchfelles aber die Brusthöhle zuerst verengt, und, wenn es plötzlich wieder herabsinkt, erweitert. Ist noch ein Funken Leben vorhanden, so sind solche Anregungen wohl imstande, Atmung und Herzschlag wieder in Gang zu bringen. Bei verunglückten Kindern können Frauen diese ‚erste Hilfe bei Unglücksfällen‘ wohl zur Anwendung bringen.“[74]
In neuerer Zeit wurde die externe Herzmassage insbesondere 1960 von Kouwenhoven, James Jude und G. Guy Knickerbocker (in Kombination mit der von Peter Safar in den 1950er Jahren propagierten Mund-zu-Mund-Beatmung) empfohlen.[75]
Entwicklung der modernen Reanimation im 20. Jahrhundert
[Bearbeiten | Quelltext bearbeiten]
Sowjetische Mediziner experimentierten Ende der 1930er Jahre mit Wiederbelebungstechniken an Hunden allein durch Blutzufuhr. Ein 1940 in New York gezeigter Werbefilm der sowjetischen Filmagentur, Experiments in the revival of organisms, demonstriert u. a. neurologische Reaktionen eines abgeschnittenen, aber mit Blut versorgten Hundeschädels sowie die vermeintliche Wiederbelebung eines Hundes nach 10 Minuten Herzstillstand durch eine externe Blutversorgungsmaschine.[76]
Seit den 1950er Jahren wird die kardiopulmonale Reanimation auf einer modernen wissenschaftlichen Grundlage praktiziert.[11] Anfang der 1960er Jahre führten verschiedene Forschungsergebnisse zur Entwicklung der im Prinzip bis heute gültigen Reanimationstechnik. 1957 gelang es Greene nachzuweisen, dass mit der Ausatemluft des Helfers ein ausreichender Gasaustausch erzielt werden konnte und dass die Mund-zu-Mund-Beatmung den vorher benutzten Beatmungsverfahren überlegen ist.[77] 1960 erkannte William B. Kouwenhoven die Effektivität der äußeren Herzdruckmassage, die zuvor nur als Verfahren bei eröffnetem Brustkorb eingesetzt worden war,[78] und führte damit die externe Herzmassage allgemein ein. Er, J. R. Jude und G. Knickerbocker berichteten 1961 über 33 nachhaltige Erfolge beim Einsatz dieser Methode zur Wiederbelebung nach Herzinfarkten.[79][80]
Ein weiterer entscheidender Schritt erfolgte durch Peter Safar. Der amerikanische Anästhesist und gebürtige Wiener hatte die geringen Erfolge der bisherigen Methoden erkannt und konnte zeigen, dass eine Kombination aus Herzdruckmassage und Beatmung höhere Erfolgsraten aufweist. Dazu erprobte er die Wirksamkeit seiner kardiopulmonalen Reanimation an freiwilligen Kollegen aus seinem Forschungsteam.[81] Aufgrund dieser Forschungsergebnisse, die die Grundlage der modernen Wiederbelebungstechniken bilden, wird Safar oft auch als „Vater der kardiopulmonalen Reanimation“ bezeichnet.
Parallel hierzu war in den 1950er Jahren durch den Ingenieur Hesse und den Arzt Ruben der Beatmungsbeutel erfunden worden.[82] Um die Handhabung des Beutels üben zu können, entwickelten die beiden Erfinder eine Puppe, die damit beatmet werden konnte. Das erste Trainingsgerät wurde dann 1958 an das dänische Rote Kreuz verkauft (Ambu-Phantom). Im Jahre 1960 wurde das Gerät dann um die Funktion der Thoraxkompression und der Mund-zu-Mund-Beatmung ergänzt, so dass das weltweit erste „Übungs-Phantom“ entstanden war. Bei einer Reise nach Norwegen lernte Safar den Spielzeugfabrikanten Asmund Laerdal kennen. Gemeinsam entwickelten Safar und Laerdal die so genannte Resusci-Anne. Mit dieser einfachen Puppe wurde es möglich, auch Laien in der Herz-Lungen-Wiederbelebung auszubilden.
Die ersten Versuche mit einer Elektroschockbehandlung bei Herzrhythmusstörungen wurden schon in den 1940er Jahren unternommen, anfangs mit Wechselstrom.[83] Anfang der 1960er Jahre ist von dem US-amerikanischen Kardiologen Bernard Lown die Defibrillation und elektrische Kardioversion durch Gleichstrom entwickelt worden.[84] Eine solche Methode war aufgrund des Kalten Krieges unabhängig davon schon 1946 in der Sowjetunion beschrieben worden.[85] Die Weiterentwicklung der Defibrillatoren führte in den 1990er Jahren schließlich zu Geräten, die auch zur Anwendung durch den Ersthelfer geeignet sind.
Basis für Ende des 20. Jahrhunderts etablierte Reanimationsmethoden waren Empfehlungen der American Heart Association und des European Resuscitation Council, für Deutschland auch die Richtlinien des Wiederbelebungsbeirats der Bundesärztekammer zur Durchführung der Reanimation.[86]
Versuche zur die Thoraxkompressionen ergänzenden abdominalen Kompression haben keine Anwendung in der Praxis erlangt.[87]
Im Jahr 2012 wurde erstmals eine mobile Herz-Lungen-Maschine zur Wiederbelebung verwendet.[88]
Aktuelle Entwicklungen
[Bearbeiten | Quelltext bearbeiten]In den letzten Jahren zeichnet sich ein zunehmender Stellenwert der Herzdruckmassage gegenüber der Beatmung ab. So wurde etwa das Verhältnis von Herzdruckmassage zu Beatmung von 15:2 auf 30:2 geändert, um die Phase der durchgehenden Druckmassage zu verlängern.
Es wurden Reanimationskonzepte entwickelt, bei denen dieses Verhältnis noch weiter gedehnt wird (etwa 100:5)[89] und solche mit kontinuierlicher Herzdruckmassage bei völligem Verzicht auf die Atemspende, Continuous-Chest-Compression-(CCC)-Resuscitation genannt.[90] Diese erhöhten in einzelnen Studien die Überlebensrate beim beobachteten Kreislaufstillstand mit kardialer Ursache beim Erwachsenen (SOS-KANTO Study Group).[91]
Der European Resuscitation Council sieht die Datengrundlage für eine ausschließliche Herzdruckmassage nicht als ausreichend für eine generelle Empfehlung einer solchen Vorgehensweise als Standardbehandlung an.[92][22] Allerdings erwies sich eine ausschließliche Herzdruckmassage ohne Beatmung besser, als gar keine Maßnahmen zu ergreifen.[93][94] Daher wird in den aktuellen Leitlinien empfohlen, dass Laienhelfer zumindest eine Herzdruckmassage durchführen sollten, wenn sie sich nicht in der Lage sehen, eine Beatmung durchzuführen.
Ein Präkordialer Faustschlag, insbesondere bei beobachtetem Kreislaufstillstand, wird nicht mehr generell empfohlen.
Automatische Reanimationsgeräte für die Herzdruckmassage kommen zunehmend prä- und innerklinisch im Rahmen der professionellen Versorgung (Advanced Life Support) zum Einsatz. Studien zufolge führen diese zwar insbesondere präklinisch zu einer besseren Qualität und einer höheren Überlebensrate bis zur Krankenhausaufnahme, haben jedoch keinen Einfluss auf das Langzeitüberleben oder den neurologischen Zustand. Sie sind vor allem im Falle von Ermüdung, Personalmangel und anderen Situationen, in denen die Durchführung einer qualitativen Herzdruckmassage nicht möglich ist, sinnvoll.[95][96] Die AHA- und ERC-Leitlinien ziehen die Anwendung solcher Geräte bei längeren Transporten und bei der Reanimation im Herzkatheterlabor in Betracht.[97]
In Deutschland werden derzeit (Stand 2019) außerhalb des Krankenhauses etwa 52.000 Reanimationen pro Jahr durchgeführt, wovon etwa 45 Prozent primär erfolgreich sind.[98]
Literatur
[Bearbeiten | Quelltext bearbeiten]Leitlinien der European Resuscitation Council (ERC)
[Bearbeiten | Quelltext bearbeiten]- Gavin D. Perkins, u. a.: Erweiterte lebensrettende Maßnahmen für Erwachsene. In: Notfall & Rettungsmedizin. Band 24, Nr. 4, 8. Juni 2021, S. 406–446, doi:10.1007/s10049-021-00893-x.
- Patrick Van de Voorde, Nigel Turner, u. a.: Lebensrettende Maßnahmen bei Kindern (Paediatric Life Support, PLS). In: Notfall & Rettungsmedizin. Band 24, Nr. 4, 2. Juni 2021, S. 650–719, doi:10.1007/s10049-021-00887-9.
- Jerry P. Nolan, Claudio Sandroni, u. a.: Postreanimationsbehandlung. In: Notfall & Rettungsmedizin. Band 24, Nr. 4, 1. Juni 2021, S. 524–576, doi:10.1007/s10049-021-00892-y.
- John Madar, Charles Christoph Roehr, u. a.: Versorgung und Reanimation des Neugeborenen nach der Geburt. In: Notfall & Rettungsmedizin. Band 24, Nr. 4, 1. Juni 2021, S. 603–649, doi:10.1007/s10049-021-00894-w.
- Carsten Lott, Anatolij Truhlář, u. a.: Kreislaufstillstand unter besonderen Umständen. In: Notfall & Rettungsmedizin. Band 24, Nr. 4, 10. Juni 2021, S. 447–523, doi:10.1007/s10049-021-00891-z.
- Robert Greif, Andrew Lockey, u. a.: Lehre in der Reanimation. In: Notfall & Rettungsmedizin. Band 24, Nr. 4, 1. Juni 2021, S. 750–772, doi:10.1007/s10049-021-00890-0.
- Spyros D. Mentzelopoulos, Keith Couper, u. a.: Ethik der Reanimation und Entscheidungen am Lebensende. In: Notfall & Rettungsmedizin. Band 24, Nr. 4, 2. Juni 2021, S. 720–749, doi:10.1007/s10049-021-00888-8.
Internationale Leitlinien
[Bearbeiten | Quelltext bearbeiten]- Myra H. Wyckoff, Robert Greif, u. a.: 2022 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science With Treatment Recommendations: Summary From the Basic Life Support; Advanced Life Support; Pediatric Life Support; Neonatal Life Support; Education, Implementation, and Teams; and First Aid Task Forces. In: Resuscitation. Band 181, 29. Oktober 2022, S. 208–288, doi:10.1016/j.resuscitation.2022.10.005 (englisch).
Geschichte
[Bearbeiten | Quelltext bearbeiten]- Heinrich L’Allemand: Wiederbelebung. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 217–228.
Historische Literatur (Auswahl)
[Bearbeiten | Quelltext bearbeiten]- Christian August Struve: Versuch über die Kunst Scheintodte zu beleben und über die Rettung in schnellen Todesgefahren, ein tabellarisches Taschenbuch. Hannover 1797.
- C. J. Flachsland: Über die Behandlung der Scheintoten. Karlsruhe 1806.
- G. Reimer: Anweisung zur zweckmäßigen Behandlung und Rettung der Scheintodten oder durch plötzliche Zufälle verunglückter Personen. Herausgegeben auf Veranlassung des königlichen Ministerii der geistlichen Unterrichts und Medizinal Angelegenheiten. Berlin 1820.
- Josef Bernt: Vorlesungen über die Rettungsmittel beim Scheintod und in plötzlichen Lebensgefahren. Wien 1837.
- Friedrich von Esmarch: Die erste Hülfe bei plötzlichen Unglücksfällen. Ein Leitfaden für Samariter-Schulen in fünf Vorträgen. Leipzig 1882; später unter dem Titel Die erste Hilfe bei plötzlichen Unglücksfällen. Ein Leitfaden für Samariter-Schulen in sechs Vorträgen. ebenda 1912, S. 69–82.
- Ernst Engelhorn: Das Samariterbuch. Ein Leitfaden für die erste Hilfe bei Unglücksfällen und die Krankenpflege im Hause, insbesondere auch zum Gebrauche für Damenkurse. Ferdinand Enke, Stuttgart 1909, S. 71–82 und 97.
- H. E. Stephenson: Cardiac Arrest and Resuscitation. St. Louis 1958.
- N. G. Bircher, Peter Safar: Open chest CPR is better for the brain than standard or new external CPR. In: Anesthesiology. Band 55, 1981, S. 104 ff.
- L. Tonczar: Kardiopulmonale Wiederbelebung (= Anästhesiologie und Intensivmedizin. Band 147). Springer, Berlin / Heidelberg / New York 1982.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Bundesweites Reanimationsregister der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin e. V. (DGAI)
- Reanimationsleitlinien des Deutschen Rates für Wiederbelebung
- European Resuscitation Council (ERC)
- cprguidelines.eu – Current ERC Guidelines (englisch)
- Austrian Resuscitation Council Website mit kompletten Guidelines (deutsch)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Ein Leben retten. 100 Pro Reanimation. einlebenretten.de
- ↑ Kampagne „Ein Leben retten. 100 Pro Reanimation“. Berufsverband Deutscher Anästhesisten e. V.
- ↑ a b Kampagne „Ein Leben retten. 100 Pro Reanimation“. Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin e. V.
- ↑ Vgl. www.youtube.com.
- ↑ Herzdruckmassage - AC/DC gibt den Takt vor. Sana Medizinwelten ZNA, abgerufen am 22. Januar 2024.
- ↑ a b c J. P. Pell, J. M. Sirel, A. K. Marsden u. a.: Presentation, management, and outcome of out of hospital cardiopulmonary arrest: comparison by underlying aetiology. In: Heart, 89, 2003, S. 839–842. PMID 12860852
- ↑ Deutscher Rat für Wiederbelebung - German Resuscitation Council (GRC) e. V. Abgerufen am 12. Mai 2021.
- ↑ a b c d e f g h i R. W. Koster u. a.: European Resuscitation Council Guidelines for Resuscitation 2010 Section 2. Adult basic life support and use of automated external defibrillators. In: Resuscitation. Band 81, Nr. 10, Oktober 2010, S. 1277–1292. PMID 20956051
- ↑ a b C. D. Deakin, J. P. Nolan, K. Sunde, R. W. Koster: European Resuscitation Council Guidelines for Resuscitation 2010 Section 3. Electrical therapies: Automated external defibrillators, defibrillation, cardioversion and pacing. In: Resuscitation. Band 81, Nr. 10, Oktober 2010, S. 1293–1304. PMID 20956050
- ↑ J. Nolan: European Resuscitation Council guidelines for resuscitation 2005. Section 1. Introduction. In: Resuscitation. Band 67, Supplement 1, 2005, S. S3–S6. PMID 16321715.
- ↑ a b c Walied Abdulla: Interdisziplinäre Intensivmedizin. Urban & Fischer, München u. a. 1999, ISBN 3-437-41410-0, S. 5.
- ↑ Walied Abdulla: Interdisziplinäre Intensivmedizin. Urban & Fischer, München u. a. 1999, ISBN 3-437-41410-0, S. 5–15.
- ↑ Walied Abdulla: Interdisziplinäre Intensivmedizin. Urban & Fischer, München u. a. 1999, ISBN 3-437-41410-0, S. 5 f.
- ↑ Harald Genzwürker, Jochen Hinkelbein: Fallbuch Anästhesie, Intensivmedizin und Notfallmedizin. Georg Thieme, Stuttgart / New York 2005, ISBN 3-13-139311-4, S. 202.
- ↑ Harald Genzwürker, Jochen Hinkelbein: Fallbuch Anästhesie, Intensivmedizin und Notfallmedizin. Georg Thieme, Stuttgart / New York 2005, ISBN 3-13-139311-4, S. 202.
- ↑ ERC Richtlinien 2015, S. 761, doi:10.1007/s10049-015-0081-1
- ↑ Heinrich L’Allemand: Wiederbelebung. 1973, S. 219–221.
- ↑ Albert Hoffa: Technik der Massage. Enke Verlag, Stuttgart 1893; 5., verbesserte Auflage ebenda 1907, S. 75 (Oertels Herzmassage).
- ↑ Vgl. etwa M. L. Weisfeldt, N. Chandra, J. Tsitlik: Increased intrathoracic pressure – not direct heart compression – causes the rise in intrathoracic vascular pressures during CPR in dogs and pigs. In: Criticial Care Medicine. 9, 1981, S. 377 ff.
- ↑ Walied Abdulla: Interdisziplinäre Intensivmedizin. Urban & Fischer, München u. a. 1999, ISBN 3-437-41410-0, S. 13 f.
- ↑ DAN Netzwerk Deutscher Apotheker – Die Wiederbelebung
- ↑ a b R. W. Koster, L. L. Bossaert, J. P. Nolan, D. Zideman, on behalf of the Board of the European Resuscitation Council: Advisory statement of the European Resuscitation Council. ( vom 13. April 2016 im Internet Archive) (PDF; 52 kB). 31. März 2008.
- ↑ a b c d e f g h i j k C. D. Deakin u. a.: European Resuscitation Council Guidelines for Resuscitation 2010 Section 4. Adult advanced life support. In: Resuscitation, 81(10), Okt 2010, S. 1305–1352. PMID 20956049
- ↑ Z. Kalenda: The capnogram as a guide to the efficiacy of cardiac massage. In: Resuscitation. 6, 1980, S. 259 ff.
- ↑ Vgl. etwa B. C. Hodgkin und andere: Effects of PEEP and of increased frequency of ventilations during CPR. In: Critical Care Medicine. Band 8, 1980, S. 123 ff.
- ↑ Y. Ido und andere: Effects of positive end-expiratory pressure on carotid blood flow during closed-chest cardiopulmonary resuscitation in dogs. In: Anesth Analg. Band 61, 1982, S. 557 ff.
- ↑ Leitlinie 2021 – kompakt. (PDF; 3,5 MB) grc-org.de, S. 56; abgerufen am 17. März 2023
- ↑ K. Aung, T. Htay: Vasopressin for cardiac arrest: a systematic review and meta-analysis. In: Arch Intern Med. 165(1), 2005, S. 17–24. PMID 15642869.
- ↑ P. Dorian, D. Cass, B. Schwartz, R. Cooper, R. Gelaznikas, A. Barr: Amiodarone as compared with lidocaine for shock-resistant ventricular fibrillation. In: N Engl J Med. 346, 2002, S. 884–890. PMID 11907287
- ↑ Peter J. Kudenchuk u. a.: Amiodarone, Lidocaine, or Placebo in Out-of-Hospital Cardiac Arrest. In: N Engl J Med. 374, 2016, S. 1711–1722. doi:10.1056/NEJMoa1514204
- ↑ a b J. Soar u. a.: European Resuscitation Council Guidelines for Resuscitation 2010 Section 8. Cardiac arrest in special circumstances. In: Resuscitation. 81(10), Okt 2010, S. 1400–1433. PMID 20956045
- ↑ Harald Genzwürker, Jochen Hinkelbein: Kardiopulmonale Reanimation bei Kindern. 2005, S. 175.
- ↑ K. D. Young, J. S. Seidel: Pediatric cardiopulmonary resuscitation: a collective review. In: Ann Emerg Med., 33(2), 1999, S. 195–205. PMID 9922416.
- ↑ a b c D. Biarent u. a.: European Resuscitation Council Guidelines for Resuscitation 2010 Section 6. Paediatric life support. In: Resuscitation. 81(10), Oktober 2010, S. 1364–1388. PMID 20956047.
- ↑ S. Richmond, J. Wyllie: European Resuscitation Council Guidelines for Resuscitation 2010 Section 7. Resuscitation of babies at birth. In: Resuscitation. 81(10), Oktober 2010, S. 1389–1399. PMID 20956046.
- ↑ A. Langhelle u. a.: Recommended guidelines for reviewing, reporting, and conducting research on post-resuscitation care: the Utstein style. In: Resuscitation. (3), 2005, S. 271–283. PMID 16129543.
- ↑ Deutsche Gesellschaft für Kardiologie. 04/2014.
- ↑ Eckpunkte für die Reanimation. ( vom 1. Januar 2015 im Internet Archive; PDF) Bundesärztekammer, 2010.
- ↑ S. Sendelbach, M. O. Hearst u. a.: Effects of variation in temperature management on cerebral performance category scores in patients who received therapeutic hypothermia post cardiac arrest. In: Resuscitation, Band 83, Nummer 7, Juli 2012, S. 829–834, doi:10.1016/j.resuscitation.2011.12.026, PMID 22230942.
- ↑ C. D. Deakin u. a.: Erweiterte Reanimationsmaßnahmen für Erwachsene („advanced life support“). Sektion 4 der Leitlinien zur Reanimation 2010 des European Resuscitation Council. In: Notfall Rettungsmed. 13, 2010, S. 559–620.
- ↑ Leitlinien Enterale und Parenterale Ernährung. Deutsche Gesellschaft für Ernährungsmedizin, 2007, ISBN 978-3-13-148091-0.
- ↑ Walied Abdulla: Interdisziplinäre Intensivmedizin. Urban & Fischer, München u. a. 1999, ISBN 3-437-41410-0, S. 4 f.
- ↑ M. Kuisma, P. Suominen, R. Korpela: Paediatric out-of-hospital cardiac arrests: epidemiology and outcome. In: Resuscitation, Band 30, 1995, S. 141–150. PMID 8560103.
- ↑ a b P. J. Baskett, A. Lim: The varying ethical attitudes towards resuscitation in Europe. In: Resuscitation, 2004, 62, S. 267–273. PMID 15325445.
- ↑ P. J. Baskett, P. A. Steen, L. Bossaert: European Resuscitation Council guidelines for resuscitation 2005. Section 8. The ethics of resuscitation and end-of-life decisions. In: Resuscitation, 2005, 67 Suppl 1, S. S171–S80. PMID 16321712.
- ↑ NoPCR. Abgerufen am 7. Februar 2021.
- ↑ Patient mit „Nicht Wiederbeleben“-Tattoo verunsichert Ärzte. Spiegel Online, 5. Dezember 2017; abgerufen am 7. Februar 2021.
- ↑ M. J. Bonnin, P. E. Pepe, K. T. Kimball, P. S. Clark Jr: Distinct criteria for termination of resuscitation in the out-of-hospital setting. In: JAMA, 1993, 270, S. 1457–1462. PMID 8204131.
- ↑ A. C. Naess, E. Steen, P. A. Steen: Ethics in treatment decisions during out-of-hospital resuscitation. In: Resuscitation, 1997, 33(3), S. 245–56. PMID 9044497.
- ↑ R. M. Morag, S. DeSouza, P. A. Steen, A. Salem, M. Harris, O. Ohnstad, J. T. Fosen, B. E. Brenner: Performing procedures on the newly deceased for teaching purposes: what if we were to ask? In: Arch Intern Med., 2005, 165(1), S. 92–96. PMID 15642881.
- ↑ C. J. Doyle, H. Post, R. E. Burney, J. Maino, M. Keefe, K. J. Rhee: Family participation during resuscitation: an option. In: Ann Emerg Med., 1987, (6), S. 673–675. PMID 3578974.
- ↑ S. Köberich: Anwesenheit von Angehörigen während einer kardiopulmonalen Reanimation. In: intensiv, 2005, 13, S. 215–220.
- ↑ Deutscher Rat für Wiederbelebung – German Resuscitation Council (GRC) e. V. Abgerufen am 12. Mai 2021.
- ↑ Eckpunkte für die Reanimation. ( vom 29. September 2007 im Internet Archive; PDF; 34 kB) der Bundesärztekammer, 2006.
- ↑ A. H. Idris u. a.: Utstein-style guidelines for uniform reporting of laboratory CPR research. In: Circulation. 94(9), 1996, S. 2324–2336. PMID 8901707.
- ↑ Öffentlicher Jahresbericht 2019 des Deutschen Reanimationsregisters. Abgerufen am 3. August 2020.
- ↑ a b c d e Gavin D. Perkins, u. a.: Erweiterte lebensrettende Maßnahmen für Erwachsene. In: Notfall & Rettungsmedizin. Band 24, Nr. 4, 8. Juni 2021, S. 406–446, doi:10.1007/s10049-021-00893-x.
- ↑ A. Ocklitz: Künstliche Beatmung mit technischen Hilfsmitteln schon vor 5000 Jahren? In: Anaesthesist. 45(1), Jan 1996, S. 19–21. PMID 8678274.
- ↑ 2. Buch der Könige, 4, 32–35 (2 Kön 4,32 EU)
- ↑ (2 Kön 13,20 EU), (Apostelgeschichte 9,37 EU), (Lukas 7,11 EU), (Lukas 8,41 EU), (Johannes 11,1 EU).
- ↑ Heinrich L’Allemand: Wiederbelebung. 1973, S. 217.
- ↑ K. Wolff: Geschichte der Medizin. edition medizin, S. 8, 9 und 17.
- ↑ Heinrich L’Allemand: Wiederbelebung. 1973, S. 218.
- ↑ Barbara I. Tshisuaka: Portal, Antoine Baron. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1176.
- ↑ J. M. Schosulan: Gründlicher Unterricht für das Landvolk. Wien 1786.
- ↑ J. N. Schosulan: Anleitung, alle Arten des Scheintodes auf die faßlichste und sicherste Art zu erkennen, die Unglücklichen wiederzubeleben, besonders für Nichtärzte. Wien 1803.
- ↑ Heinrich L’Allemand: Wiederbelebung. 1973, S. 218.
- ↑ Geschichte der modernen Notfallmedizin, ADAC.
- ↑ Heinrich L’Allemand: Wiederbelebung. 1973, S. 218 f.
- ↑ H. R. Silvester: A new method of resuscitating still-born children and of restoring persons apparently drowned or dead. In: BMJ. 2, 1858, S. 576–579.
- ↑ Heinrich L’Allemand: Wiederbelebung. 1973, S. 219.
- ↑ Barbara I. Tshisuaka: Tuffier, Théodore. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1424.
- ↑ Heinrich L’Allemand: Wiederbelebung. 1973, S. 220–221.
- ↑ Anna Fischer-Dückelmann: Die Frau als Hausärztin – ein ärztliches Nachschlagebuch. Süddeutsches Verlags-Institut, München 1922 (Vorwort von 1901).
- ↑ Otto Mayrhofer: Gedanken zum 150. Geburtstag der Anästhesie. In: Der Anaesthesist. Band 45, 1996, S. 881–883, hier: S. 883.
- ↑ Hundereanimationsfilm der Sowjetunion, 1940; archive.org.
- ↑ D. G. Greene, R. O. Bauer, C. D. Janney, J. O. Elam: Expired air resuscitation in paralyzed human subjects. In: J Appl Physiol., 11, 1957, S. 313–318.
- ↑ W. B. Kouwenhoven, J. R. Jude, G. G. Knickerbocker: Closed chest cardiac massage. In: JAMA, 173, 1960, S. 1064–1067.
- ↑ J. R. Jude, W. B. Kouwenhoven und G. Knickerbocker in J. Amer. med. Ass. Band 178, 1961, S. 1063, und in Ann. Surg. Band 154, 1961, S. 311.
- ↑ Heinrich L’Allemand: Wiederbelebung. 1973, S. 223.
- ↑ P. Safar, T. C. Brown, W. J. Holtey, R. J. Wilder: Ventilation and circulation with closed-chest cardiac massage in man. In: JAMA. 176, 1961, S. 574–576. PMID 13745343.
- ↑ Die Erfindung des Ambu-Beutels. ( des vom 28. Oktober 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., von Ambu
- ↑ C. S. Beck, W. H. Pritchard, H. S. Fell: Ventricular fibrillation of long duration abolished by electric shock. In: JAMA. 135, 1947, S. 985–986.
- ↑ B. Lown, R. Amarasingham, J. Neuman: New method for terminating cardiac arrhythmias. Use of synchronized capacitor discharge. In: JAMA. 182, 1962, S. 548–555. PMID 13931298.
- ↑ N. L. Gurvich, S. G. Yuniev: Restoration of a regular rhythm in the mammalian fibrillating heart. In: Am Rev Sov Med. 3, 1946, S. 236.
- ↑ Walied Abdulla: Interdisziplinäre Intensivmedizin. Urban & Fischer, München u. a. 1999, ISBN 3-437-41410-0, 5.
- ↑ Karl H. Lindner, Wolfgang Dick, P. Lotz, E. Pfenninger: Abdominale Kompression und PEEP-Beatmung während der kardiopulmonalen Reanimation. In: Der Anaesthesist. Band 33, Heft 1, Januar 1984, S. 20–30.
- ↑ Dennis Ballwieser: Mobile Herz-Lungen-Maschine: Klinik to go. Spiegel Online, 23. November 2012.
- ↑ M. Hassmann: Cardiopulmonale Reanimation mit einem Kompressions-Ventilations-Verhältnis von 100:5 und 30:2: Einfluss auf den Gasaustausch im Tiermodell. (PDF; 12 MB)
- ↑ G. A. Ewy: Cardiocerebral resuscitation: the new cardiopulmonary resuscitation. In: Circulation. 111(16), 26. Apr 2005, S. 2134–2142. PMID 15851620.
- ↑ SOS-KANTO study group: Cardiopulmonary resuscitation by bystanders with chest compression only (SOS-KANTO): an observational study. In: The Lancet. 369(9565), 17. Mar 2007, S. 920–926. PMID 17368153
- ↑ Stellungnahme ( vom 1. Juli 2007 im Internet Archive) des European Resuscitation Council (ERC) bezüglich der „Compression-only CPR Studie“
- ↑ SOS-KANTO Study Group: Cardiopulmonary resuscitation by bystanders with chest compression only (SOS-KANTO): an observational study. In: Lancet. 369, 2007, S. 920–926.
- ↑ T. Iwami, T. Kawamura, A. Hiraide u. a.: Effectiveness of bystander-initiated cardiac-only resuscitation for patients with out-of-hospital cardiac arrest. In: Circulation. 116, 2007, S. 2900–2907.
- ↑ Mack Sheraton et al.: Effectiveness of Mechanical Chest Compression Devices over Manual Cardiopulmonary Resuscitation: A Systematic Review with Meta-analysis and Trial Sequential Analysis. In: Western Journal of Emergency Medicine. Band 22, Nr. 4, Juli 2021, S. 810–819, doi:10.5811/westjem.2021.3.50932, PMID 35353993, PMC 8328162 (freier Volltext).
- ↑ Cheng-Ying Chiang et al.: Comparison between Prehospital Mechanical Cardiopulmonary Resuscitation (CPR) Devices and Manual CPR for Out-of-Hospital Cardiac Arrest: A Systematic Review, Meta-Analysis, and Trial Sequential Analysis. In: Journal of Clinical Medicine. Band 11, Nr. 5, März 2022, S. 1448, doi:10.3390/jcm11051448, PMID 35268537, PMC 8911115 (freier Volltext).
- ↑ Anatol Prinzing, Stefan Eichhorn, Marcus-André Deutsch, Ruediger Lange, Markus Krane: Cardiopulmonary resuscitation using electrically driven devices: a review. In: Journal of Thoracic Disease. Band 7, Nr. 10, Oktober 2015, ISSN 2072-1439, S. E459–E467, doi:10.3978/j.issn.2072-1439.2015.10.40, PMID 26623121, PMC 4635271 (freier Volltext).
- ↑ J. Wnent, J. T. Gräsner, Stephan Seewald, S. Brenner u. a.: Jahresbericht des Deutschen Reanimationsregisters. In: Anästhesiologie & Intensivmedizin. Band 60, 2019, S. V91–C93.